名校
1 . 我国对世界郑重承诺:2030年前实现碳达峰,2060年前实现碳中和,而研发 的碳捕捉和碳利用技术则是关键。
的碳捕捉和碳利用技术则是关键。
Ⅰ. 的捕集:
的捕集:
(1) 属于
属于_______ 分子(填“极性”或“非极性”),其晶体(干冰)属于_______ 晶体。
(2)用饱和 溶液做吸收剂“捕集”
溶液做吸收剂“捕集” 。若所得溶液pH=l0,则溶液中
。若所得溶液pH=l0,则溶液中
_______ (室温下, 的
的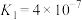 ;
; );若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式
);若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式_______ 。
(3)聚合离子液体是目前广泛研究的 吸附剂。
吸附剂。结合下图 分析聚合离子液体吸附 的有利条件是
的有利条件是_______ 。 的转化:
的转化:
 、
、 重整制合成气CO和
重整制合成气CO和 ,是一种有效实现碳达峰、碳中和的关键技术,也是近几年研究的热点之一、回答下列问题:
,是一种有效实现碳达峰、碳中和的关键技术,也是近几年研究的热点之一、回答下列问题:
已知:甲烷、二氧化碳重整工艺的相关反应如下:
①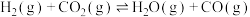

②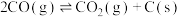
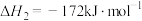
③
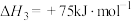
④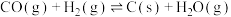
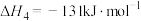
(4)重整反应 的发生条件是
的发生条件是_______ 填(“高温自发”“低温自发”或“任何温度下都自发”)。
(5)在恒压p=100kPa、初始投料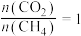 的条件下,甲烷、二氧化碳重整制合成气的过程中各平衡组分的物质的量随温度的变化如图所示。
的条件下,甲烷、二氧化碳重整制合成气的过程中各平衡组分的物质的量随温度的变化如图所示。 减小,积碳含量
减小,积碳含量_______ (填“增大”或“减小”)。
②在630℃时,反应 的平衡常数
的平衡常数
_______  (
( 是以分压表示的平衡常数,已知分压=总压×物质的量分数)。
是以分压表示的平衡常数,已知分压=总压×物质的量分数)。
Ⅲ.CO2的创新应用
(6)某团队提出 耦合乙烷催化脱氢制乙烯技术。用Cr/SSZ-13为催化剂、
耦合乙烷催化脱氢制乙烯技术。用Cr/SSZ-13为催化剂、 作为温和的氧化剂用于乙烷脱氢制备乙烯可以避免乙烷深度氧化、实现
作为温和的氧化剂用于乙烷脱氢制备乙烯可以避免乙烷深度氧化、实现 资源化利用、避免将
资源化利用、避免将 氧化为更高价等优势。催化条件下,乙烷裂解主要引发反应为:
氧化为更高价等优势。催化条件下,乙烷裂解主要引发反应为: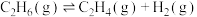 ,同时Cr的价态由
,同时Cr的价态由 升高
升高 。推测配位不饱和
。推测配位不饱和 催化
催化 耦合
耦合 脱氢反应过程如图所示,补全图中画框部分
脱氢反应过程如图所示,补全图中画框部分_______ 。
 的碳捕捉和碳利用技术则是关键。
的碳捕捉和碳利用技术则是关键。Ⅰ.
 的捕集:
的捕集:(1)
 属于
属于(2)用饱和
 溶液做吸收剂“捕集”
溶液做吸收剂“捕集” 。若所得溶液pH=l0,则溶液中
。若所得溶液pH=l0,则溶液中
 的
的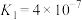 ;
; );若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式
);若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式(3)聚合离子液体是目前广泛研究的
 吸附剂。
吸附剂。 的有利条件是
的有利条件是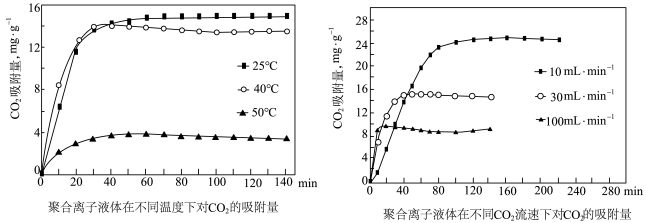
 的转化:
的转化: 、
、 重整制合成气CO和
重整制合成气CO和 ,是一种有效实现碳达峰、碳中和的关键技术,也是近几年研究的热点之一、回答下列问题:
,是一种有效实现碳达峰、碳中和的关键技术,也是近几年研究的热点之一、回答下列问题:已知:甲烷、二氧化碳重整工艺的相关反应如下:
①
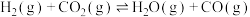

②
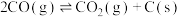
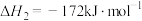
③

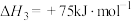
④
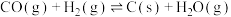
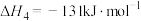
(4)重整反应
 的发生条件是
的发生条件是(5)在恒压p=100kPa、初始投料
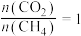 的条件下,甲烷、二氧化碳重整制合成气的过程中各平衡组分的物质的量随温度的变化如图所示。
的条件下,甲烷、二氧化碳重整制合成气的过程中各平衡组分的物质的量随温度的变化如图所示。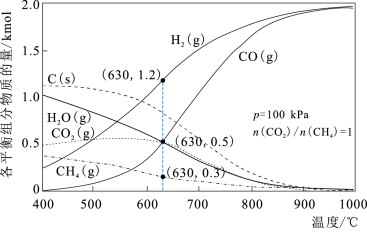
 减小,积碳含量
减小,积碳含量②在630℃时,反应
 的平衡常数
的平衡常数
 (
( 是以分压表示的平衡常数,已知分压=总压×物质的量分数)。
是以分压表示的平衡常数,已知分压=总压×物质的量分数)。Ⅲ.CO2的创新应用
(6)某团队提出
 耦合乙烷催化脱氢制乙烯技术。用Cr/SSZ-13为催化剂、
耦合乙烷催化脱氢制乙烯技术。用Cr/SSZ-13为催化剂、 作为温和的氧化剂用于乙烷脱氢制备乙烯可以避免乙烷深度氧化、实现
作为温和的氧化剂用于乙烷脱氢制备乙烯可以避免乙烷深度氧化、实现 资源化利用、避免将
资源化利用、避免将 氧化为更高价等优势。催化条件下,乙烷裂解主要引发反应为:
氧化为更高价等优势。催化条件下,乙烷裂解主要引发反应为: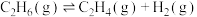 ,同时Cr的价态由
,同时Cr的价态由 升高
升高 。推测配位不饱和
。推测配位不饱和 催化
催化 耦合
耦合 脱氢反应过程如图所示,补全图中画框部分
脱氢反应过程如图所示,补全图中画框部分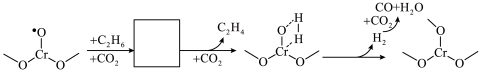
您最近一年使用:0次
名校
2 . 乙酸是基本的有机化工原料。
I.乙酸制氢具有重要意义,制氢过程发生如下反应等:
主反应i:CH3COOH(g) 2CO(g)+2H2(g) △H1=+213.7kJ•mol-1
2CO(g)+2H2(g) △H1=+213.7kJ•mol-1
副反应ii:CH3COOH(g) CH4(g)+CO2(g) △H2=-33.5kJ•mol-1
CH4(g)+CO2(g) △H2=-33.5kJ•mol-1
(1)在容积相同的密闭容器中,均加入1molCH3COOH(g) (g),在相同时间测得温度与气体产率的关系如图所示:
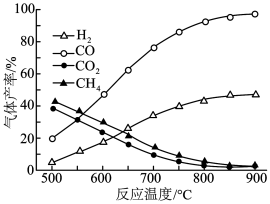
①约650℃之前,氢气产率低于甲烷的原因可能是_______ 。
②根据图像中相关物质的产率,推测该容器还发生了其它的副反应,该副反应的化学方程式为_______ 。
(2)T℃时、保持恒压(akPa)条件下,乙酸制氢反应达到平衡(假设只发生反应i和ii),此时测得混合气体中乙酸的体积分数为20%,乙酸的转化率为60%,则反应i的平衡常数Kp为_______ (kPa)3(Kp为以分压表示的平衡常数)。
Ⅱ.研究CH3COOH在电解质溶液里的离子平衡也有重要意义[已知Ka(CH3COOH)=1.75×10-5]。
(3)①常温下,某同学用酸碱中和滴定法测定某品牌白醋的醋酸浓度,当醋酸与氢氧化钠恰好完全反应时,测得溶液中 =
=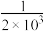 ,则此时溶液中的pH约为
,则此时溶液中的pH约为_______ (保留整数)。
②常温下,向25.00mL0.1mol/L氢氧化钠溶液中滴加0.2mol/L醋酸溶液至25.00mL,此时溶液中v(CH3COO-)+2c(OH-)=c(CH3COOH)+_______ [用c(B)表示]。
③已知常温下H2SO3的Ka1=1.4×10-2,Ka2=6.0×10-8,则足量醋酸与Na2SO3溶液反应的离子方程式为_______ 。
I.乙酸制氢具有重要意义,制氢过程发生如下反应等:
主反应i:CH3COOH(g)
 2CO(g)+2H2(g) △H1=+213.7kJ•mol-1
2CO(g)+2H2(g) △H1=+213.7kJ•mol-1副反应ii:CH3COOH(g)
 CH4(g)+CO2(g) △H2=-33.5kJ•mol-1
CH4(g)+CO2(g) △H2=-33.5kJ•mol-1(1)在容积相同的密闭容器中,均加入1molCH3COOH(g) (g),在相同时间测得温度与气体产率的关系如图所示:

①约650℃之前,氢气产率低于甲烷的原因可能是
②根据图像中相关物质的产率,推测该容器还发生了其它的副反应,该副反应的化学方程式为
(2)T℃时、保持恒压(akPa)条件下,乙酸制氢反应达到平衡(假设只发生反应i和ii),此时测得混合气体中乙酸的体积分数为20%,乙酸的转化率为60%,则反应i的平衡常数Kp为
Ⅱ.研究CH3COOH在电解质溶液里的离子平衡也有重要意义[已知Ka(CH3COOH)=1.75×10-5]。
(3)①常温下,某同学用酸碱中和滴定法测定某品牌白醋的醋酸浓度,当醋酸与氢氧化钠恰好完全反应时,测得溶液中
 =
=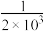 ,则此时溶液中的pH约为
,则此时溶液中的pH约为②常温下,向25.00mL0.1mol/L氢氧化钠溶液中滴加0.2mol/L醋酸溶液至25.00mL,此时溶液中v(CH3COO-)+2c(OH-)=c(CH3COOH)+
③已知常温下H2SO3的Ka1=1.4×10-2,Ka2=6.0×10-8,则足量醋酸与Na2SO3溶液反应的离子方程式为
您最近一年使用:0次
2023-06-11更新
|
78次组卷
|
2卷引用:安徽省池州市第一中学(A10联盟)2022-2023学年高二下学期6月月考化学试题
3 . Ⅰ.甲酸(HCOOH)又名蚊酸,是一种常见的弱酸,常温下甲酸的电离平衡常数 (已知
(已知 )。
)。
(1)设计实验证明甲酸为弱酸,下列实验设计合理的是___________ (填字母)。
A.将甲酸溶液滴入 溶液中,观察是否有气泡生成
溶液中,观察是否有气泡生成
B.向体积相同、pH相同的盐酸和甲酸溶液中加入足量Zn,比较溶解Zn的质量
C.取一定浓度的甲酸钠溶液,测其pH
(2)常温下,将 的甲酸钠(HCOONa)溶液和
的甲酸钠(HCOONa)溶液和 的甲酸溶液等体积混合配成一种缓冲溶液。
的甲酸溶液等体积混合配成一种缓冲溶液。
①常温下, 的水解平衡常数
的水解平衡常数
___________ 。
②该混合溶液的pH约为___________ 。
③该混合溶液中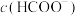
___________ (填“>”“=”或“<”) 。
。
Ⅱ.在一定条件下, 可还原氮氧化物,消除氮氧化物污染。工业上,常用
可还原氮氧化物,消除氮氧化物污染。工业上,常用 和
和 在催化剂作用下合成
在催化剂作用下合成 。在催化剂作用下,
。在催化剂作用下,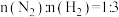 ,发生反应,平衡混合气中
,发生反应,平衡混合气中 的物质的量分数随温度和压强的变化关系如图所示。
的物质的量分数随温度和压强的变化关系如图所示。

(3)该反应的平衡常数Ka___________ (填“<”“=”或“>”)Kb。
(4)500℃、压强为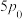 时,
时, 的转化率为
的转化率为___________ %(保留三位有效数字)。
 (已知
(已知 )。
)。(1)设计实验证明甲酸为弱酸,下列实验设计合理的是
A.将甲酸溶液滴入
 溶液中,观察是否有气泡生成
溶液中,观察是否有气泡生成B.向体积相同、pH相同的盐酸和甲酸溶液中加入足量Zn,比较溶解Zn的质量
C.取一定浓度的甲酸钠溶液,测其pH
(2)常温下,将
 的甲酸钠(HCOONa)溶液和
的甲酸钠(HCOONa)溶液和 的甲酸溶液等体积混合配成一种缓冲溶液。
的甲酸溶液等体积混合配成一种缓冲溶液。①常温下,
 的水解平衡常数
的水解平衡常数
②该混合溶液的pH约为
③该混合溶液中
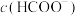
 。
。Ⅱ.在一定条件下,
 可还原氮氧化物,消除氮氧化物污染。工业上,常用
可还原氮氧化物,消除氮氧化物污染。工业上,常用 和
和 在催化剂作用下合成
在催化剂作用下合成 。在催化剂作用下,
。在催化剂作用下,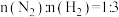 ,发生反应,平衡混合气中
,发生反应,平衡混合气中 的物质的量分数随温度和压强的变化关系如图所示。
的物质的量分数随温度和压强的变化关系如图所示。
(3)该反应的平衡常数Ka
(4)500℃、压强为
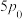 时,
时, 的转化率为
的转化率为
您最近一年使用:0次
4 . 雪碧是常见的碳酸型饮料。其中所含酸性物质包括:碳酸、柠檬酸、苯甲酸。 时,上述三种酸的电离常数如表所示:
时,上述三种酸的电离常数如表所示:
(1)三种酸的酸性由强到弱的顺序为_______ 。
(2)水存在电离平衡,下列能促进水的电离,且溶液显碱性的是_______ (填标号)。
a.通入氨气 b.加入 固体 c.加入苯甲酸钠
固体 c.加入苯甲酸钠 固体 d.加热至
固体 d.加热至
(3) 时,等物质的量浓度的苯甲酸
时,等物质的量浓度的苯甲酸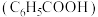 和苯甲酸钠
和苯甲酸钠 的混合溶液的
的混合溶液的
_______ (填“>”“<”或“=”)7,溶液中离子浓度由大到小的顺序是_______ 。
(4) 时,
时, 的柠檬酸与
的柠檬酸与 溶液中由水电离出的
溶液中由水电离出的 之比是
之比是_______ 。
(5)可乐含有比雪碧更刺激的酸性物质——磷酸(化学式为 ,沸点高、难挥发)。长期过量饮用可乐会破坏牙釉质(羟基磷酸钙
,沸点高、难挥发)。长期过量饮用可乐会破坏牙釉质(羟基磷酸钙 ),造成龋齿。牙齿表面存在平衡:
),造成龋齿。牙齿表面存在平衡: 。
。
①结合平衡移动原理解释造成龋齿的原因是_______ 。
②室温下,向磷酸溶液中滴加 溶液,含磷各微粒在溶液中的物质的量分数与
溶液,含磷各微粒在溶液中的物质的量分数与 的关系如图示。
的关系如图示。
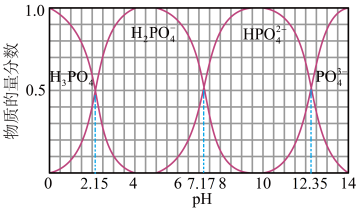
 的电离平衡常数
的电离平衡常数
_______ 。 ,溶液中
,溶液中
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
 时,上述三种酸的电离常数如表所示:
时,上述三种酸的电离常数如表所示:| 化学式 | 苯甲酸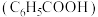 | 碳酸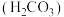 | 柠檬酸(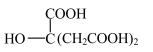 ) ) |
| 电离常数 | 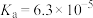 | 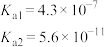 |  |
(1)三种酸的酸性由强到弱的顺序为
(2)水存在电离平衡,下列能促进水的电离,且溶液显碱性的是
a.通入氨气 b.加入
 固体 c.加入苯甲酸钠
固体 c.加入苯甲酸钠 固体 d.加热至
固体 d.加热至
(3)
 时,等物质的量浓度的苯甲酸
时,等物质的量浓度的苯甲酸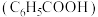 和苯甲酸钠
和苯甲酸钠 的混合溶液的
的混合溶液的
(4)
 时,
时, 的柠檬酸与
的柠檬酸与 溶液中由水电离出的
溶液中由水电离出的 之比是
之比是(5)可乐含有比雪碧更刺激的酸性物质——磷酸(化学式为
 ,沸点高、难挥发)。长期过量饮用可乐会破坏牙釉质(羟基磷酸钙
,沸点高、难挥发)。长期过量饮用可乐会破坏牙釉质(羟基磷酸钙 ),造成龋齿。牙齿表面存在平衡:
),造成龋齿。牙齿表面存在平衡: 。
。①结合平衡移动原理解释造成龋齿的原因是
②室温下,向磷酸溶液中滴加
 溶液,含磷各微粒在溶液中的物质的量分数与
溶液,含磷各微粒在溶液中的物质的量分数与 的关系如图示。
的关系如图示。
 的电离平衡常数
的电离平衡常数
 ,溶液中
,溶液中
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
您最近一年使用:0次
名校
5 . 回答下列问题:
(1)室温下,下列______(填选项字母)的水溶液中 可能是
可能是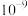 mol·L
mol·L 。
。
(2)常温下,将pH=13的NaOH溶液a L分别与下列溶液混合后溶液均呈中性。
① mol·L
mol·L 的醋酸b L;
的醋酸b L;
②浓度为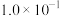 mol·L
mol·L 的醋酸c L;
的醋酸c L;
则a、b、c之间由大到小的关系是______ 。
(3)已知室温时,0.1 mol·L 的某一元酸HA在水中有0.1%发生电离(
的某一元酸HA在水中有0.1%发生电离( ),回答下列各问题:
),回答下列各问题:
①该溶液的pH=______ .
②升高温度时, 将
将______ (填“增大”、“减小”或“不变”),pH将_______ (填“增大”、“减小”或“不变”)。
③由HA电离出的 约为水电离出的
约为水电离出的 的
的______ 倍。
(4)某学生用0.1 mol/L HCl溶液滴定未知浓度的NaOH溶液,其操作可分解为如下几步:
(A)移取20.00 mL待测的NaOH溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的酸式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准HCl溶液注入酸式滴定管至0刻度以上2-3 cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准盐酸溶液滴定至终点,记下滴定管液面的刻度
①正确操作的顺序是B→______ →F(用序号字母填写)。
②上述(A)操作之前,如锥形瓶有少量蒸馏水,则对测定结果的影响是______ (填“偏大”、“偏小”或“不变”)。判断到达终点的现象是再滴半滴标准溶液时锥形瓶中溶液______ 。
(1)室温下,下列______(填选项字母)的水溶液中
 可能是
可能是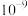 mol·L
mol·L 。
。A. | B. | C.NaOH | D.NaCl |
①
 mol·L
mol·L 的醋酸b L;
的醋酸b L;②浓度为
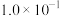 mol·L
mol·L 的醋酸c L;
的醋酸c L;则a、b、c之间由大到小的关系是
(3)已知室温时,0.1 mol·L
 的某一元酸HA在水中有0.1%发生电离(
的某一元酸HA在水中有0.1%发生电离( ),回答下列各问题:
),回答下列各问题:①该溶液的pH=
②升高温度时,
 将
将③由HA电离出的
 约为水电离出的
约为水电离出的 的
的(4)某学生用0.1 mol/L HCl溶液滴定未知浓度的NaOH溶液,其操作可分解为如下几步:
(A)移取20.00 mL待测的NaOH溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的酸式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准HCl溶液注入酸式滴定管至0刻度以上2-3 cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准盐酸溶液滴定至终点,记下滴定管液面的刻度
①正确操作的顺序是B→
②上述(A)操作之前,如锥形瓶有少量蒸馏水,则对测定结果的影响是
您最近一年使用:0次
2023-02-16更新
|
79次组卷
|
2卷引用:安徽省池州市普通高中2022-2023学年高二下学期开学考化学试题
名校
6 . 二氧化碳的捕获、利用是实现碳中和的一个重要战略方向。回答下列问题:
(1)已知:常温下,反应CaO(s)+CO2(g) CaCO3(s)能自发进行。则该反应为
CaCO3(s)能自发进行。则该反应为____ (填“吸热”或“放热”)反应;上述反应达到平衡后,若其他条件不变,增大CaO的用量,CO2的转化率将____ (填“增大”“减小”或“不变”)。
(2)工业上以CO2和H2为原料合成CH3OH涉及的主要反应如下:
反应I.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49kJ·mol-1
反应II.CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41kJ·mol-1
CO(g)+H2O(g) △H2=+41kJ·mol-1
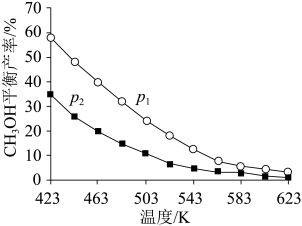
①将反应物混合气按进料比n(CO2):n(H2)=1:3通入反应装置,选择合适的催化剂发生反应。
不同温度和压强下,CH3OH平衡产率如图所示。则图中的压强p1____ (填“>”“=”或“<”)p2,推断的依据是____ 。
②T℃时,在体积为V的密闭容器中,反应I、II均达到化学平衡,CO2转化率为25%,且生成等物质的量的CH3OH和CO,则该温度下反应II的平衡常数的值为_____ (用分数表示)。
(3)调节溶液pH可实现工业废气中CO2的捕获和释放。已知20℃时碳酸的电离常数为Ka1、Ka2,当溶液pH=11时,c(H2CO3):c(HCO ):c(CO
):c(CO )=1:
)=1:____ :____ 。(用Ka1、Ka2表示)
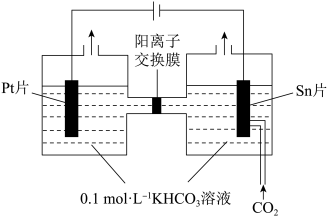
(4)电解CO2制HCOOH的原理如图所示,写出在Sn片上发生的电极反应式:____ 。
(1)已知:常温下,反应CaO(s)+CO2(g)
 CaCO3(s)能自发进行。则该反应为
CaCO3(s)能自发进行。则该反应为(2)工业上以CO2和H2为原料合成CH3OH涉及的主要反应如下:
反应I.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-49kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49kJ·mol-1反应II.CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41kJ·mol-1
CO(g)+H2O(g) △H2=+41kJ·mol-1①将反应物混合气按进料比n(CO2):n(H2)=1:3通入反应装置,选择合适的催化剂发生反应。
不同温度和压强下,CH3OH平衡产率如图所示。则图中的压强p1

②T℃时,在体积为V的密闭容器中,反应I、II均达到化学平衡,CO2转化率为25%,且生成等物质的量的CH3OH和CO,则该温度下反应II的平衡常数的值为
(3)调节溶液pH可实现工业废气中CO2的捕获和释放。已知20℃时碳酸的电离常数为Ka1、Ka2,当溶液pH=11时,c(H2CO3):c(HCO
 ):c(CO
):c(CO )=1:
)=1:(4)电解CO2制HCOOH的原理如图所示,写出在Sn片上发生的电极反应式:

您最近一年使用:0次
2022-07-14更新
|
109次组卷
|
3卷引用:安徽省淮南市第一中学2023-2024学年高二下学期开学考试化学试题
解题方法
7 . 碳酸钴(CoCO3)是一种红色粉末,常用作催化剂、选矿剂和家装涂料的颜料。以含钴废渣(主要成分为CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
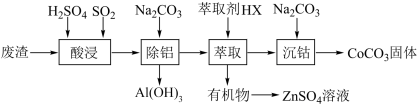
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol· L-1计算)。
回答下列问题:
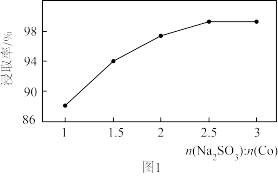
(1)“酸浸”时通入SO2的目的是_________ ,反应的离子方程式为________________ 。此处的SO2也可以用Na2SO3代替,Na2SO3用量和钴的浸取率之间的关系如图1所示,则较为适宜的条件为__________ 。
(2)除铝时,应控制溶液的pH范围为_______ ,除铝的离子方程式为_____________ 。
(3)“萃取”过程可表示为ZnSO4 (水层) +2HX(有机层) ZnX2(有机层) + H2SO4(水层),由有机层获取ZnSO4溶液的操作是
ZnX2(有机层) + H2SO4(水层),由有机层获取ZnSO4溶液的操作是_______________ 。
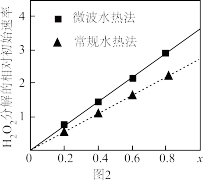
(4)用得到的CoCO3等为原料,采用微波水热法和常规水热法发可以制得两种CoxNi(1-x) Fe2O4,(其中Co、Ni均为+2价),均可用作H2O2分解的催化剂,有较高的活性。图2是两种不同方法制得的CoxNi(1-x) Fe2O4在10° C时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知:_______________ 法制取得到的催化剂活性更高,由此推测Co2+、Ni2+两种离子中催化效果更好的是_________ 。
(5)用纯碱沉淀转化法也可以从草酸钴(CoC2O4)废料中得到CoCO3,向含有CoC2O4固体的溶液中滴加Na2CO3溶液,当有CoCO3沉淀生成时,溶液中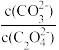 =
=______ (保留两位有效数字)。[已知:Ksp(CoC2O4)=6.3×10-8,Ksp(CoCO3)=1.4×10-13]

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol· L-1计算)。
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
回答下列问题:
(1)“酸浸”时通入SO2的目的是

(2)除铝时,应控制溶液的pH范围为
(3)“萃取”过程可表示为ZnSO4 (水层) +2HX(有机层)
 ZnX2(有机层) + H2SO4(水层),由有机层获取ZnSO4溶液的操作是
ZnX2(有机层) + H2SO4(水层),由有机层获取ZnSO4溶液的操作是(4)用得到的CoCO3等为原料,采用微波水热法和常规水热法发可以制得两种CoxNi(1-x) Fe2O4,(其中Co、Ni均为+2价),均可用作H2O2分解的催化剂,有较高的活性。图2是两种不同方法制得的CoxNi(1-x) Fe2O4在10° C时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知:

(5)用纯碱沉淀转化法也可以从草酸钴(CoC2O4)废料中得到CoCO3,向含有CoC2O4固体的溶液中滴加Na2CO3溶液,当有CoCO3沉淀生成时,溶液中
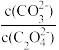 =
=
您最近一年使用:0次
8 . 2021年我国制氢量位居世界第一,煤的气化是一种重要的制氢途径。回答下列问题:
(1)在一定温度下,向体积固定的密闭容器中加入足量的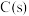 和
和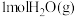 ,起始压强为
,起始压强为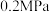 时,发生下列反应生成水煤气:
时,发生下列反应生成水煤气:
Ⅰ.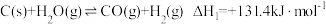
Ⅱ.
①下列说法正确的是_______ ;
A.平衡时向容器中充入惰性气体,反应Ⅰ的平衡逆向移动
B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.平衡时 的体积分数可能大于
的体积分数可能大于
D.将炭块粉碎,可加快反应速率
②反应平衡时, 的转化率为
的转化率为 ,CO的物质的量为
,CO的物质的量为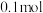 。此时,整个体系
。此时,整个体系_______ (填“吸收”或“放出”)热量_______ kJ,反应Ⅰ的平衡常数
_______ (以分压表示,分压=总压×物质的量分数)。
(2)一种脱除和利用水煤气中 方法的示意图如下:
方法的示意图如下:
 溶液吸收一定量的
溶液吸收一定量的 后,
后, ,则该溶液的
,则该溶液的
_______ (该温度下 的
的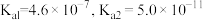 );
);
②再生塔中产生 的离子方程式为
的离子方程式为_______ ;
③利用电化学原理,将 电催化还原为
电催化还原为 ,阴极反应式为
,阴极反应式为_______ 。
(1)在一定温度下,向体积固定的密闭容器中加入足量的
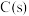 和
和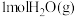 ,起始压强为
,起始压强为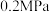 时,发生下列反应生成水煤气:
时,发生下列反应生成水煤气:Ⅰ.
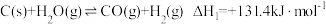
Ⅱ.

①下列说法正确的是
A.平衡时向容器中充入惰性气体,反应Ⅰ的平衡逆向移动
B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.平衡时
 的体积分数可能大于
的体积分数可能大于
D.将炭块粉碎,可加快反应速率
②反应平衡时,
 的转化率为
的转化率为 ,CO的物质的量为
,CO的物质的量为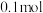 。此时,整个体系
。此时,整个体系
(2)一种脱除和利用水煤气中
 方法的示意图如下:
方法的示意图如下: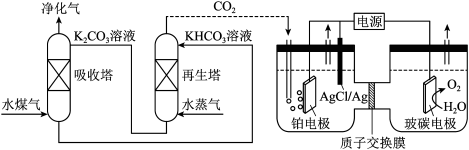
 溶液吸收一定量的
溶液吸收一定量的 后,
后, ,则该溶液的
,则该溶液的
 的
的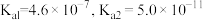 );
);②再生塔中产生
 的离子方程式为
的离子方程式为③利用电化学原理,将
 电催化还原为
电催化还原为 ,阴极反应式为
,阴极反应式为
您最近一年使用:0次
2022-06-10更新
|
11370次组卷
|
21卷引用:安徽省六安第一中学2022-2023学年高二上学期期末考试化学试题
安徽省六安第一中学2022-2023学年高二上学期期末考试化学试题2022年新高考湖南化学高考真题(已下线)2022年湖南卷高考真题变式题(15-19)(已下线)专题14 化学反应原理综合题-2022年高考真题模拟题分项汇编(已下线)专题15 化学反应原理综合题-三年(2020-2022)高考真题分项汇编(已下线)考点22 化学平衡状态与化学平衡移动-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题18 化学反应原理综合题-备战2023年高考化学母题题源解密(广东卷)广东省汕头市金山中学2022-2023学年高三上学期第二次月考化学试题山东省枣庄市第三中学2022-2023学年高三上学期期中考试化学试题广东省佛山市顺德区第一中学2023届高三上学期12月综合训练化学试题山东省潍坊市昌乐第一中学2022-2023学年高二上学期期末拉练二化学试题(已下线)回归教材重难点08 聚焦热、速率、平衡-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)专题17 原理综合题(已下线)专题17 原理综合题(已下线)第20练 化学反应原理综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题14 化学反应原理综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题15 化学反应原理综合题-2023年高考化学真题题源解密(全国通用)模块综合检测卷2四川省眉山市彭山区第一中学2023-2024学年高三上学期11月月考理综试题 河南省南阳市第一中学校2024届高三上学期阶段检测化学试题(12月)湖南省浏阳景雅高级中学2024届高三下学期5月全真仿真模拟考试化学试题
9 . 某小组从反应速率和产物角度探究Mg与NaHCO3溶液反应。
实验I、25°C, 相同镁条分别与下列试剂反应
(1)已知: Mg(OH)2固体致密,易包裹在金属表面成膜。根据上述现象,推测在实验ii中。
①Mg可以提高 的电离程度,原因是
的电离程度,原因是___________ ;
②浑浊的主要原因是产生了___________ (填化学式) ;
③实验ii中产生气泡的速率快于实验i的原因可能是___________ 。
(2)补充实验II,证实(1)的推测:
①小组设计实验iii 的目的是___________ ; 甲同学结合实验iv的现象认为可以不必进行实验iii,他的理由是___________ ;
②实验ii生成气体的速率快于实验iv,原因可能是___________ ;
③查资料知 +Mg2+
+Mg2+  [Mg(HCO3)]+,请从平衡移动的角度解释实验ii产生气体速率更快的原因
[Mg(HCO3)]+,请从平衡移动的角度解释实验ii产生气体速率更快的原因___________ 。
实验I、25°C, 相同镁条分别与下列试剂反应
| 序号 | 试剂 | 浓度(mol·L-1) | 体积(mL) | pH | 现象 |
| i | H2O | —— | 7.5 | 7 | 镁条表面有微量气泡附着 |
| ii | NaHCO3溶液 | 1.0 | 7.5 | 8.4 | 镁条表面持续产生大量气泡,溶液略显浑浊,点燃气泡有爆鸣声 |
①Mg可以提高
 的电离程度,原因是
的电离程度,原因是②浑浊的主要原因是产生了
③实验ii中产生气泡的速率快于实验i的原因可能是
(2)补充实验II,证实(1)的推测:
| 序号 | 试剂 | 浓度(mol·L-1) | 体积(mL) | pH | 现象 |
| iii | NaNO3溶液 | 1.0 | 7.5 | 7 | 镁条表面有微量气泡附着 |
| iv | Na2CO3溶液 | 0.5 | 7.5 | 11.8 | 持续产生少量气泡,溶液显浑浊 |
②实验ii生成气体的速率快于实验iv,原因可能是
③查资料知
 +Mg2+
+Mg2+  [Mg(HCO3)]+,请从平衡移动的角度解释实验ii产生气体速率更快的原因
[Mg(HCO3)]+,请从平衡移动的角度解释实验ii产生气体速率更快的原因
您最近一年使用:0次
解题方法
10 . 某废催化剂(主要含有WO3、V2O5、V2O4、V2O3、少量杂质Fe2O3、SiO2等)是能源行业产生的难处理多金属危险废物,其回收利用已成为当前研究的热点和重点。一种处理流程如下:
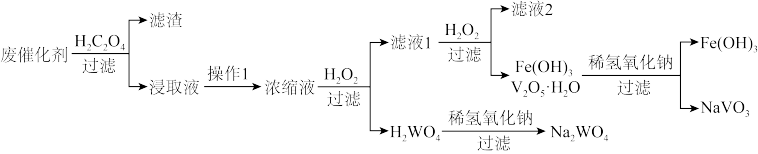
(1)已知草酸晶体(H2C2O4·2H2O)的溶解度随温度的变化如图所示。草酸酸浸时控制温度为90℃,理由是_______ ,实验室中宜选用的加热方式为_______ (“水浴加热”或“油浴加热”)。
(2)已知“浸取液”的主要成分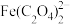 、
、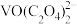 、
、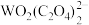 和过量的H2C2O4,滤渣的主要成分是
和过量的H2C2O4,滤渣的主要成分是_______ ;Fe2O3与H2C2O4的反应的离子方程式为_______ 。
(3)“浓缩液”经过两步氧化实现金属元素的分离。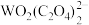 在溶液中存在平衡
在溶液中存在平衡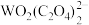
 WO2(C2O4)+
WO2(C2O4)+ ,WO2(C2O4)
,WO2(C2O4)
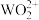 +
+  ,当溶液中的草酸氧化分解率到达67%时,
,当溶液中的草酸氧化分解率到达67%时,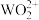 开始水解生成
开始水解生成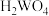 。
。
①写出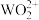 水解的离子方程式
水解的离子方程式_______ ;
②已知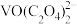 离子在溶液中也存在类似
离子在溶液中也存在类似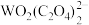 的电离平衡,下列有关
的电离平衡,下列有关 氧化
氧化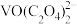 离子生成V2O5·H2O的说法错误的是
离子生成V2O5·H2O的说法错误的是_______ (填标号)。
A.加入 促使
促使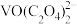 离子的电离平衡正向移动
离子的电离平衡正向移动
B.该过程涉及了2个以上的化学平衡
C.VO2+离子水解生成V2O5·H2O
(4)已知 K1;FeC2O4
K1;FeC2O4 Fe2++
Fe2++ K2,当“滤液1”中
K2,当“滤液1”中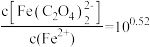 时,
时, 的浓度为
的浓度为_______ mol/L。(已知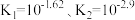 )
)

(1)已知草酸晶体(H2C2O4·2H2O)的溶解度随温度的变化如图所示。草酸酸浸时控制温度为90℃,理由是

(2)已知“浸取液”的主要成分
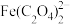 、
、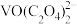 、
、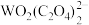 和过量的H2C2O4,滤渣的主要成分是
和过量的H2C2O4,滤渣的主要成分是(3)“浓缩液”经过两步氧化实现金属元素的分离。
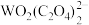 在溶液中存在平衡
在溶液中存在平衡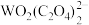
 WO2(C2O4)+
WO2(C2O4)+ ,WO2(C2O4)
,WO2(C2O4)
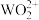 +
+  ,当溶液中的草酸氧化分解率到达67%时,
,当溶液中的草酸氧化分解率到达67%时,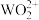 开始水解生成
开始水解生成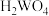 。
。①写出
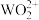 水解的离子方程式
水解的离子方程式②已知
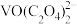 离子在溶液中也存在类似
离子在溶液中也存在类似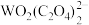 的电离平衡,下列有关
的电离平衡,下列有关 氧化
氧化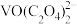 离子生成V2O5·H2O的说法错误的是
离子生成V2O5·H2O的说法错误的是A.加入
 促使
促使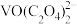 离子的电离平衡正向移动
离子的电离平衡正向移动B.该过程涉及了2个以上的化学平衡
C.VO2+离子水解生成V2O5·H2O
(4)已知
 K1;FeC2O4
K1;FeC2O4 Fe2++
Fe2++ K2,当“滤液1”中
K2,当“滤液1”中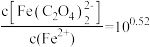 时,
时, 的浓度为
的浓度为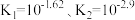 )
)
您最近一年使用:0次
2022-05-04更新
|
910次组卷
|
9卷引用:安徽省淮北市2022届高三第二次模拟考试理科综合化学试题
安徽省淮北市2022届高三第二次模拟考试理科综合化学试题(已下线)专项15 工艺流程综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)(已下线)专题15工艺流程题-2022年高考真题+模拟题汇编(全国卷)(已下线)专题16工艺流程题-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)第二部分 热点专项突破——解题能力稳提升 专项3 结合理论的综合类工艺流程超重点6 高考热点命题素材——过渡金属元素湖南省株洲市攸县第四中学2022-2023学年高三上学期第五次月考化学试题 (已下线)T26-工业流程题



