名校
解题方法
1 . 化学上的缓冲溶液就是外加少量酸、碱后而pH值基本不变的溶液。
I.CH3COOH和CH3COONa的缓冲溶液
1.现有25℃时浓度均为0.10mol/L的CH3COOH和CH3COONa的缓冲溶液,pH=4.76。写出该缓冲溶液中存在的电离平衡方程式___________ 、___________ 。
2.向1.0L上述0.10mol/L的CH3COOH和CH3COONa的缓冲溶液中滴加几滴NaOH稀溶液(忽略溶液体积的变化),发生反应的离子方程式为___________ ,反应后溶液中c(H+)=___________ mol/L。
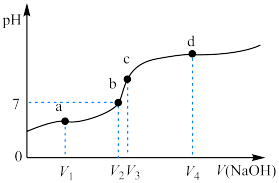
3.向CH3COOH溶液中逐滴加入NaOH溶液,溶液pH与加入NaOH溶液的关系如图所示,a点为反应一半点,a点离子浓度关系由大到小为___________ ;c点恰好完全反应,该处溶液呈碱性的原因为___________ 。
4.CO2的电子式为___________ ,其分子极性为___________ ;电负性C___________ Si(填“>”“=”或者“<”)。
5.人体血液存在H2CO3(CO2)和NaHCO3的缓冲体系,下列说法不正确的是___________ 。
a.代谢产生的H+被 结合形成H2CO3
结合形成H2CO3
b.代谢产生的碱被H+中和,H+又由H2CO3电离
c.血液中的缓冲体系可抵抗大量酸、碱的影响
d.能有效除掉人体正常代谢产生的酸、碱,保持pH的稳定
I.CH3COOH和CH3COONa的缓冲溶液
1.现有25℃时浓度均为0.10mol/L的CH3COOH和CH3COONa的缓冲溶液,pH=4.76。写出该缓冲溶液中存在的电离平衡方程式
2.向1.0L上述0.10mol/L的CH3COOH和CH3COONa的缓冲溶液中滴加几滴NaOH稀溶液(忽略溶液体积的变化),发生反应的离子方程式为
3.向CH3COOH溶液中逐滴加入NaOH溶液,溶液pH与加入NaOH溶液的关系如图所示,a点为反应一半点,a点离子浓度关系由大到小为
4.CO2的电子式为
5.人体血液存在H2CO3(CO2)和NaHCO3的缓冲体系,下列说法不正确的是
a.代谢产生的H+被
 结合形成H2CO3
结合形成H2CO3b.代谢产生的碱被H+中和,H+又由H2CO3电离
c.血液中的缓冲体系可抵抗大量酸、碱的影响
d.能有效除掉人体正常代谢产生的酸、碱,保持pH的稳定
您最近一年使用:0次
2 . 已知25℃时,醋酸、次氯酸、碳酸和亚硫酸的电离平衡常数分别为物质
(1)碳酸一级电离的平衡常数表达式为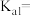
_______ 。
(2)下列四种离子结合 能力最强的是_______。
能力最强的是_______。
(3)酸性强弱:醋酸_______ 次氯酸(填“>”或“<”,下同);经测定,常温下0.1 的醋酸钠溶液的pH小于相同的浓度的次氯酸钠溶液,
的醋酸钠溶液的pH小于相同的浓度的次氯酸钠溶液,_______ (填“能”或“不能”)说明两者的酸性强弱关系。
(4)若保持温度不变,在醋酸溶液中通入少量HCl,则下列物理量变小的是_______。
(5) 和
和 的混合溶液中,
的混合溶液中,
_______ (用微粒符号表示)。
(6)25℃时,pH=1的硫酸与0.02
 溶液中,两者水电离出的氢离子浓度之比为
溶液中,两者水电离出的氢离子浓度之比为_______ 。
| 物质 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数 |  |  | 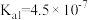 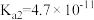 | 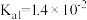 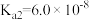 |
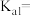
(2)下列四种离子结合
 能力最强的是_______。
能力最强的是_______。A. | B. | C. | D. |
 的醋酸钠溶液的pH小于相同的浓度的次氯酸钠溶液,
的醋酸钠溶液的pH小于相同的浓度的次氯酸钠溶液,(4)若保持温度不变,在醋酸溶液中通入少量HCl,则下列物理量变小的是_______。
A. | B. | C.醋酸的电离平衡常数 | D.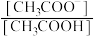 |
 和
和 的混合溶液中,
的混合溶液中,
(6)25℃时,pH=1的硫酸与0.02

 溶液中,两者水电离出的氢离子浓度之比为
溶液中,两者水电离出的氢离子浓度之比为
您最近一年使用:0次
解题方法
3 . 溶液法制取LiBF4的流程如下: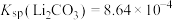 ,
,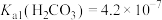 ,
,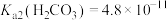 ;
;
ⅱ.反应①可以表示为: 。
。
(1)写出反应②的化学方程式:___________ 。室温条件下,反应②完成后若溶液中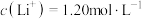 ,pH=8.0,则此时溶液中
,pH=8.0,则此时溶液中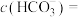
___________ 。
(2)对LiBF4粗品进一步提纯的方法称为______________ 。
(3)写出固相-气相接触法较溶液法制取LiBF4的一项优势:__________ 。

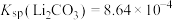 ,
,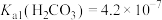 ,
,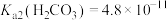 ;
;ⅱ.反应①可以表示为:
 。
。(1)写出反应②的化学方程式:
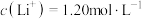 ,pH=8.0,则此时溶液中
,pH=8.0,则此时溶液中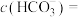
(2)对LiBF4粗品进一步提纯的方法称为
(3)写出固相-气相接触法较溶液法制取LiBF4的一项优势:
您最近一年使用:0次
名校
解题方法
4 . 三氯氧磷( )可用作半导体掺杂剂。工业上采用直接氧化法由
)可用作半导体掺杂剂。工业上采用直接氧化法由 制备
制备 ,反应原理为:
,反应原理为: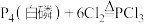 ,
, 。
。
已知: 、
、 的部分性质如下:
的部分性质如下:
某实验小组模拟该工艺设计实验装置如图(部分加热和夹持装置已略去):___________ 。
(2)装置乙的主要作用为:①干燥气体,②___________ ,③___________ 。
(3)装置丙的温度需控制在60-65°℃的原因是___________ 。
(4)提纯 (含少量杂质
(含少量杂质 ),可采用的方法是
),可采用的方法是___________ 。
(5) 遇水生成弱电解质亚磷酸
遇水生成弱电解质亚磷酸 ,已知
,已知 与过量NaOH反应生成
与过量NaOH反应生成 。
。
①写出 的电离方程式:
的电离方程式:___________ 。
② 溶液中,各离子浓度由大到小的顺序为
溶液中,各离子浓度由大到小的顺序为___________ 。
(6)通过测定三氯氧磷产品中Cl元素含量,可进一步计算产品的纯度,实验步骤如下:
I.取mg产品于锥形瓶中,加入足量NaOH溶液,待水解完全后滴加稀硝酸至酸性;
Ⅱ.向锥形瓶中加入 溶液至
溶液至 完全沉淀;
完全沉淀;
Ⅲ.向其中加入少量硝基苯,用力摇动,使沉淀表面被有机物覆盖;
Ⅳ.加入指示剂,用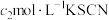 溶液进行滴定,至终点时消耗KSCN溶液
溶液进行滴定,至终点时消耗KSCN溶液 。
。
(已知: 溶于酸,AgSCN是白色沉淀;
溶于酸,AgSCN是白色沉淀;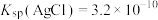 ,
,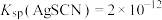 )
)
①步骤Ⅳ中选用的指示剂为___________ 。
A. B.
B. C.淀粉 D.甲基橙
C.淀粉 D.甲基橙
②产品中氯元素的百分含量表达式为:___________ 。
③下列操作会使测得的氯元素含量偏小的是___________ 。
A.配制 标准溶液时仰视容量瓶刻度线
标准溶液时仰视容量瓶刻度线
B.实验过程中未加入硝基苯
C.滴定前滴定管尖嘴处有气泡,滴定后无气泡
D.滴定时锥形瓶未干燥
 )可用作半导体掺杂剂。工业上采用直接氧化法由
)可用作半导体掺杂剂。工业上采用直接氧化法由 制备
制备 ,反应原理为:
,反应原理为: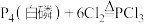 ,
, 。
。已知:
 、
、 的部分性质如下:
的部分性质如下:| 熔点/℃ | 沸点/℃ | 其它 | |
 | -112 | 75.5 |  和 和 互溶,均为无色液体,遇水均剧烈水解 互溶,均为无色液体,遇水均剧烈水解 |
 | 2 | 105.3 |
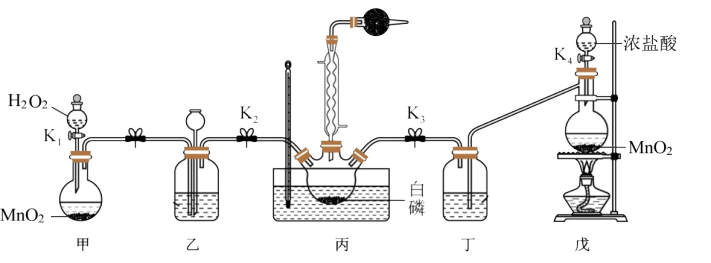
(2)装置乙的主要作用为:①干燥气体,②
(3)装置丙的温度需控制在60-65°℃的原因是
(4)提纯
 (含少量杂质
(含少量杂质 ),可采用的方法是
),可采用的方法是(5)
 遇水生成弱电解质亚磷酸
遇水生成弱电解质亚磷酸 ,已知
,已知 与过量NaOH反应生成
与过量NaOH反应生成 。
。①写出
 的电离方程式:
的电离方程式:②
 溶液中,各离子浓度由大到小的顺序为
溶液中,各离子浓度由大到小的顺序为(6)通过测定三氯氧磷产品中Cl元素含量,可进一步计算产品的纯度,实验步骤如下:
I.取mg产品于锥形瓶中,加入足量NaOH溶液,待水解完全后滴加稀硝酸至酸性;
Ⅱ.向锥形瓶中加入
 溶液至
溶液至 完全沉淀;
完全沉淀;Ⅲ.向其中加入少量硝基苯,用力摇动,使沉淀表面被有机物覆盖;
Ⅳ.加入指示剂,用
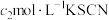 溶液进行滴定,至终点时消耗KSCN溶液
溶液进行滴定,至终点时消耗KSCN溶液 。
。(已知:
 溶于酸,AgSCN是白色沉淀;
溶于酸,AgSCN是白色沉淀;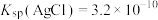 ,
,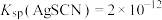 )
)①步骤Ⅳ中选用的指示剂为
A.
 B.
B. C.淀粉 D.甲基橙
C.淀粉 D.甲基橙②产品中氯元素的百分含量表达式为:
③下列操作会使测得的氯元素含量偏小的是
A.配制
 标准溶液时仰视容量瓶刻度线
标准溶液时仰视容量瓶刻度线B.实验过程中未加入硝基苯
C.滴定前滴定管尖嘴处有气泡,滴定后无气泡
D.滴定时锥形瓶未干燥
您最近一年使用:0次
名校
5 . 电解质水溶液广泛存在于生命体及其赖以生存的环境中,电离平衡、水解平衡和沉淀溶解平衡都与生活、生产等息息相关。回答下问题。
(1)室温,体积均为10mL且等pH的CH3COOH溶液与一元酸HX,分别加水稀释至100mL,溶液pH变化如图,则Ka(HX)______ Ka(CH3COOH) (填“>”、“<”或“=”)。溶液稀释后,HX溶液中水电离的c(H+)_____ CH3COOH溶液水电离的c(H+) (填“>”、“<”或“=”)。 _____ 0.01mol/L (填“>”、“<”或“=”)。
(3)在氨水和碳酸氢钠溶液中分别滴入酚酞,溶液均呈现红色,请用相关理论及离子程式解释其原因。______________ 。
(4)浓度均为0.5mol/L的Na2CO3溶液和NaHCO3溶液,以下关系式中,Na2CO3 溶液和NaHCO3溶液均满足的是______。
(5)在Na2CO3和NaHCO3的混合溶液中,一定可以大量共存的离子是______。
(6)等浓度的NH4Cl、(NH4)2CO3和NH4HCO3溶液中,c( )最大的溶液是
)最大的溶液是____ (填化学式)。
(7)含两种等物质的量的溶质的溶液,溶液中只存在OH-、H+、 、Cl-四种离子,且c(
、Cl-四种离子,且c( )>c(Cl-)>c(OH-)>c(H+),则这两种溶质分别是
)>c(Cl-)>c(OH-)>c(H+),则这两种溶质分别是________ 。
(8)我国饮用水卫生标准规定:生活用水中镉(Cd2+)的排放量不超过0.005mg/L。工业上处理含镉(Cd2+)废水常用化学沉淀法。常温下Ksp(Cd(OH)2)=3.2×10-14,若使用生石灰调节溶液pH值,以Cd(OH)2沉淀析出达到Cd2+可排放标准,则溶液pH值至少控制在_____ (保留小数点后一位) (已知:Cd相对原子质量为112.4)
(1)室温,体积均为10mL且等pH的CH3COOH溶液与一元酸HX,分别加水稀释至100mL,溶液pH变化如图,则Ka(HX)

(3)在氨水和碳酸氢钠溶液中分别滴入酚酞,溶液均呈现红色,请用相关理论及离子程式解释其原因。
(4)浓度均为0.5mol/L的Na2CO3溶液和NaHCO3溶液,以下关系式中,Na2CO3 溶液和NaHCO3溶液均满足的是______。
A.c(Na+)+c(H+)=2c( )+c( )+c( )+c(OH-) )+c(OH-) |
B.c( )+ 2c(H2CO3)+ c(H+)=c(OH-) )+ 2c(H2CO3)+ c(H+)=c(OH-) |
C.c( )+c( )+c( )+c(H2CO3)=0.5 mol/L )+c(H2CO3)=0.5 mol/L |
D.c(Na+)>c( )>c(OH-)> c( )>c(OH-)> c( )>c(H+) )>c(H+) |
(5)在Na2CO3和NaHCO3的混合溶液中,一定可以大量共存的离子是______。
| A.OH- | B. | C.H+ | D.Al3+ |
(6)等浓度的NH4Cl、(NH4)2CO3和NH4HCO3溶液中,c(
 )最大的溶液是
)最大的溶液是(7)含两种等物质的量的溶质的溶液,溶液中只存在OH-、H+、
 、Cl-四种离子,且c(
、Cl-四种离子,且c( )>c(Cl-)>c(OH-)>c(H+),则这两种溶质分别是
)>c(Cl-)>c(OH-)>c(H+),则这两种溶质分别是(8)我国饮用水卫生标准规定:生活用水中镉(Cd2+)的排放量不超过0.005mg/L。工业上处理含镉(Cd2+)废水常用化学沉淀法。常温下Ksp(Cd(OH)2)=3.2×10-14,若使用生石灰调节溶液pH值,以Cd(OH)2沉淀析出达到Cd2+可排放标准,则溶液pH值至少控制在
您最近一年使用:0次
6 . Ⅰ.生产、生活废水必须要做及时处理,否则会影响人类的生活环境。废水的常见化学处理法有:中和法、氧化还原法、萃取法、吸附法、混凝法、沉淀法等。
(1)下列物质常被用于污水处理,其中属于纯净物的是___________
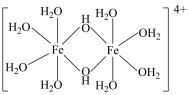
(2)三价铁的强酸盐溶液因会发生水解,可被用作净水剂,其水解时会产生黄色的[Fe(OH)(H2O)5]2+以及二聚体[Fe2 (OH)2(H2O)8]4+ (结构如图)。则二聚体中Fe的配位数为___________ 。
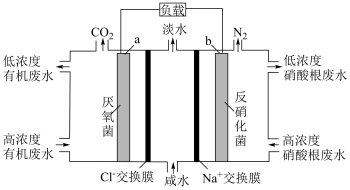
(3)某工厂的酸性 废水中同时含有高浓度有机物(化学式为C6H10O5)和NO 离子,可用一种微生物燃料电池进行污水净化,工作原理如图所示。下列说法正确的是___________;
离子,可用一种微生物燃料电池进行污水净化,工作原理如图所示。下列说法正确的是___________;
Ⅱ.大量含氮污水任意排放将造成藻类疯长,出现水体富营养化等问题。某小组尝试用NaClO溶液处理含氨氮废水。
(4)室温下,部分酸的电离平衡常数如表所示,
下列关于次氯酸钠溶液的说法中,错误的是___________;
(5)下列物质中不能与NaClO反应的是___________
(6)NaClO将废水中的NH3氧化为无污染气体,反应的化学方程式为___________ ;实际实验中NaClO溶液的投入量要大于理论计算量,可能的原因是___________ 。
Ⅲ.含铜(Cu2+)废水是冶金、电子等行业产生的废水,直接排放会导致严重污染。工业上常用NaHS作为沉淀剂处理Cu2+离子。
(7)已知0.1 mol·L−1NaHS溶液呈碱性;
①若将该溶液中的离子按浓度由大到小进行排序,排位第三的离子是___________
A.Na+ B.HS− C.S2− D.OH−
②通过计算,说明溶液呈碱性的原因:___________
(8)沉淀铜离子时,发生反应Cu2+(aq) + 2HS− (aq) CuS(s) + H2S(aq)。常温下,该反应的平衡常数约为K,则此条件下Ksp(CuS) =
CuS(s) + H2S(aq)。常温下,该反应的平衡常数约为K,则此条件下Ksp(CuS) =___________ (用该反应的K,H2S的Ka1和Ka2表示)。
(1)下列物质常被用于污水处理,其中属于纯净物的是___________
| A.漂粉精 | B.聚丙烯酸钠 | C.明矾 | D.石灰乳 |
(2)三价铁的强酸盐溶液因会发生水解,可被用作净水剂,其水解时会产生黄色的[Fe(OH)(H2O)5]2+以及二聚体[Fe2 (OH)2(H2O)8]4+ (结构如图)。则二聚体中Fe的配位数为

(3)某工厂的
 离子,可用一种微生物燃料电池进行污水净化,工作原理如图所示。下列说法正确的是___________;
离子,可用一种微生物燃料电池进行污水净化,工作原理如图所示。下列说法正确的是___________;
| A.图中的a极为阳极,发生氧化反应 |
| B.该装置工作时,电子经导线由a极流向b极 |
| C.Na+向b极流动,故b极为负极 |
| D.该装置亦可用于咸水淡化 |
Ⅱ.大量含氮污水任意排放将造成藻类疯长,出现水体富营养化等问题。某小组尝试用NaClO溶液处理含氨氮废水。
(4)室温下,部分酸的电离平衡常数如表所示,
| 化学式 | 常温下的电离平衡常数 |
| HClO | Ka = 3×10−8 |
| H2CO3 | Ka1 = 4.2×10−7 Ka2 = 4.8×10−11 |
| H2S | Ka1 = 1.3×10−7 Ka2 = 7.1×10−15 |
| A.依据物料守恒关系,[Na+] =[ClO−] + [HClO] |
| B.依据强酸制弱酸原理,通入少量SO2有利于HClO生成,可增强漂白作用 |
| C.由于NaClO水解呈碱性,则[Na+]>[ClO−] |
| D.根据“有弱才水解”规律,所以NaClO是弱电解质 |
(5)下列物质中不能与NaClO反应的是___________
| A.CO2 | B.NaHCO3 | C.H2S | D.NaHS |
(6)NaClO将废水中的NH3氧化为无污染气体,反应的化学方程式为
Ⅲ.含铜(Cu2+)废水是冶金、电子等行业产生的废水,直接排放会导致严重污染。工业上常用NaHS作为沉淀剂处理Cu2+离子。
(7)已知0.1 mol·L−1NaHS溶液呈碱性;
①若将该溶液中的离子按浓度由大到小进行排序,排位第三的离子是
A.Na+ B.HS− C.S2− D.OH−
②通过计算,说明溶液呈碱性的原因:
(8)沉淀铜离子时,发生反应Cu2+(aq) + 2HS− (aq)
 CuS(s) + H2S(aq)。常温下,该反应的平衡常数约为K,则此条件下Ksp(CuS) =
CuS(s) + H2S(aq)。常温下,该反应的平衡常数约为K,则此条件下Ksp(CuS) =
您最近一年使用:0次
7 . Ⅰ.柠檬酸是一种重要的工业原料,化学式可表示为H3Cit,属于三元弱酸。25℃时,柠檬酸的电离常数如下:Ka1=7.4×10-4、Ka2=1.7×10-5、Ka3=4.0×10-7。
(1)25℃时,不同pH范围内,H3Cit、H2Cit-、HCit2-和Cit3-所占的比例(该微粒浓度与四种微粒浓度之和的比值)如下图所示,则其中代表HCit2-的是___________。
(2)25℃时,0.1 mol∙L-1下列溶液中微粒的浓度关系正确的是___________。
(3)已知25℃时,碳酸的电离常数为:Ka1=4.4×10-7、Ka2=4.7×10-11,向NaHCO3溶液中加入NaH2Cit溶液,请写出反应的化学方程式___________ 。
Ⅱ.电子元器件经处理后可得贵金属溶液。在适宜条件下,柠檬酸亚铁中的Fe2+可将贵金属溶液中的AuCl 还原为金颗粒沉淀。
还原为金颗粒沉淀。
(4)请写出离子反应方程式,并标出电子转移的方向和数目。___________ 。
Ⅲ.柠檬酸亚铁是一种高效补铁剂。利用硫铁矿烧渣(主要含Fe2O3及少量CaO、Al2O3)制备柠檬酸亚铁的工艺流程如图。
(5)基态Fe原子价电子排布式为___________ 。
(6)滤渣1为___________ 。(填化学式)
(7)“沉铝”过程中,为了使铝充分沉淀的同时减少铁的损失,需要精确控制氨水的加入量。已知溶液中[Al3+]≤10-5 mol•L-1,认为已经沉淀完全。请计算:(计算结果保留2位有效数字),Al3+恰好沉淀完全时,溶液中[OH-] =___________ 。
(8)“沉铁”过程需控制温度在35℃以下,可能原因是___________ 。
(9)“合成”过程中,需加入少量的抗氧化剂,下列试剂合适的是___________。
(1)25℃时,不同pH范围内,H3Cit、H2Cit-、HCit2-和Cit3-所占的比例(该微粒浓度与四种微粒浓度之和的比值)如下图所示,则其中代表HCit2-的是___________。
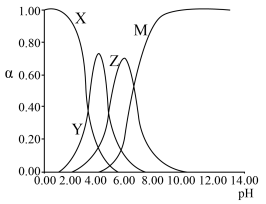
| A.X | B.Y | C.Z | D.M |
(2)25℃时,0.1 mol∙L-1下列溶液中微粒的浓度关系正确的是___________。
| A.Na3Cit溶液中,[Na+]+[H+]=[OH-]+ [H2Cit-]+[HCit2-]+ [Cit3-] |
| B.Na3Cit溶液中, [OH-]>[H+] |
| C.NaH2Cit溶液中,[Na+]=[H3Cit]+[H2Cit-]+[HCit2-]+ [Cit3-] |
| D.Na2HCit溶液中,[OH-]>[H+] |
(3)已知25℃时,碳酸的电离常数为:Ka1=4.4×10-7、Ka2=4.7×10-11,向NaHCO3溶液中加入NaH2Cit溶液,请写出反应的化学方程式
Ⅱ.电子元器件经处理后可得贵金属溶液。在适宜条件下,柠檬酸亚铁中的Fe2+可将贵金属溶液中的AuCl
 还原为金颗粒沉淀。
还原为金颗粒沉淀。(4)请写出离子反应方程式,并标出电子转移的方向和数目。
Ⅲ.柠檬酸亚铁是一种高效补铁剂。利用硫铁矿烧渣(主要含Fe2O3及少量CaO、Al2O3)制备柠檬酸亚铁的工艺流程如图。

(5)基态Fe原子价电子排布式为
(6)滤渣1为
(7)“沉铝”过程中,为了使铝充分沉淀的同时减少铁的损失,需要精确控制氨水的加入量。已知溶液中[Al3+]≤10-5 mol•L-1,认为已经沉淀完全。请计算:(计算结果保留2位有效数字),Al3+恰好沉淀完全时,溶液中[OH-] =
(8)“沉铁”过程需控制温度在35℃以下,可能原因是
(9)“合成”过程中,需加入少量的抗氧化剂,下列试剂合适的是___________。
| A.FeSO4 | B.Fe | C.Cu | D.H2O2 |
您最近一年使用:0次
名校
解题方法
8 . 二氧化碳的捕集和资源化利用是缓解温室效应的重要战略方向。
(1)CO2可用于制取纯碱。纯碱溶液呈碱性的原因是___________ (用离子方程式表示),溶液中离子浓度由大到小的顺序为___________ 。
(2)我国在二氧化碳催化加氢合成甲醇上取得了突破性进展,有关反应如下:
反应ⅰ:
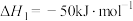
反应ⅱ:
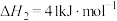
①CO(g)和H2(g)合成甲醇的热化学方程式为___________ ;该反应达平衡后,若升高温度,平衡___________ 移动。
A.正向 B.逆向
②甲醇燃料电池工作原理如下图,下列有关叙述正确的是___________ 。
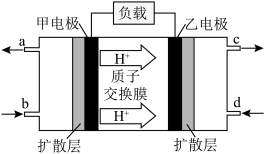
A.a导出的气体是O2
B.电池工作时,电子由甲电极经外电路流向乙电极
C.乙电极的反应式为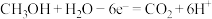
D.当外电路通过0.6 mol电子时,理论上消耗甲醇1.6 g
(3)将1 mol CO2和3 mol H2充入一恒容密闭容器中,同时发生了反应ⅰ和反应ⅱ,测得CO2的平衡转化率随温度、压强变化的情况如图所示。
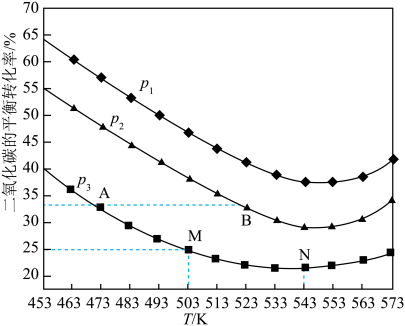
①压强p1、p2、p3由小到大的顺序为___________ 。
②A点、M点的化学反应速率大小: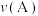
___________ 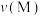 。
。
A.小于 B.等于 C.大于
③温度高于543 K时,CO2平衡转化率随温度的升高而增大的原因是___________ 。
④图中M点对应的温度下,平衡体系中CH3OH的物质的量为0.15 mol,则CO的选择性为___________ 。(CO的选择性 )。
)。
(4)CO2可合成有机试剂DMF,用含金属铱(Ir)的化合物催化,反应机理如下图(其中L表示配体)。下列说法正确的是___________。

(5)催化CO2加氢合成乙酸在减少碳排放的同时还可以生产重要的化工原料。已知电离度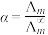 ,
, 为一定浓度下电解质的摩尔电导率,
为一定浓度下电解质的摩尔电导率,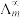 为无限稀释时溶液的摩尔电导率,
为无限稀释时溶液的摩尔电导率,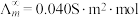 (
(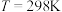 )。实验测得
)。实验测得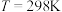 时,
时, 乙酸的
乙酸的 。该条件下测定的乙酸的电离度为
。该条件下测定的乙酸的电离度为___________ %;乙酸的电离平衡常数 为
为___________ (计算结果保留2位有效数字)。
(1)CO2可用于制取纯碱。纯碱溶液呈碱性的原因是
(2)我国在二氧化碳催化加氢合成甲醇上取得了突破性进展,有关反应如下:
反应ⅰ:

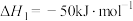
反应ⅱ:

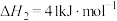
①CO(g)和H2(g)合成甲醇的热化学方程式为
A.正向 B.逆向
②甲醇燃料电池工作原理如下图,下列有关叙述正确的是

A.a导出的气体是O2
B.电池工作时,电子由甲电极经外电路流向乙电极
C.乙电极的反应式为
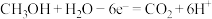
D.当外电路通过0.6 mol电子时,理论上消耗甲醇1.6 g
(3)将1 mol CO2和3 mol H2充入一恒容密闭容器中,同时发生了反应ⅰ和反应ⅱ,测得CO2的平衡转化率随温度、压强变化的情况如图所示。

①压强p1、p2、p3由小到大的顺序为
②A点、M点的化学反应速率大小:
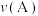
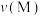 。
。A.小于 B.等于 C.大于
③温度高于543 K时,CO2平衡转化率随温度的升高而增大的原因是
④图中M点对应的温度下,平衡体系中CH3OH的物质的量为0.15 mol,则CO的选择性为
 )。
)。(4)CO2可合成有机试剂DMF,用含金属铱(Ir)的化合物催化,反应机理如下图(其中L表示配体)。下列说法正确的是___________。

| A.CO2在反应中断裂极性键 |
B.总反应方程式为H2+ +CO2 +CO2 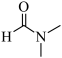 +H2O +H2O |
| C.配合物C中的配位键由Ir提供孤电子对 |
| D.最后一步生成DMF的反应类型为氧化反应 |
(5)催化CO2加氢合成乙酸在减少碳排放的同时还可以生产重要的化工原料。已知电离度
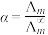 ,
, 为一定浓度下电解质的摩尔电导率,
为一定浓度下电解质的摩尔电导率,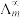 为无限稀释时溶液的摩尔电导率,
为无限稀释时溶液的摩尔电导率,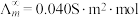 (
(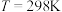 )。实验测得
)。实验测得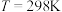 时,
时, 乙酸的
乙酸的 。该条件下测定的乙酸的电离度为
。该条件下测定的乙酸的电离度为 为
为
您最近一年使用:0次
解题方法
9 . 乙酸是典型的有机酸,在生产、生活中有广泛应用.乙酸作为化工原料可以制备氢气,以乙酸为原料制备氢气时的反应:
反应1(热裂解):
反应2(脱羧基):
(1) 中形成
中形成____________ 中心____________ 电子的大π键;

____________  。
。
(2)向一恒容密闭容器中充入一定量的乙酸气体发生反应1和反应2,反应相同时间后,测得部分气体产率与温度的关系如图。 之后氢气产率高于甲烷,试说明理由:
之后氢气产率高于甲烷,试说明理由:_____________________________ 。
②一定温度下,若在充入容器的乙酸气体中掺杂一定量水蒸气,氢气产率显著提高而 产率下降,分析可能原因:
产率下降,分析可能原因:____________________________ (用化学方程式表示)。
(3)采用光催化反应技术直接合成乙酸,可符合原子经济学(原子利用率100%)。下列原料组合符合要求的是____________ (填标号)。
A.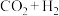 B.
B.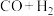 C.
C.
(4)若利用合适的催化剂控制其他副反应(只发生反应1和反应2),温度为 时反应达到平衡,此时总压强为力
时反应达到平衡,此时总压强为力 ,反应1消耗起始乙酸总量的30%,反应2消耗起始乙酸总量的50%,则平衡时
,反应1消耗起始乙酸总量的30%,反应2消耗起始乙酸总量的50%,则平衡时 体积分数为
体积分数为____________ %;反应2的平衡常数
____________  (
( 为以分压表示的平衡常数,分压=总压×体积分数,计算结果用最简式表示)。
为以分压表示的平衡常数,分压=总压×体积分数,计算结果用最简式表示)。
(5)研究 在水溶液中的电离平衡有重要意义。若室温下将
在水溶液中的电离平衡有重要意义。若室温下将 的
的 溶液和
溶液和 溶液等体积混合,恢复至室温后混合溶液中存在
溶液等体积混合,恢复至室温后混合溶液中存在 。则乙酸的电离平衡常数
。则乙酸的电离平衡常数
____________ (用含a和b的代数式表示)。
反应1(热裂解):

反应2(脱羧基):

(1)
 中形成
中形成

 。
。(2)向一恒容密闭容器中充入一定量的乙酸气体发生反应1和反应2,反应相同时间后,测得部分气体产率与温度的关系如图。

 之后氢气产率高于甲烷,试说明理由:
之后氢气产率高于甲烷,试说明理由:②一定温度下,若在充入容器的乙酸气体中掺杂一定量水蒸气,氢气产率显著提高而
 产率下降,分析可能原因:
产率下降,分析可能原因:(3)采用光催化反应技术直接合成乙酸,可符合原子经济学(原子利用率100%)。下列原料组合符合要求的是
A.
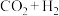 B.
B.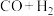 C.
C.
(4)若利用合适的催化剂控制其他副反应(只发生反应1和反应2),温度为
 时反应达到平衡,此时总压强为力
时反应达到平衡,此时总压强为力 ,反应1消耗起始乙酸总量的30%,反应2消耗起始乙酸总量的50%,则平衡时
,反应1消耗起始乙酸总量的30%,反应2消耗起始乙酸总量的50%,则平衡时 体积分数为
体积分数为
 (
( 为以分压表示的平衡常数,分压=总压×体积分数,计算结果用最简式表示)。
为以分压表示的平衡常数,分压=总压×体积分数,计算结果用最简式表示)。(5)研究
 在水溶液中的电离平衡有重要意义。若室温下将
在水溶液中的电离平衡有重要意义。若室温下将 的
的 溶液和
溶液和 溶液等体积混合,恢复至室温后混合溶液中存在
溶液等体积混合,恢复至室温后混合溶液中存在 。则乙酸的电离平衡常数
。则乙酸的电离平衡常数
您最近一年使用:0次
名校
解题方法
10 . 已知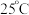 时,部分电解质的电离常数如下表所示:
时,部分电解质的电离常数如下表所示:
(1)根据在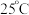 时,用蒸馏水稀释
时,用蒸馏水稀释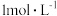 的醋酸溶液至
的醋酸溶液至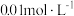 ,随着溶液的稀释,下列各项中始终保持增大趋势的是_____。(单选)
,随着溶液的稀释,下列各项中始终保持增大趋势的是_____。(单选)
(2)常温下,同浓度的下列物质的水溶液 最小的是_____。(单选)
最小的是_____。(单选)
(3)常温下,下列操作(忽略过程中温度变化)可以使亚硫酸稀溶液中的 增大的是_____。(单选)
增大的是_____。(单选)
(4)下列关于 溶液中微粒关系错误的是_____。(不定项)
溶液中微粒关系错误的是_____。(不定项)
(5)向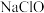 溶液中通入少量
溶液中通入少量 ,写出反应的离子方程式
,写出反应的离子方程式_____ 。
(6)含镉 废水是危害严重的重金属离子废水,处理含镉废水常采用化学沉淀法。常温下,
废水是危害严重的重金属离子废水,处理含镉废水常采用化学沉淀法。常温下, 、
、 。若用
。若用 处理
处理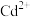 实现沉淀转化,写出反应的离子方程式:
实现沉淀转化,写出反应的离子方程式:_____ ,此时该反应的化学平衡常数为_____ 。
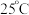 时,部分电解质的电离常数如下表所示:
时,部分电解质的电离常数如下表所示:| 电解质 |  | 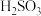 |
| 电离常数 | 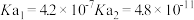 | 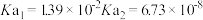 |
| 电解质 | 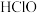 | 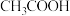 |
| 电离常数 |  | 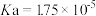 |
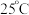 时,用蒸馏水稀释
时,用蒸馏水稀释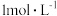 的醋酸溶液至
的醋酸溶液至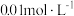 ,随着溶液的稀释,下列各项中始终保持增大趋势的是_____。(单选)
,随着溶液的稀释,下列各项中始终保持增大趋势的是_____。(单选)A. | B.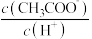 |
C.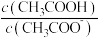 | D. |
 最小的是_____。(单选)
最小的是_____。(单选)A.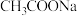 | B. | C. | D. |
 增大的是_____。(单选)
增大的是_____。(单选)A.通入 气体 气体 | B.通入 气体 气体 | C.加入 固体 固体 | D.加入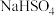 固体 固体 |
 溶液中微粒关系错误的是_____。(不定项)
溶液中微粒关系错误的是_____。(不定项)A.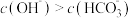 |
B.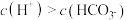 |
C. |
D.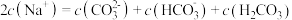 |
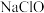 溶液中通入少量
溶液中通入少量 ,写出反应的离子方程式
,写出反应的离子方程式(6)含镉
 废水是危害严重的重金属离子废水,处理含镉废水常采用化学沉淀法。常温下,
废水是危害严重的重金属离子废水,处理含镉废水常采用化学沉淀法。常温下, 、
、 。若用
。若用 处理
处理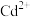 实现沉淀转化,写出反应的离子方程式:
实现沉淀转化,写出反应的离子方程式:
您最近一年使用:0次



