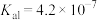名校
解题方法
1 . 二氧化铈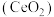 是一种用途广泛的稀土化合物。以氟碳铈矿(主要含
是一种用途广泛的稀土化合物。以氟碳铈矿(主要含 )为原料制备
)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示: 能与
能与 结合成
结合成 ;
;
②在硫酸体系中 能被萃取剂
能被萃取剂 萃取,而
萃取,而 不能。
不能。
回答下列问题:
(1)“氧化焙烧”中氧化的目的是___________ 。
(2)“酸浸”时提高浸取率的方法___________ (写出一种)。
(3)“萃取”时存在反应: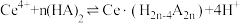 ,Ce4+的萃取率与温度、稀硫酸的浓度的变化关系如图所示,应选择的最适宜条件为
,Ce4+的萃取率与温度、稀硫酸的浓度的变化关系如图所示,应选择的最适宜条件为___________ (填标号);硫酸浓度过大时,萃取率降低的原因是___________ 。
(4)“反萃取”中,在稀硫酸和 的作用下
的作用下 转化为
转化为 ,反应的离子方程式为:
,反应的离子方程式为:___________ 。
(5)向水层中加入 溶液来调节溶液的
溶液来调节溶液的 ,
, 大于
大于___________ 时, 完全生成
完全生成 沉淀。(已知Ksp[Ce(OH)3]=1.0×10-20;当溶液中某离子浓度c<1.0×10-5mol·L-1时,可认为该离子沉淀完全。)
沉淀。(已知Ksp[Ce(OH)3]=1.0×10-20;当溶液中某离子浓度c<1.0×10-5mol·L-1时,可认为该离子沉淀完全。)
(6)二氧化铈( )作为一种脱硝催化剂,能在
)作为一种脱硝催化剂,能在 和
和 之间改变氧化状态,将NO氧化为
之间改变氧化状态,将NO氧化为 ,并引起氧空位的形成,得到新的铈氧化物
,并引起氧空位的形成,得到新的铈氧化物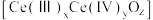 。铈氧化物晶胞发生的变化如下图所示,生成新的铈氧化物中x、y、z的最简整数比为
。铈氧化物晶胞发生的变化如下图所示,生成新的铈氧化物中x、y、z的最简整数比为___________ ,当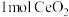 发生如图所示变化时,可吸收标况下NO的体积为
发生如图所示变化时,可吸收标况下NO的体积为___________ 。
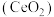 是一种用途广泛的稀土化合物。以氟碳铈矿(主要含
是一种用途广泛的稀土化合物。以氟碳铈矿(主要含 )为原料制备
)为原料制备 的一种工艺流程如图所示:
的一种工艺流程如图所示:
 能与
能与 结合成
结合成 ;
;②在硫酸体系中
 能被萃取剂
能被萃取剂 萃取,而
萃取,而 不能。
不能。回答下列问题:
(1)“氧化焙烧”中氧化的目的是
(2)“酸浸”时提高浸取率的方法
(3)“萃取”时存在反应:
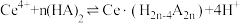 ,Ce4+的萃取率与温度、稀硫酸的浓度的变化关系如图所示,应选择的最适宜条件为
,Ce4+的萃取率与温度、稀硫酸的浓度的变化关系如图所示,应选择的最适宜条件为
(4)“反萃取”中,在稀硫酸和
 的作用下
的作用下 转化为
转化为 ,反应的离子方程式为:
,反应的离子方程式为:(5)向水层中加入
 溶液来调节溶液的
溶液来调节溶液的 ,
, 大于
大于 完全生成
完全生成 沉淀。(已知Ksp[Ce(OH)3]=1.0×10-20;当溶液中某离子浓度c<1.0×10-5mol·L-1时,可认为该离子沉淀完全。)
沉淀。(已知Ksp[Ce(OH)3]=1.0×10-20;当溶液中某离子浓度c<1.0×10-5mol·L-1时,可认为该离子沉淀完全。)(6)二氧化铈(
 )作为一种脱硝催化剂,能在
)作为一种脱硝催化剂,能在 和
和 之间改变氧化状态,将NO氧化为
之间改变氧化状态,将NO氧化为 ,并引起氧空位的形成,得到新的铈氧化物
,并引起氧空位的形成,得到新的铈氧化物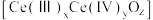 。铈氧化物晶胞发生的变化如下图所示,生成新的铈氧化物中x、y、z的最简整数比为
。铈氧化物晶胞发生的变化如下图所示,生成新的铈氧化物中x、y、z的最简整数比为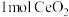 发生如图所示变化时,可吸收标况下NO的体积为
发生如图所示变化时,可吸收标况下NO的体积为
您最近一年使用:0次
2 . 高氯酸三碳酰肼合镍 是一种新型的起爆药,回答下列问题:
是一种新型的起爆药,回答下列问题:
(1)基态Ni原子的电子排布式为_______ 。
(2)基态碳原子核外电子有_______ 种不同运动状态。
(3) 的中心原子的价层电子对数为
的中心原子的价层电子对数为_______ , 的VSEPR模型是
的VSEPR模型是_______ 。
(4)化学式中的CHZ为碳酰肼,其结构为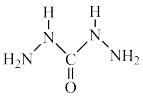 ,是一种新型的环保锅炉水除氧剂:
,是一种新型的环保锅炉水除氧剂:
①CHZ中氮原子的杂化轨道类型为_______ 。
②1molCHZ中含有的σ键数目为_______ NA。
③键角:
_______ (填“>”“<”或“=”) 。
。
(5)常温下, 的HClO溶液的pH约为
的HClO溶液的pH约为_______ [已知: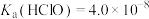 ,
, ]。
]。
 是一种新型的起爆药,回答下列问题:
是一种新型的起爆药,回答下列问题:(1)基态Ni原子的电子排布式为
(2)基态碳原子核外电子有
(3)
 的中心原子的价层电子对数为
的中心原子的价层电子对数为 的VSEPR模型是
的VSEPR模型是(4)化学式中的CHZ为碳酰肼,其结构为
 ,是一种新型的环保锅炉水除氧剂:
,是一种新型的环保锅炉水除氧剂:①CHZ中氮原子的杂化轨道类型为
②1molCHZ中含有的σ键数目为
③键角:

 。
。(5)常温下,
 的HClO溶液的pH约为
的HClO溶液的pH约为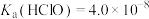 ,
, ]。
]。
您最近一年使用:0次
名校
解题方法
3 . 金属钒在新能源动力电池中有重要作用。含钒尖晶石是钒渣中最主要的含钒物相,其主要成分有V2O3、FeO、Fe2O3、Al2O3、SiO2,采用以下工艺流程制备V2O5。 的形式存在。
的形式存在。
(1)“焙烧”过程中被氧化的元素是___________ 。
(2)“焙烧"时,V2O3与Na2CO3反应的化学方程式是___________ 。
(3)“沉淀1”的成分是___________ 。
(4)“沉淀2”加热分解后固体产物的用途___________ (任写一种)。
(5)“沉钒”析出NH4VO3晶体时,需要加入过量(NH4)2CO3,其原因_____ (结合平衡移动原理解释)。
(6)沉钒过程中,沉钒率随溶液pH的变化如图1所示。沉钒率随溶液pH的增加先升高后降低的原因可能是___________ 。___________ 。
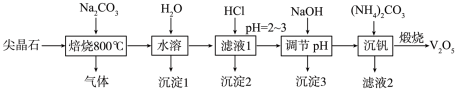
 的形式存在。
的形式存在。(1)“焙烧”过程中被氧化的元素是
(2)“焙烧"时,V2O3与Na2CO3反应的化学方程式是
(3)“沉淀1”的成分是
(4)“沉淀2”加热分解后固体产物的用途
(5)“沉钒”析出NH4VO3晶体时,需要加入过量(NH4)2CO3,其原因
(6)沉钒过程中,沉钒率随溶液pH的变化如图1所示。沉钒率随溶液pH的增加先升高后降低的原因可能是

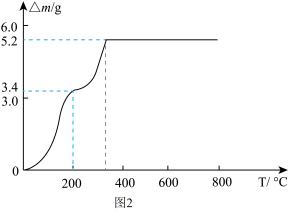
您最近一年使用:0次
2023-11-27更新
|
192次组卷
|
2卷引用:2024届广西普通高中学业水平选择性考试高三下学期模拟考试化学试卷
名校
4 . Ⅰ.盐类水解知识。
(1)氯化铁水溶液呈___________ 性,原因是用离子方程式表示:___________ ;把 溶液蒸干,灼烧,最后得到的主要固体产物是
溶液蒸干,灼烧,最后得到的主要固体产物是___________ ;普通泡沫灭火器是利用溶液跟溶液混合,产生大量的气体和沉淀,气体将混合物压出灭火器,相关反应的离子方程式是:_________ 。
Ⅱ.已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
(2)物质的量浓度均为0.1 的四种溶液:pH由小到大排列的顺序是
的四种溶液:pH由小到大排列的顺序是___________ (用编号填写)
a. b.
b. c.NaClO d.
c.NaClO d.
(3)常温下,0.1
 溶液加水稀释过程中,下列表达式的数据变大的是
溶液加水稀释过程中,下列表达式的数据变大的是________
A. B.
B. C.
C.
D. E.
E.
(4)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:___________ 。
(5)25℃时,将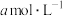 的醋酸与
的醋酸与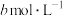 氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为
氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为___________ 。
(1)氯化铁水溶液呈
 溶液蒸干,灼烧,最后得到的主要固体产物是
溶液蒸干,灼烧,最后得到的主要固体产物是Ⅱ.已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
| 化学式 |  |  | HClO |
| 电离平衡常数 |  |   |  |
 的四种溶液:pH由小到大排列的顺序是
的四种溶液:pH由小到大排列的顺序是a.
 b.
b. c.NaClO d.
c.NaClO d.
(3)常温下,0.1

 溶液加水稀释过程中,下列表达式的数据变大的是
溶液加水稀释过程中,下列表达式的数据变大的是A.
 B.
B. C.
C.
D.
 E.
E.
(4)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:
(5)25℃时,将
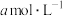 的醋酸与
的醋酸与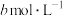 氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为
氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为
您最近一年使用:0次
2023-11-11更新
|
222次组卷
|
2卷引用:广西玉林市2023-2024学年高二上学期11月期中考试化学试题
名校
解题方法
5 . 南宁二中“启天化学社”设计如下实验方案制备SO2 (装置图如下),并利用高中所学化学知识探究含硫化合物的相关性质。请回答下列问题:

(1)打开分液漏斗a的旋塞,浓硫酸不能顺利流下,原因可能是_______ ;加热前,圆底烧瓶中无需加入沸石,其原因是_______ 。
(2)实验室通常使用亚硫酸钠固体与70%硫酸溶液反应制备SO2,此方法与用浓硫酸与铜反应制备SO2相比,优点是:①_______ ,②_______ 。
(3)装置B的作用是_______ ,装置D的作用(请用化学方程式表示)_______ 。
(4)探究实验:向NaHSO3溶液中加入NaClO溶液时,反应有二种可能的情况:
I.NaHSO4与NaClO恰好完全反应,此时反应的离子方程式为_______ ;
II.NaHSO3过量;
III.NaClO过量。
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪种情况,请完成下表:
(已知: H2SO3;Ka1=1.54×10-2,Ka2=1.02×10-7;H2CO3:Ka1=4.3×10-7,Ka2=5.61×10-11;HClO:Ka=3×10-8)

(1)打开分液漏斗a的旋塞,浓硫酸不能顺利流下,原因可能是
(2)实验室通常使用亚硫酸钠固体与70%硫酸溶液反应制备SO2,此方法与用浓硫酸与铜反应制备SO2相比,优点是:①
(3)装置B的作用是
(4)探究实验:向NaHSO3溶液中加入NaClO溶液时,反应有二种可能的情况:
I.NaHSO4与NaClO恰好完全反应,此时反应的离子方程式为
II.NaHSO3过量;
III.NaClO过量。
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪种情况,请完成下表:
(已知: H2SO3;Ka1=1.54×10-2,Ka2=1.02×10-7;H2CO3:Ka1=4.3×10-7,Ka2=5.61×10-11;HClO:Ka=3×10-8)
| 序号 | 实验操作 | 现象 | 结论 |
| ① | 加入少量CaCO3粉末 | I或II | |
| ② | 滴加少量淀粉-KI溶液,振荡 | 溶液先变蓝后褪色 | |
| ③ | II |
您最近一年使用:0次
名校
解题方法
6 . 常温时,几种弱酸的电离平衡常数如表所示。
(1)次氯酸(HClO)的电离方程式为________ 。
(2) 的电离平衡常数表达式K=
的电离平衡常数表达式K=_______ ,通过改变外界条件可以使K值发生变化,则使K值增大需改变的条件是_________ 。
(3)测得某HClO溶液中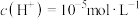 ,则该溶液中HClO的电离度约为
,则该溶液中HClO的电离度约为__________ [已知: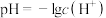 ,电离度是指已电离的电解质分子数占原来总分子数的百分比]。
,电离度是指已电离的电解质分子数占原来总分子数的百分比]。
(4) 的酸性由强到弱的顺序为
的酸性由强到弱的顺序为______ ;向 溶液中滴加HClO溶液发生反应的离子方程式为
溶液中滴加HClO溶液发生反应的离子方程式为__________ ;向 溶液中滴加HClO溶液发生反应的离子方程式为
溶液中滴加HClO溶液发生反应的离子方程式为___________ 。
酸 | 亚硫酸 | 碳酸 | 次氯酸 |
电离平衡常数 |
|
|
|
|
|
(2)
 的电离平衡常数表达式K=
的电离平衡常数表达式K=(3)测得某HClO溶液中
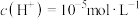 ,则该溶液中HClO的电离度约为
,则该溶液中HClO的电离度约为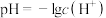 ,电离度是指已电离的电解质分子数占原来总分子数的百分比]。
,电离度是指已电离的电解质分子数占原来总分子数的百分比]。(4)
 的酸性由强到弱的顺序为
的酸性由强到弱的顺序为 溶液中滴加HClO溶液发生反应的离子方程式为
溶液中滴加HClO溶液发生反应的离子方程式为 溶液中滴加HClO溶液发生反应的离子方程式为
溶液中滴加HClO溶液发生反应的离子方程式为
您最近一年使用:0次
解题方法
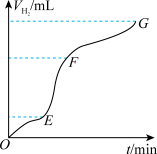
7 . I.用一定质量的Zn跟足量的稀硫酸反应制氢气,请回答:
(1)实验过程如图所示,EF段化学反应速率加快与该反应是_______ (填“放热”或“吸热”)反应有关。
(2)为了减慢上述反应的化学反应速率且不影响氢气的量,向溶液中加入下列物质,你认为可行的是_______(填字母代号)。
II.滴定法是化学分析的常用方法,是一种简便、快速和应用广泛的定量分析方法,在常量分析中有较高的准确度。酸碱滴定和氧化还原滴定是常见的两种滴定方法:
(3)氧化还原滴定:双氧水常用于医用伤口消毒、环境消毒和食品消毒。化学兴趣小组欲准确测定某市售双氧水中 的含量:取双氧水25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释。用一定浓度的高锰酸钾标准液滴定,其反应的离子方程式为
的含量:取双氧水25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释。用一定浓度的高锰酸钾标准液滴定,其反应的离子方程式为 。
。
①滴定时,将高锰酸钾标准溶液注入_______ (填“酸”或“碱”)式滴定管中。
②判断滴定到达终点的现象是_______ 。
(4)酸碱中和滴定:常温下,用 NaOH溶液分别滴定20.00mL浓度均为
NaOH溶液分别滴定20.00mL浓度均为 的盐酸和醋酸溶液,得到两条滴定曲线如图所示:
的盐酸和醋酸溶液,得到两条滴定曲线如图所示:
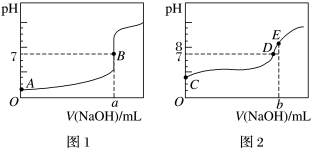
①滴定盐酸的曲线是图_______ (填“1”或“2”)。
②滴定前 的电离度为
的电离度为_______ ,若一定温度下,向该 溶液中加入少量的
溶液中加入少量的 固体,则醋酸的电离平衡向
固体,则醋酸的电离平衡向_______ (填“正”或“逆”)向移动;溶液中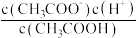 的值
的值_______ (填"增大”、“减小”或“不变”)。
③达到B、D状态时,反应消耗的NaOH溶液的体积a_______ b(填“>”“<"或“=”)。
(1)实验过程如图所示,EF段化学反应速率加快与该反应是

(2)为了减慢上述反应的化学反应速率且不影响氢气的量,向溶液中加入下列物质,你认为可行的是_______(填字母代号)。
| A.蒸馏水 | B.NaCl溶液 | C. 固体 固体 | D. 固体 固体 |
II.滴定法是化学分析的常用方法,是一种简便、快速和应用广泛的定量分析方法,在常量分析中有较高的准确度。酸碱滴定和氧化还原滴定是常见的两种滴定方法:
(3)氧化还原滴定:双氧水常用于医用伤口消毒、环境消毒和食品消毒。化学兴趣小组欲准确测定某市售双氧水中
 的含量:取双氧水25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释。用一定浓度的高锰酸钾标准液滴定,其反应的离子方程式为
的含量:取双氧水25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释。用一定浓度的高锰酸钾标准液滴定,其反应的离子方程式为 。
。①滴定时,将高锰酸钾标准溶液注入
②判断滴定到达终点的现象是
(4)酸碱中和滴定:常温下,用
 NaOH溶液分别滴定20.00mL浓度均为
NaOH溶液分别滴定20.00mL浓度均为 的盐酸和醋酸溶液,得到两条滴定曲线如图所示:
的盐酸和醋酸溶液,得到两条滴定曲线如图所示:
①滴定盐酸的曲线是图
②滴定前
 的电离度为
的电离度为 溶液中加入少量的
溶液中加入少量的 固体,则醋酸的电离平衡向
固体,则醋酸的电离平衡向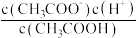 的值
的值③达到B、D状态时,反应消耗的NaOH溶液的体积a
您最近一年使用:0次
8 . 当今环境问题越来越受到人们的重视。汽车尾气中含有较多的NO和CO,两种气体均会使人体中毒。处理大气中的污染物,打响“蓝天白云”保卫战是当前的重要课题。请回答下列问题。
(1)用还原法将NO转化为无污染的物质。已知:
2C(s)+O2(g) 2CO △H1=- 221.0 kJ/mol;
2CO △H1=- 221.0 kJ/mol;
N2(g)+O2(g) 2NO △H2= + 180. 5 kJ/mol;
2NO △H2= + 180. 5 kJ/mol;
2NO+ C(s) CO2(g)+N2(g) △H3 =-573.75 kJ/mol。
CO2(g)+N2(g) △H3 =-573.75 kJ/mol。
请写出CO与NO生成无污染气体CO2与N2的热化学方程式_______ 。
(2)在一定温度下,向甲、乙、丙三个恒容密闭容器中加入一定量的NO和足量的焦炭,反应过程中测得各容器中c(NO)(mol/L)随时间(s)的变化如下表。
已知:三个容器反应温度分别为T甲=500 ℃、T乙 =500 ℃、T丙=a℃
甲容器中,该反应的平衡常数K=_______ 。 丙容器的反应温度a _______ 500 ℃(填“>”、“<”或“=”),理由是_______ 。
(3)某研究性小组在实验室以Ag- ZSM- 5为催化剂,测得NO转化为N2的转化率随温度变化情况如图所示。若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因为_______ 。

(4)利用电解原理也可以处理NO。图为工业生产模拟装置,其中A、B为多孔电极(外接电源未画出),A电极反应式为_______ 。SO2溶于水生成H2SO3,已 知:H2SO3 HSO
HSO +H+ Ka1,HSO
+H+ Ka1,HSO
 SO
SO +H+ Ka2,常温下,向某浓度的H2SO3溶液中逐滴加入一定量浓度的NaOH溶液,所得溶液中H2SO3、HSO
+H+ Ka2,常温下,向某浓度的H2SO3溶液中逐滴加入一定量浓度的NaOH溶液,所得溶液中H2SO3、HSO 、SO
、SO 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示。常温下,
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示。常温下,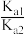 =
=_______ 。


(1)用还原法将NO转化为无污染的物质。已知:
2C(s)+O2(g)
 2CO △H1=- 221.0 kJ/mol;
2CO △H1=- 221.0 kJ/mol;N2(g)+O2(g)
 2NO △H2= + 180. 5 kJ/mol;
2NO △H2= + 180. 5 kJ/mol;2NO+ C(s)
 CO2(g)+N2(g) △H3 =-573.75 kJ/mol。
CO2(g)+N2(g) △H3 =-573.75 kJ/mol。请写出CO与NO生成无污染气体CO2与N2的热化学方程式
(2)在一定温度下,向甲、乙、丙三个恒容密闭容器中加入一定量的NO和足量的焦炭,反应过程中测得各容器中c(NO)(mol/L)随时间(s)的变化如下表。
已知:三个容器反应温度分别为T甲=500 ℃、T乙 =500 ℃、T丙=a℃
| 时间 | 0s | 10 s | 20 s | 30 s | 40 s |
| 甲 | 3.00 | 2.50 | 2.10 | 1.80 | 1.80 |
| 乙 | 1.00 | 0.80 | 0.65 | 0.62 | 0.6 |
| 丙 | 3.00 | 2.45 | 2.00 | 2.00 | 2.00 |
甲容器中,该反应的平衡常数K=
(3)某研究性小组在实验室以Ag- ZSM- 5为催化剂,测得NO转化为N2的转化率随温度变化情况如图所示。若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因为

(4)利用电解原理也可以处理NO。图为工业生产模拟装置,其中A、B为多孔电极(外接电源未画出),A电极反应式为
 HSO
HSO +H+ Ka1,HSO
+H+ Ka1,HSO
 SO
SO +H+ Ka2,常温下,向某浓度的H2SO3溶液中逐滴加入一定量浓度的NaOH溶液,所得溶液中H2SO3、HSO
+H+ Ka2,常温下,向某浓度的H2SO3溶液中逐滴加入一定量浓度的NaOH溶液,所得溶液中H2SO3、HSO 、SO
、SO 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示。常温下,
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示。常温下,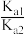 =
=

您最近一年使用:0次
解题方法
9 . Ⅰ.(1)决定化学反应速率的主要因素是_______ 。
A. 浓度 B. 温度 C. 催化剂 D. 反应物的性质
(2) 时,
时, 与
与 反应的能量变化曲线如图。下列叙述正确的是
反应的能量变化曲线如图。下列叙述正确的是_______ 。

A. 该反应的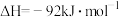
B. 加入催化剂,能提高 的转化率
的转化率
C. 形成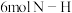 键,吸收
键,吸收 能量
能量
D. 曲线是加入催化剂时的能量变化曲线
曲线是加入催化剂时的能量变化曲线
(3)向纯水中加入下列物质,能抑制水的电离,并使溶液中的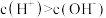 的是
的是_______ 。
A. B.
B.  C.
C.  D.
D. 
(4)下图装置中,能形成原电池的是_______ 。
A. B.
B.  C.
C.  D.
D.
(5)在一密闭容器中,反应
 达到平衡后,改变以下条件,下列说法正确的是
达到平衡后,改变以下条件,下列说法正确的是_______ 。
A. 增大压强,正、逆反应速率同等程度增大,平衡不移动
B. 增加 的用量,正、逆反应速率不变,平衡不移动
的用量,正、逆反应速率不变,平衡不移动
C. 增加 的浓度,平衡向正方向移动,平衡常数增大
的浓度,平衡向正方向移动,平衡常数增大
D. 升高温度,正反应速率增大,逆反应速率减小,平衡向正方向移动
Ⅱ. 时,用
时,用 盐酸滴定
盐酸滴定 氨水的图象如图所示。回答以下问题。
氨水的图象如图所示。回答以下问题。

(1)在图象的 、
、 、
、 、
、 四点中,表示盐酸与氨水恰好反应的是
四点中,表示盐酸与氨水恰好反应的是_______ 点,此时溶液呈_______ (填“酸”、“碱”或“中”)性。
(2) 点时,溶液中微粒浓度关系:
点时,溶液中微粒浓度关系:
_______ (用离子浓度符号填空)。
(3) 点时,溶液中
点时,溶液中
_______  (填“
(填“ ”、“
”、“ ”或“
”或“ ”),理由是
”),理由是_______ 。
(4) 点时,溶液中粒子浓度关系:
点时,溶液中粒子浓度关系:
_______ (用离子浓度符号填空)。
(5) 、
、 、
、 、
、 点均成立的离子浓度等式为
点均成立的离子浓度等式为_______ 。
A. 浓度 B. 温度 C. 催化剂 D. 反应物的性质
(2)
 时,
时, 与
与 反应的能量变化曲线如图。下列叙述正确的是
反应的能量变化曲线如图。下列叙述正确的是
A. 该反应的
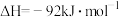
B. 加入催化剂,能提高
 的转化率
的转化率C. 形成
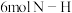 键,吸收
键,吸收 能量
能量D.
 曲线是加入催化剂时的能量变化曲线
曲线是加入催化剂时的能量变化曲线(3)向纯水中加入下列物质,能抑制水的电离,并使溶液中的
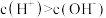 的是
的是A.
 B.
B.  C.
C.  D.
D. 
(4)下图装置中,能形成原电池的是
A.
 B.
B.  C.
C.  D.
D.
(5)在一密闭容器中,反应

 达到平衡后,改变以下条件,下列说法正确的是
达到平衡后,改变以下条件,下列说法正确的是A. 增大压强,正、逆反应速率同等程度增大,平衡不移动
B. 增加
 的用量,正、逆反应速率不变,平衡不移动
的用量,正、逆反应速率不变,平衡不移动C. 增加
 的浓度,平衡向正方向移动,平衡常数增大
的浓度,平衡向正方向移动,平衡常数增大D. 升高温度,正反应速率增大,逆反应速率减小,平衡向正方向移动
Ⅱ.
 时,用
时,用 盐酸滴定
盐酸滴定 氨水的图象如图所示。回答以下问题。
氨水的图象如图所示。回答以下问题。
(1)在图象的
 、
、 、
、 、
、 四点中,表示盐酸与氨水恰好反应的是
四点中,表示盐酸与氨水恰好反应的是(2)
 点时,溶液中微粒浓度关系:
点时,溶液中微粒浓度关系:
(3)
 点时,溶液中
点时,溶液中
 (填“
(填“ ”、“
”、“ ”或“
”或“ ”),理由是
”),理由是(4)
 点时,溶液中粒子浓度关系:
点时,溶液中粒子浓度关系:
(5)
 、
、 、
、 、
、 点均成立的离子浓度等式为
点均成立的离子浓度等式为
您最近一年使用:0次
解题方法
10 . 现有常温条件下甲、乙、丙三种溶液,甲为0.1mol·L-1的NaOH溶液,乙为0.1mol·L-1的HCl溶液,丙为0.1mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=_______ ;
(2)丙溶液中存在的电离平衡为________________ (用电离平衡方程式表示);
(3)甲、乙、丙三种溶液中由水电离出的c(OH-)的由小到大顺序为________ ;

(4)某同学用甲溶液分别滴定20.00mL乙溶液和20.00mL丙溶液,得到如图所示两条滴定曲线,请完成有关问题:
①甲溶液滴定丙溶液的曲线是________ (填“图1”或“图2”);
②a=_________ mL
③pH试纸测定溶液pH的操作方法为_______________________________ 。
(1)甲溶液的pH=
(2)丙溶液中存在的电离平衡为
(3)甲、乙、丙三种溶液中由水电离出的c(OH-)的由小到大顺序为

(4)某同学用甲溶液分别滴定20.00mL乙溶液和20.00mL丙溶液,得到如图所示两条滴定曲线,请完成有关问题:
①甲溶液滴定丙溶液的曲线是
②a=
③pH试纸测定溶液pH的操作方法为
您最近一年使用:0次