解题方法
1 . 碲广泛用于半导体器件、合金、化工原料及铸铁、橡胶、玻璃等工业。工业上利用电解铜的阳极泥(主要成分为 、
、 ,还含有Ag、Au、Si等元素)提取碲,其工艺流程如图甲所示。
,还含有Ag、Au、Si等元素)提取碲,其工艺流程如图甲所示。 是一种两性氧化物,微溶于水,易溶于强酸和强碱。
是一种两性氧化物,微溶于水,易溶于强酸和强碱。
② 为酸性氧化物,溶于水生成亚硒酸。常温下,亚硒酸的电离平衡常数为
为酸性氧化物,溶于水生成亚硒酸。常温下,亚硒酸的电离平衡常数为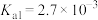 ,
,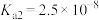 。
。
回答下列问题:
(1)“氧化焙烧”时,为了加快反应速率,可采取的措施为_______ (写一种即可);流程中多次用到过滤操作,实验室进行过滤时需要用到的玻璃仪器有烧杯、_______ 。
(2)“氧化焙烧”后碲元素转化为 ,写出
,写出 反应的化学方程式:
反应的化学方程式:_______ 。
(3)“水浸”后,“滤液”中溶质的主要成分为_______ (填化学式)。
(4)“酸化”后,碲以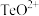 形式存在,则“还原”过程中反应的离子方程式为
形式存在,则“还原”过程中反应的离子方程式为_______ 。
(5)室温下,用水吸收二氧化硒,得到溶液的pH=2,此时溶液中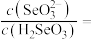
_______ 。
(6)近年,碲化镉太阳能发电玻璃在我国发展迅猛,被誉为“墙壁上的油田”,碲化镉立方晶胞结构如图乙所示。碲化镉的化学式为_______ ,Cd原子周围等距离且最近的Te原子为_______ 个,测得碲化镉晶体的密度为 ,设
,设 为阿伏加德罗常数的值,则晶胞边长为
为阿伏加德罗常数的值,则晶胞边长为_______ pm。
 、
、 ,还含有Ag、Au、Si等元素)提取碲,其工艺流程如图甲所示。
,还含有Ag、Au、Si等元素)提取碲,其工艺流程如图甲所示。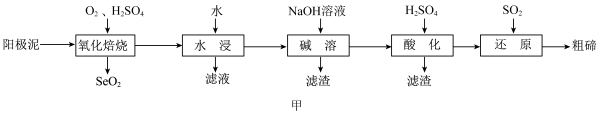
 是一种两性氧化物,微溶于水,易溶于强酸和强碱。
是一种两性氧化物,微溶于水,易溶于强酸和强碱。②
 为酸性氧化物,溶于水生成亚硒酸。常温下,亚硒酸的电离平衡常数为
为酸性氧化物,溶于水生成亚硒酸。常温下,亚硒酸的电离平衡常数为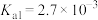 ,
,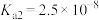 。
。回答下列问题:
(1)“氧化焙烧”时,为了加快反应速率,可采取的措施为
(2)“氧化焙烧”后碲元素转化为
 ,写出
,写出 反应的化学方程式:
反应的化学方程式:(3)“水浸”后,“滤液”中溶质的主要成分为
(4)“酸化”后,碲以
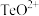 形式存在,则“还原”过程中反应的离子方程式为
形式存在,则“还原”过程中反应的离子方程式为(5)室温下,用水吸收二氧化硒,得到溶液的pH=2,此时溶液中
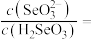
(6)近年,碲化镉太阳能发电玻璃在我国发展迅猛,被誉为“墙壁上的油田”,碲化镉立方晶胞结构如图乙所示。碲化镉的化学式为
 ,设
,设 为阿伏加德罗常数的值,则晶胞边长为
为阿伏加德罗常数的值,则晶胞边长为
您最近一年使用:0次
7日内更新
|
36次组卷
|
3卷引用:2024届云南省昆明市官渡区云南大学附属中学星耀学校高三下学期适应性考试(三模)理综试卷-高中化学
2 . 次硫酸氢钠甲醛(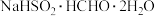 ,其相对分子质量为154)俗称吊白块,在空气中易被氧化,120℃时会分解,在印染、医药及原子能工业中应用广泛。某实验小组以浓
,其相对分子质量为154)俗称吊白块,在空气中易被氧化,120℃时会分解,在印染、医药及原子能工业中应用广泛。某实验小组以浓 、
、 、HCHO和Zn为原料制备次硫酸氢钠甲醛。回答下列问题:
、HCHO和Zn为原料制备次硫酸氢钠甲醛。回答下列问题:
(1)制备 :实验室常用
:实验室常用 与浓
与浓 反应制取
反应制取 。
。
① 分子的空间结构为
分子的空间结构为___________ 。
②工业生产中常用氨水处理废气中 ,写出足量氨水吸收
,写出足量氨水吸收 的离子方程式:
的离子方程式:___________ 。
(2)制备 溶液:在三颈烧瓶中加入一定量
溶液:在三颈烧瓶中加入一定量 固体和
固体和 ,搅拌溶解,再缓慢通入
,搅拌溶解,再缓慢通入 ,实验装置如图所示(夹持仪器已省略)。
,实验装置如图所示(夹持仪器已省略)。 溶液吸收
溶液吸收 的过程中,
的过程中,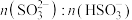 及
及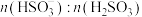 等于1时,溶液的pH分别为7.2、2。
等于1时,溶液的pH分别为7.2、2。
①装置E的作用是___________ ,装置X的名称为___________ 。
②常温下,当溶液中 时,溶液的pH为
时,溶液的pH为___________ 。
(3)制备次硫酸氢钠甲醛:(2)中充分反应后,将装置D中导气管换成橡皮塞,向三颈烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,反应约3h,冷却至室温,抽滤。
①生成 [副产物为
[副产物为 ]时发生反应的化学方程式为
]时发生反应的化学方程式为___________ 。
②将上述抽滤所得的滤液经___________ 步骤,过滤得到产品。
(4)测定产品的纯度:准确称取8.0 g产品,完全溶于水配成100 mL溶液,取20.00 mL所配溶液,加入过量碘完全反应后(已知 不能氧化甲醛,S元素转化为
不能氧化甲醛,S元素转化为 ,杂质不反应),加入
,杂质不反应),加入 溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体2.33 g。产品的纯度为
溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体2.33 g。产品的纯度为___________ 。
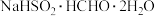 ,其相对分子质量为154)俗称吊白块,在空气中易被氧化,120℃时会分解,在印染、医药及原子能工业中应用广泛。某实验小组以浓
,其相对分子质量为154)俗称吊白块,在空气中易被氧化,120℃时会分解,在印染、医药及原子能工业中应用广泛。某实验小组以浓 、
、 、HCHO和Zn为原料制备次硫酸氢钠甲醛。回答下列问题:
、HCHO和Zn为原料制备次硫酸氢钠甲醛。回答下列问题:(1)制备
 :实验室常用
:实验室常用 与浓
与浓 反应制取
反应制取 。
。①
 分子的空间结构为
分子的空间结构为②工业生产中常用氨水处理废气中
 ,写出足量氨水吸收
,写出足量氨水吸收 的离子方程式:
的离子方程式:(2)制备
 溶液:在三颈烧瓶中加入一定量
溶液:在三颈烧瓶中加入一定量 固体和
固体和 ,搅拌溶解,再缓慢通入
,搅拌溶解,再缓慢通入 ,实验装置如图所示(夹持仪器已省略)。
,实验装置如图所示(夹持仪器已省略)。
 溶液吸收
溶液吸收 的过程中,
的过程中,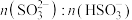 及
及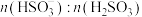 等于1时,溶液的pH分别为7.2、2。
等于1时,溶液的pH分别为7.2、2。①装置E的作用是
②常温下,当溶液中
 时,溶液的pH为
时,溶液的pH为(3)制备次硫酸氢钠甲醛:(2)中充分反应后,将装置D中导气管换成橡皮塞,向三颈烧瓶中加入稍过量的锌粉和一定量甲醛溶液,在80~90℃下,反应约3h,冷却至室温,抽滤。
①生成
 [副产物为
[副产物为 ]时发生反应的化学方程式为
]时发生反应的化学方程式为②将上述抽滤所得的滤液经
(4)测定产品的纯度:准确称取8.0 g产品,完全溶于水配成100 mL溶液,取20.00 mL所配溶液,加入过量碘完全反应后(已知
 不能氧化甲醛,S元素转化为
不能氧化甲醛,S元素转化为 ,杂质不反应),加入
,杂质不反应),加入 溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体2.33 g。产品的纯度为
溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体2.33 g。产品的纯度为
您最近一年使用:0次
名校
解题方法
3 . “吃饺子要蘸醋”是很多中国人传统的饮食习惯,我们对醋酸的使用有着悠久的历史。
(1) 的醋酸和盐酸各
的醋酸和盐酸各 分别稀释至
分别稀释至 ,所得醋酸的
,所得醋酸的
_______ (填“>”“<”或“=”)所得盐酸的 。
。
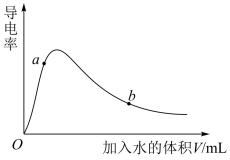
(2)取 冰醋酸作导电性实验,测得其导电率随加入水的量的变化如图所示。
冰醋酸作导电性实验,测得其导电率随加入水的量的变化如图所示。
①由水电离出的氢离子 :a
:a_______ b(填“>”“<”或“=”)。
②使图中b点对应的溶液中 增大、
增大、 减小,可采用的方法是
减小,可采用的方法是_______ (填标号)。
A.加入 B.加入
B.加入 固体 C.加入浓硫酸 D.加入
固体 C.加入浓硫酸 D.加入 固体
固体
(3)向面食中加入适量的醋可以中和其中过量的食用碱而改善口感,已知 时,三种弱酸的电离平衡常数如下表,写出过量醋酸与
时,三种弱酸的电离平衡常数如下表,写出过量醋酸与 溶液反应的离子方程式:
溶液反应的离子方程式:_______ ;判断 结合质子能力由大到小顺序为
结合质子能力由大到小顺序为_______ 。
(4)吃醋虽好但不宜过量,不然容易造成牙齿酸软,甚至引发龋齿,牙齿的主要成分是羟基磷灰石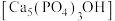 ,市面上含氟牙膏常添加了
,市面上含氟牙膏常添加了 来预防龋齿,请结合化学用语解释含氟牙膏预防龋齿的原因:
来预防龋齿,请结合化学用语解释含氟牙膏预防龋齿的原因:_______ [已知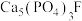 难溶于酸]。
难溶于酸]。
(5)常温下,某同学取 物质的量浓度为
物质的量浓度为 的醋酸,向其中滴入
的醋酸,向其中滴入
 溶液,当滴入的
溶液,当滴入的 溶液的体积为
溶液的体积为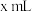 ,溶液呈中性,则醋酸的电离平衡常数
,溶液呈中性,则醋酸的电离平衡常数
_______ (用含x的代数式表示)。

(1)
 的醋酸和盐酸各
的醋酸和盐酸各 分别稀释至
分别稀释至 ,所得醋酸的
,所得醋酸的
 。
。(2)取
 冰醋酸作导电性实验,测得其导电率随加入水的量的变化如图所示。
冰醋酸作导电性实验,测得其导电率随加入水的量的变化如图所示。①由水电离出的氢离子
 :a
:a②使图中b点对应的溶液中
 增大、
增大、 减小,可采用的方法是
减小,可采用的方法是A.加入
 B.加入
B.加入 固体 C.加入浓硫酸 D.加入
固体 C.加入浓硫酸 D.加入 固体
固体(3)向面食中加入适量的醋可以中和其中过量的食用碱而改善口感,已知
 时,三种弱酸的电离平衡常数如下表,写出过量醋酸与
时,三种弱酸的电离平衡常数如下表,写出过量醋酸与 溶液反应的离子方程式:
溶液反应的离子方程式: 结合质子能力由大到小顺序为
结合质子能力由大到小顺序为| 弱酸 |  |  |  |
| 电离平衡常数 | 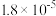 | 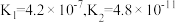 | 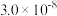 |
(4)吃醋虽好但不宜过量,不然容易造成牙齿酸软,甚至引发龋齿,牙齿的主要成分是羟基磷灰石
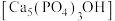 ,市面上含氟牙膏常添加了
,市面上含氟牙膏常添加了 来预防龋齿,请结合化学用语解释含氟牙膏预防龋齿的原因:
来预防龋齿,请结合化学用语解释含氟牙膏预防龋齿的原因: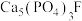 难溶于酸]。
难溶于酸]。(5)常温下,某同学取
 物质的量浓度为
物质的量浓度为 的醋酸,向其中滴入
的醋酸,向其中滴入
 溶液,当滴入的
溶液,当滴入的 溶液的体积为
溶液的体积为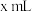 ,溶液呈中性,则醋酸的电离平衡常数
,溶液呈中性,则醋酸的电离平衡常数
您最近一年使用:0次
2024-02-26更新
|
128次组卷
|
2卷引用:云南省大理州民族中学2023-2024学年高二下学期见面考化学试题
名校
解题方法
4 . 我国力争于2030年前做到碳达峰、2060年前实现碳中和,体现了中国对解决气候问题的担当。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径、CO、捕获与CO2重整是CO2利用的研究热点,
(1)在催化剂作用下,可用CO2与H2反应制取甲酸。已知:
则 △H=
△H=________ kJ∙mol−1。
(2)在刚性密闭容器中,HCOOH平衡时的体积分数随投料比[
 ]的变化如图所示:
]的变化如图所示:_____ T2(填“>”“<”或“=”),依据为________ ;
②图中a=________ ;
③A、B、C三点CO2(g)的平衡转化率αA、αB、αC,由大到小的顺序为________ 。
(3)CO2可以被NaOH溶液捕获,若所得溶液pH=13,CO2主要转化为___________ (写离子符号);若所得溶液

 溶液pH=
溶液pH=_____ (室温下,
 的
的
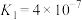 ;
;
 )。
)。
(4)CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用。与CaCO、热分解制备的CaO相比,CaC₂O₄·H₂O热分解制备的CaO具有更好的CO2捕集性能。其原囚是___________ 。
(1)在催化剂作用下,可用CO2与H2反应制取甲酸。已知:
| 共价键 | C=O | C-O | H-H | H-O | C-H |
| 键能/(kJ·mol⁻¹) | 799 | 343 | 436 | 463 | 413 |
 △H=
△H=(2)在刚性密闭容器中,HCOOH平衡时的体积分数随投料比[
 ]的变化如图所示:
]的变化如图所示:
②图中a=
③A、B、C三点CO2(g)的平衡转化率αA、αB、αC,由大到小的顺序为
(3)CO2可以被NaOH溶液捕获,若所得溶液pH=13,CO2主要转化为

 溶液pH=
溶液pH= 的
的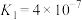 ;
; )。
)。(4)CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用。与CaCO、热分解制备的CaO相比,CaC₂O₄·H₂O热分解制备的CaO具有更好的CO2捕集性能。其原囚是
您最近一年使用:0次
2023-10-29更新
|
376次组卷
|
2卷引用:云南省昆明市第三中学2023-2024学年高二下学期4月第二次综合测试化学试题
解题方法
5 . 氨是重要的基础化工原料,可以制备亚硝酸(HNO2)、连二次硝酸(H2N2O2)、尿素[CO(NH2)2]等多种含氮的化工产品。
(1)NH3极易溶于水且溶液显碱性,请用化学方程式解释原因:___________ 。
(2)25℃时,亚硝酸和连二次硝酸的电离常数如下表所示:
①物质的量浓度相同的NaNO2和NaHN2O2溶液的pH(NaHN2O2)___________ pH(NaNO2)(填“>”、“<”或“=”)。
②25℃时NaHN2O2溶液中存在水解平衡,其水解常数Kh=___________ (保留三位有效数字)。
③0.1mol/LNa2N2O2溶液中离子浓度由大到小的顺序为___________ 。
(3)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应Ⅰ:2NH3(g)+CO2(g) NH2CO2NH4(s) ΔH1=﹣159.5kJ•mol-1;
NH2CO2NH4(s) ΔH1=﹣159.5kJ•mol-1;
反应Ⅱ:NH2CO2NH4(s) CO(NH2)2(s)+H2O(g) ΔH2=+116.5kJ•mol-1;
CO(NH2)2(s)+H2O(g) ΔH2=+116.5kJ•mol-1;
反应Ⅲ:H2O(l)=H2O(g) ΔH3=+44.0kJ•mol-1。
则反应Ⅳ:NH3与CO2合成尿素同时生成液态水的热化学方程式为___________ 。
(4)T1℃时,向容积为2L的恒容密闭容器中充入n(NH3):n(CO2)=2:l的原料气,使之发生反应Ⅳ,反应结束后得到尿素的质量为30g

①T1℃时,NH3的平衡转化率=______ ,该反应的平衡常数K的值为_____ 。
②图2中能正确反应平衡常数K随温度变化关系的曲线为_____ (填字母标号)。
(1)NH3极易溶于水且溶液显碱性,请用化学方程式解释原因:
(2)25℃时,亚硝酸和连二次硝酸的电离常数如下表所示:
| 化学式 | HNO2 | H2N2O2 |
| 电离常数 | Ka=5.1×10-4 | Ka1=6.17×10-8、Ka2=2.88×10-12 |
②25℃时NaHN2O2溶液中存在水解平衡,其水解常数Kh=
③0.1mol/LNa2N2O2溶液中离子浓度由大到小的顺序为
(3)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应Ⅰ:2NH3(g)+CO2(g)
 NH2CO2NH4(s) ΔH1=﹣159.5kJ•mol-1;
NH2CO2NH4(s) ΔH1=﹣159.5kJ•mol-1;反应Ⅱ:NH2CO2NH4(s)
 CO(NH2)2(s)+H2O(g) ΔH2=+116.5kJ•mol-1;
CO(NH2)2(s)+H2O(g) ΔH2=+116.5kJ•mol-1;反应Ⅲ:H2O(l)=H2O(g) ΔH3=+44.0kJ•mol-1。
则反应Ⅳ:NH3与CO2合成尿素同时生成液态水的热化学方程式为
(4)T1℃时,向容积为2L的恒容密闭容器中充入n(NH3):n(CO2)=2:l的原料气,使之发生反应Ⅳ,反应结束后得到尿素的质量为30g

①T1℃时,NH3的平衡转化率=
②图2中能正确反应平衡常数K随温度变化关系的曲线为
您最近一年使用:0次
名校
6 . 我国提出“CO2排放力争于2030年前达到峰值,努力争取2060年前实现碳中和”。研发CO2的利用技术,降低空气中CO2的含量是实现该目标的重要途径。
(1)下面是用H2捕捉CO2时发生两个反应:
I.
Ⅱ.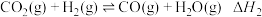
①反应I、Ⅱ的lnK随 的变化如图所示,则
的变化如图所示,则
_______ 0(填“>”“<”或“=”)0;有利于该反应自发进行的温度是___________ (填“高温”或“低温”)。

②将一定量的CO2和H2的混合气体充入密闭容器中, 、
、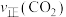 与温度的关系如图所示,400℃之后
与温度的关系如图所示,400℃之后 降低的原因是
降低的原因是_______ ;而速率仍然增大的可能原因是________ 。
③220℃时,将4molH2与1molCO2的混合气体充入2L反应器中,气体初始总压强为p,10分钟后体系达到平衡,CO2的转化率为80%,CH4的选择性为50%,则生成的CH4平均速率为_______ ,反应Ⅱ的平衡常数 为
为________ 。[已知CH4的选择性 ]
]

(2)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工物质Na2CO3.若某次捕捉后得到pH=10的溶液,则溶液中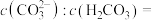
___________ 。(已知常温下 :
: 、
、 )
)
(3)Na-CO2电池可以实现对CO2的利用,该类电池放电的反应方程式为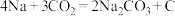 。其工作原理如图所示,请写出正极的反应方程式:
。其工作原理如图所示,请写出正极的反应方程式:________ 。

(1)下面是用H2捕捉CO2时发生两个反应:
I.

Ⅱ.
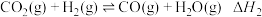
①反应I、Ⅱ的lnK随
 的变化如图所示,则
的变化如图所示,则

②将一定量的CO2和H2的混合气体充入密闭容器中,
 、
、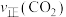 与温度的关系如图所示,400℃之后
与温度的关系如图所示,400℃之后 降低的原因是
降低的原因是③220℃时,将4molH2与1molCO2的混合气体充入2L反应器中,气体初始总压强为p,10分钟后体系达到平衡,CO2的转化率为80%,CH4的选择性为50%,则生成的CH4平均速率为
 为
为 ]
]
(2)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工物质Na2CO3.若某次捕捉后得到pH=10的溶液,则溶液中
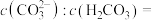
 :
: 、
、 )
)(3)Na-CO2电池可以实现对CO2的利用,该类电池放电的反应方程式为
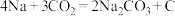 。其工作原理如图所示,请写出正极的反应方程式:
。其工作原理如图所示,请写出正极的反应方程式:
您最近一年使用:0次
名校
解题方法
7 . H2S和SO2会对环境和人体健康带来极大的危害,工业上采取多种方法对这些有害气体进行处理,回答下列问题。
(1)H2S的处理:H2S与CO2在高温下发生反应:H2S(g)+CO2(g) COS(g)+H2O(g)。在610K时,将0.10molCO2与0.40molH2S充入2L的钢瓶中,反应平衡后水的物质的量分数为0.1。
COS(g)+H2O(g)。在610K时,将0.10molCO2与0.40molH2S充入2L的钢瓶中,反应平衡后水的物质的量分数为0.1。
①H2S的平衡转化率α1=___________ %,反应平衡常数K=___________ 。
②在620K重复试验,平衡后水的物质的量分数为0.16,H2S的转化率α2___________ α1,该反应的ΔH___________ 0.(填“>”“<”或“=”)
(2)SO2的除去:

方法1(双碱法):用NaOH吸收SO2,并用CaO使NaOH再生:
①写出过程①的离子方程式:___________ 。CaO在水中存在如下转化:CaO(s)+H2O(l)=Ca(OH)2(s) Ca2+(aq)+2OH-(aq),从平衡移动的角度,简述过程②NaOH再生的原理
Ca2+(aq)+2OH-(aq),从平衡移动的角度,简述过程②NaOH再生的原理___________ 。
方法2:用氨水除去SO2
②已知25℃时,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.1×10-8.若氨水的浓度为2.0mol·L-1,溶液中的c(OH-)=___________ mol·L-1.将SO2通入该氨水中,当溶液呈中性时,溶液中的 =
=___________ 。
(1)H2S的处理:H2S与CO2在高温下发生反应:H2S(g)+CO2(g)
 COS(g)+H2O(g)。在610K时,将0.10molCO2与0.40molH2S充入2L的钢瓶中,反应平衡后水的物质的量分数为0.1。
COS(g)+H2O(g)。在610K时,将0.10molCO2与0.40molH2S充入2L的钢瓶中,反应平衡后水的物质的量分数为0.1。①H2S的平衡转化率α1=
②在620K重复试验,平衡后水的物质的量分数为0.16,H2S的转化率α2
(2)SO2的除去:

方法1(双碱法):用NaOH吸收SO2,并用CaO使NaOH再生:
①写出过程①的离子方程式:
 Ca2+(aq)+2OH-(aq),从平衡移动的角度,简述过程②NaOH再生的原理
Ca2+(aq)+2OH-(aq),从平衡移动的角度,简述过程②NaOH再生的原理方法2:用氨水除去SO2
②已知25℃时,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.1×10-8.若氨水的浓度为2.0mol·L-1,溶液中的c(OH-)=
 =
=
您最近一年使用:0次
8 . 按要求完成下列问题。
(1)某温度(t℃)时水的图象如图所示,a点离子积K=_______ ,在该温度下, 的溶液显
的溶液显_______ 性(填“酸”“碱”或“中”);在该温度下,将 的苛性钠溶液V1L与
的苛性钠溶液V1L与 的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的
的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的 ,则
,则
_______ 。

(2)25℃时,向 氨水中加入少量
氨水中加入少量 固体,当固体溶解后,测得溶液pH会
固体,当固体溶解后,测得溶液pH会_______ 。(填“增大”“减小”或“不变”)
(3)25℃时,等浓度的 溶液和
溶液和 溶液等体积混合,
溶液等体积混合, ,则混合溶液中各种离子浓度大小关系为
,则混合溶液中各种离子浓度大小关系为_______ 。
(4)已知:HClO的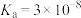 ,
, 的
的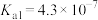 ,
, ,写出往NaClO溶液中通入少量
,写出往NaClO溶液中通入少量 的离子方程式:
的离子方程式:_______ 。
(1)某温度(t℃)时水的图象如图所示,a点离子积K=
 的溶液显
的溶液显 的苛性钠溶液V1L与
的苛性钠溶液V1L与 的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的
的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的 ,则
,则

(2)25℃时,向
 氨水中加入少量
氨水中加入少量 固体,当固体溶解后,测得溶液pH会
固体,当固体溶解后,测得溶液pH会(3)25℃时,等浓度的
 溶液和
溶液和 溶液等体积混合,
溶液等体积混合, ,则混合溶液中各种离子浓度大小关系为
,则混合溶液中各种离子浓度大小关系为(4)已知:HClO的
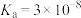 ,
, 的
的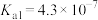 ,
, ,写出往NaClO溶液中通入少量
,写出往NaClO溶液中通入少量 的离子方程式:
的离子方程式:
您最近一年使用:0次
2022-06-23更新
|
104次组卷
|
2卷引用:云南省弥勒市第一中学2021-2022学年高二下学期第一次月考化学试题
9 . 从烟气脱硝催化剂(SCR)中回收金属元素可实现资源的循环利用。一种从废弃SCR(主要含TiO2、V2O5、WO3及SiO2、Al2O3)中回收金属钒和钨的工艺流程如下:
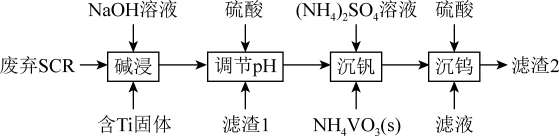
已知:
①Al元素及Si元素在水溶液中的主要存在形式与pH的关系为:
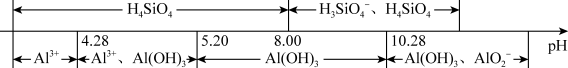
②V2O5为两性氧化物:在水溶液中存在:VO +2H+⇌VO
+2H+⇌VO +H2O;钒元素常见的化合价及其在水溶液中的存在形式如下:
+H2O;钒元素常见的化合价及其在水溶液中的存在形式如下:
回答下列问题:
(1)“碱浸”时,滤液中的金属含氧酸根离子除WO 外还有
外还有_______ 。
(2)“调节pH”时,所调pH的范围是_______ 。
(3)“沉钒”过程中:
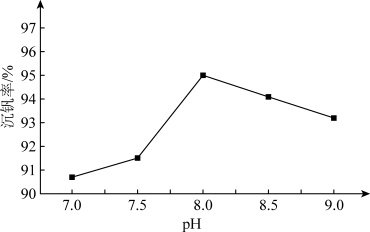
①沉钒率随溶液pH的变化如下图所示。沉钒率随溶液pH值的增加先升高后降低的原因可能是___ 。
②已知25℃时,Kb(NH3·H2O)=1.8×10-5,Ksp(NH4VO3)=3.0×10-8。若25℃时控制“沉钒”的pH为8.0,当VO 恰好完全沉淀时,溶液中的c(NH3·H2O)=
恰好完全沉淀时,溶液中的c(NH3·H2O)=_______ mol·L-1。
(4)常温下,钨酸(H2WO4)是一种难溶于水的弱酸。“沉钨”过程中发生反应的离子方程式为_______ ;“沉钨”后需对滤渣2进行洗涤、干燥,判断滤渣2已洗涤干净的方法为_______ 。
(5)V2O5具有强氧化性,可与浓盐酸发生反应生成气体单质,该反应中氧化剂与还原剂的物质的量之比为1:2,则反应的化学方程式为_______ 。

已知:
①Al元素及Si元素在水溶液中的主要存在形式与pH的关系为:

②V2O5为两性氧化物:在水溶液中存在:VO
 +2H+⇌VO
+2H+⇌VO +H2O;钒元素常见的化合价及其在水溶液中的存在形式如下:
+H2O;钒元素常见的化合价及其在水溶液中的存在形式如下:| 价态 | +5 | +4 | +3 | +2 |
| 存在形式 | VO /VO /VO | VO2+ | V3+ | V2+ |
回答下列问题:
(1)“碱浸”时,滤液中的金属含氧酸根离子除WO
 外还有
外还有(2)“调节pH”时,所调pH的范围是
(3)“沉钒”过程中:
①沉钒率随溶液pH的变化如下图所示。沉钒率随溶液pH值的增加先升高后降低的原因可能是

②已知25℃时,Kb(NH3·H2O)=1.8×10-5,Ksp(NH4VO3)=3.0×10-8。若25℃时控制“沉钒”的pH为8.0,当VO
 恰好完全沉淀时,溶液中的c(NH3·H2O)=
恰好完全沉淀时,溶液中的c(NH3·H2O)=(4)常温下,钨酸(H2WO4)是一种难溶于水的弱酸。“沉钨”过程中发生反应的离子方程式为
(5)V2O5具有强氧化性,可与浓盐酸发生反应生成气体单质,该反应中氧化剂与还原剂的物质的量之比为1:2,则反应的化学方程式为
您最近一年使用:0次
10 . I.次磷酸( )是一种精细化工产品。
)是一种精细化工产品。
(1) 溶液中的含磷微粒只有
溶液中的含磷微粒只有 和
和 ,则该溶液呈
,则该溶液呈_______ 性(填“酸”“碱”或“中”)。
(2)25℃时, 溶液和盐酸的物质的量浓度相同。加水稀释至相同的pH,此时加入
溶液和盐酸的物质的量浓度相同。加水稀释至相同的pH,此时加入 溶液中水的体积
溶液中水的体积_______ (填“大于”“小于”或“等于”)加入盐酸中水的体积。
II.
(3)硅元素可形成多种晶体。
①硅与氯、溴结合能形成 、
、 ,沸点较高的是
,沸点较高的是_______ 。
②晶体Si和晶体SiC结构相似,熔点较低的是_______ 。
(4)某化合物具有超导性,其晶胞结构如图所示,则该化合物的化学式为_______ ,1个Mg与_______ 个Ni等距离且最近。

III.为了达到碳中和,研发二氧化碳、烃类等物质的利用技术已成为科研热点。
(5)



则

_______ (用 、
、 表示)。
表示)。
(6)已知反应:
 。将1molCO和2mol
。将1molCO和2mol 充入1L恒容密闭容器中,在一定条件下合成甲醇,相同时间(2min)内测得CO的转化率与温度的对应关系如图所示:
充入1L恒容密闭容器中,在一定条件下合成甲醇,相同时间(2min)内测得CO的转化率与温度的对应关系如图所示:
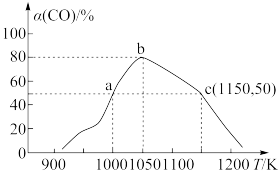
①试求温度为1000K条件下,反应开始至2min时,
_______ 。
②已知c点时容器内的压强为p,则在1150K温度下该反应的压强平衡常数 为
为_______ ( 是用各气体物质的分压替代浓度来计算的平衡常数)。
是用各气体物质的分压替代浓度来计算的平衡常数)。
 )是一种精细化工产品。
)是一种精细化工产品。(1)
 溶液中的含磷微粒只有
溶液中的含磷微粒只有 和
和 ,则该溶液呈
,则该溶液呈(2)25℃时,
 溶液和盐酸的物质的量浓度相同。加水稀释至相同的pH,此时加入
溶液和盐酸的物质的量浓度相同。加水稀释至相同的pH,此时加入 溶液中水的体积
溶液中水的体积II.
(3)硅元素可形成多种晶体。
①硅与氯、溴结合能形成
 、
、 ,沸点较高的是
,沸点较高的是②晶体Si和晶体SiC结构相似,熔点较低的是
(4)某化合物具有超导性,其晶胞结构如图所示,则该化合物的化学式为

III.为了达到碳中和,研发二氧化碳、烃类等物质的利用技术已成为科研热点。
(5)




则


 、
、 表示)。
表示)。(6)已知反应:

 。将1molCO和2mol
。将1molCO和2mol 充入1L恒容密闭容器中,在一定条件下合成甲醇,相同时间(2min)内测得CO的转化率与温度的对应关系如图所示:
充入1L恒容密闭容器中,在一定条件下合成甲醇,相同时间(2min)内测得CO的转化率与温度的对应关系如图所示:
①试求温度为1000K条件下,反应开始至2min时,

②已知c点时容器内的压强为p,则在1150K温度下该反应的压强平衡常数
 为
为 是用各气体物质的分压替代浓度来计算的平衡常数)。
是用各气体物质的分压替代浓度来计算的平衡常数)。
您最近一年使用:0次



