1 . 钪的特殊性质,使其在电子工业、航天、核技术、激光技术、冶金、化工、医学、农业等各方面得到广泛应用。一种利用高温沸腾氯化烟尘(主要成分为AlCl3、FeCl3、TiCl4、ScCl3等,还含有其他难溶于酸的物质)回收Sc的工艺流程如图。

已知:钪(原子序数为21)与铝类似,其氢氧化物具有两性;钪离子可以在不同pH下生成[Sc(OH)n]3-n(n=1~6)。
请回答以下问题:
(1)某次实验中需要使用480mL3mol·L-1的盐酸,用浓盐酸(密度为1.2g·cm-3,质量分数为36.5%)配制实验所需要的盐酸,则需要量取浓盐酸的体积为_______ mL,需要使用的玻璃仪器除烧杯、量筒、玻璃棒外,还需要的是_______ 。
(2)钪的一种核素可用作示踪原子,用于对恶性肿瘤放射治疗,该种核素的中子数为25,则该核素的符号为_______ 。
(3)“反萃取”时,若加入的氢氧化钠溶液过量,则Sc(OH)3沉淀会溶解。写出Se(OH)3与过量NaOH溶液反应生成n=6的含钪产物的化学方程式:_______ 。
(4)加入草酸进行“沉淀转化”,将Sc(OH)3沉淀转化为Sc2(C2O4)3。25°C时pH=2的草酸溶液中 =
=_______ 。(25°C时,草酸的电离平衡常数为Ka1=5.0×10-2,Ka2=5.4×10-5)
(5)草酸钪在空气中“灼烧”可制得Sc2O3,写出反应的化学方程式:_______ 。
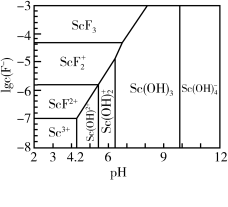
(6)常温下,三价Sc的部分存在形式与氟离子浓度的对数[lgc(F-)、pH的关系如图所示。若溶液中c(F-)=1×10-5mol·L-1,“调pH”过程中控制pH=5,此时三价Sc的主要存在形式为_______ (填化学式)。

已知:钪(原子序数为21)与铝类似,其氢氧化物具有两性;钪离子可以在不同pH下生成[Sc(OH)n]3-n(n=1~6)。
请回答以下问题:
(1)某次实验中需要使用480mL3mol·L-1的盐酸,用浓盐酸(密度为1.2g·cm-3,质量分数为36.5%)配制实验所需要的盐酸,则需要量取浓盐酸的体积为
(2)钪的一种核素可用作示踪原子,用于对恶性肿瘤放射治疗,该种核素的中子数为25,则该核素的符号为
(3)“反萃取”时,若加入的氢氧化钠溶液过量,则Sc(OH)3沉淀会溶解。写出Se(OH)3与过量NaOH溶液反应生成n=6的含钪产物的化学方程式:
(4)加入草酸进行“沉淀转化”,将Sc(OH)3沉淀转化为Sc2(C2O4)3。25°C时pH=2的草酸溶液中
 =
=(5)草酸钪在空气中“灼烧”可制得Sc2O3,写出反应的化学方程式:
(6)常温下,三价Sc的部分存在形式与氟离子浓度的对数[lgc(F-)、pH的关系如图所示。若溶液中c(F-)=1×10-5mol·L-1,“调pH”过程中控制pH=5,此时三价Sc的主要存在形式为

您最近一年使用:0次
2 . 二氧化碳的捕集和资源化利用是缓解温室效应的重要战略方向。回答下列问题:
(1)我国在二氧化碳催化加氢合成甲醇上取得了突破性进展,有关反应如下:
反应ⅰ。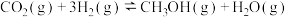
反应ⅱ。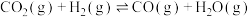

 和
和 合成甲醇的热化学方程式为
合成甲醇的热化学方程式为___________ 。
(2)在催化剂 的作用下,
的作用下,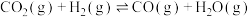 的微观反应历程和相对能量(
的微观反应历程和相对能量( )如图所示,其中吸附在催化剂表面上的物种用“*”标注。已知:
)如图所示,其中吸附在催化剂表面上的物种用“*”标注。已知: 表示
表示 ,
, 表示
表示 ,
, 表示
表示 。
。
历程Ⅰ: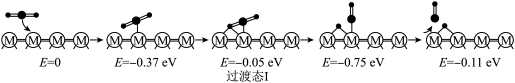
反应甲: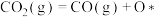
历程Ⅱ: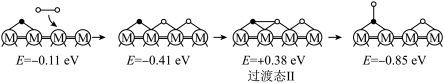
反应乙:
历程Ⅲ: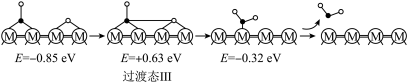
反应丙:___________
①历程Ⅲ中的反应丙可表示为___________ 。
②决定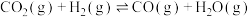 的总反应速率的是历程
的总反应速率的是历程___________ (填“Ⅰ”、“Ⅱ”或“Ⅲ”)。
(3)将 和
和 按物质的量之比
按物质的量之比 充入一恒容密闭容器中,同时发生了反应ⅰ和反应ⅱ,测得
充入一恒容密闭容器中,同时发生了反应ⅰ和反应ⅱ,测得 的平衡转化率随温度、压强变化的情况如图所示。
的平衡转化率随温度、压强变化的情况如图所示。
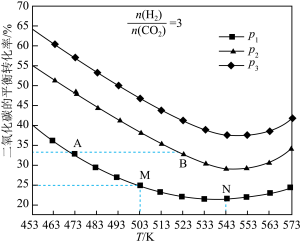
①压强 、
、 、
、 的大小关系为
的大小关系为___________ 。
② 点、
点、 点的化学反应速率大小:
点的化学反应速率大小: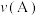
___________ (填“<”、“=”或“>”) 。
。
③温度高于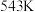 时,
时, 的平衡转化率随温度的升高而增大的原因是
的平衡转化率随温度的升高而增大的原因是___________ 。
④图中 点对应的温度下,已知
点对应的温度下,已知 的选择性(生成的
的选择性(生成的 与转化的
与转化的 的百分比)为50%,该温度下反应ⅱ的平衡常数为
的百分比)为50%,该温度下反应ⅱ的平衡常数为___________ (结果保留3位小数)。
(4)催化 加氢合成乙酸在减少碳排放的同时还可以生产重要的化工原料。已知电离度
加氢合成乙酸在减少碳排放的同时还可以生产重要的化工原料。已知电离度 ,
, 为一定浓度下电解质的摩尔电导率,
为一定浓度下电解质的摩尔电导率,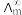 为无限稀释时溶液的摩尔电导率,
为无限稀释时溶液的摩尔电导率,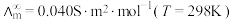 。某小组实验测得
。某小组实验测得 时,
时, 乙酸的
乙酸的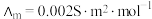 。
。
①该条件下测定的乙酸的电离平衡常数 为
为___________ (列出计算式,不需化简)。
②在 时,几种离子的摩尔电导率如表所示。已知:摩尔电导率越大,溶液的导电性越好。空间站通过电解水实现
时,几种离子的摩尔电导率如表所示。已知:摩尔电导率越大,溶液的导电性越好。空间站通过电解水实现 的再生,从导电性角度选择,最适宜的电解质为
的再生,从导电性角度选择,最适宜的电解质为___________ (填化学式)。
(1)我国在二氧化碳催化加氢合成甲醇上取得了突破性进展,有关反应如下:
反应ⅰ。
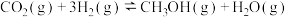
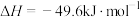
反应ⅱ。
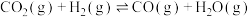

 和
和 合成甲醇的热化学方程式为
合成甲醇的热化学方程式为(2)在催化剂
 的作用下,
的作用下,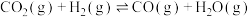 的微观反应历程和相对能量(
的微观反应历程和相对能量( )如图所示,其中吸附在催化剂表面上的物种用“*”标注。已知:
)如图所示,其中吸附在催化剂表面上的物种用“*”标注。已知: 表示
表示 ,
, 表示
表示 ,
,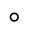 表示
表示 。
。历程Ⅰ:

反应甲:
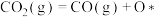
历程Ⅱ:

反应乙:

历程Ⅲ:

反应丙:
①历程Ⅲ中的反应丙可表示为
②决定
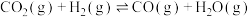 的总反应速率的是历程
的总反应速率的是历程(3)将
 和
和 按物质的量之比
按物质的量之比 充入一恒容密闭容器中,同时发生了反应ⅰ和反应ⅱ,测得
充入一恒容密闭容器中,同时发生了反应ⅰ和反应ⅱ,测得 的平衡转化率随温度、压强变化的情况如图所示。
的平衡转化率随温度、压强变化的情况如图所示。
①压强
 、
、 、
、 的大小关系为
的大小关系为②
 点、
点、 点的化学反应速率大小:
点的化学反应速率大小: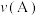
 。
。③温度高于
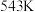 时,
时, 的平衡转化率随温度的升高而增大的原因是
的平衡转化率随温度的升高而增大的原因是④图中
 点对应的温度下,已知
点对应的温度下,已知 的选择性(生成的
的选择性(生成的 与转化的
与转化的 的百分比)为50%,该温度下反应ⅱ的平衡常数为
的百分比)为50%,该温度下反应ⅱ的平衡常数为(4)催化
 加氢合成乙酸在减少碳排放的同时还可以生产重要的化工原料。已知电离度
加氢合成乙酸在减少碳排放的同时还可以生产重要的化工原料。已知电离度 ,
, 为一定浓度下电解质的摩尔电导率,
为一定浓度下电解质的摩尔电导率,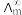 为无限稀释时溶液的摩尔电导率,
为无限稀释时溶液的摩尔电导率,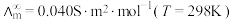 。某小组实验测得
。某小组实验测得 时,
时, 乙酸的
乙酸的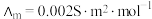 。
。①该条件下测定的乙酸的电离平衡常数
 为
为②在
 时,几种离子的摩尔电导率如表所示。已知:摩尔电导率越大,溶液的导电性越好。空间站通过电解水实现
时,几种离子的摩尔电导率如表所示。已知:摩尔电导率越大,溶液的导电性越好。空间站通过电解水实现 的再生,从导电性角度选择,最适宜的电解质为
的再生,从导电性角度选择,最适宜的电解质为| 离子种类 |  |  |  |  |  |  |
| 摩尔电导率 /(  ) ) | 349.82 | 79.8 | 76.34 | 50.18 | 73.52 | 50.11 |
您最近一年使用:0次
2023-04-28更新
|
651次组卷
|
3卷引用:青海省海东市2023届高三下学期第三次联考理综化学试题
3 . 化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许______ 离子通过,氯气的逸出口是_______ (填标号)。

(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X)= ,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为
,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为______ 。
(3)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为______ 。
(4)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为_____ mol;产生“气泡”的化学方程式为____________ 。
(5)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是______ (用离子方程式表示)。工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000 kg该溶液需消耗氯气的质量为____ kg(保留整数)。
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许

(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X)=
 ,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为
,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为(3)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为
(4)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为
(5)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是
您最近一年使用:0次
2020-07-08更新
|
12773次组卷
|
13卷引用:青海省湟川中学2020-2021学年高二下学期第一次月考化学试题
青海省湟川中学2020-2021学年高二下学期第一次月考化学试题2020年全国统一考试化学试题(新课标Ⅱ)(已下线)专题13 元素及其化合物知识的综合应用-2020年高考真题和模拟题化学分项汇编四川省成都市双流棠湖中学2021届高三上学期开学考试理综化学试题(已下线)专题08 常见无机物及其应用——备战2021年高考化学纠错笔记(已下线)押全国卷理综第27题 工业流程-备战2021年高考化学临考题号押题(课标全国卷)山东省枣庄市第三中学2022届高三第一次月考化学试题2020年全国卷Ⅱ化学真题变式题(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押全国卷理综第27题 工业流程-备战2022年高考化学临考题号押题(全国卷)(已下线)第05练 以简单工业流程突破金属及其化合物-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)题型43 次氯酸、氯的含氧酸盐的性质和应用(已下线)专题17 原理综合题
名校
4 . 两位同学设计实验确定某一元酸HA是弱电解质并分析其中的变化,实验方案如下:
甲:取纯度、质量、大小相同的锌粒于两只相同气球中,向2支试管中分别加入浓度均为0.1mol/L的HA溶液和稀盐酸各10mL,将气球套在试管上,并同时将锌粒加入试管。
乙:方案一:用pH计测定浓度为0.1mol/L HA溶液的pH;
方案二:取pH=3的HA溶液5mL稀释至500mL,再用pH计测其pH。
(1)甲同学设计的方案中,说明HA是弱电解质的实验现象是_________ (填字母)。
a. 两个试管上方的气球同时鼓起,且一样大
b. 装有HA溶液的试管上方的气球鼓起慢
c. 装有盐酸的试管上方的气球鼓起慢
(2)乙同学设计的方案可证明HA是弱电解质:方案一中,测得0.1mol/L的HA溶液的pH________ 1(填“>”“<”或“=”);方案二中,所得结果是_________ 。
(3)若从水解原理角度设计一个合理而比较容易进行的方案(药品可任取),证明HA是弱电解质,你的设计方案是_________ 。
(4)乙同学根据HA在溶液中的电离平衡移动的原理,进一步做下列分析。
①使HA的电离程度和c(H+)都减小,c(A-)增大,可在0.1mol/L的HA溶液中,选择加入___________ 试剂。
②使HA的电离程度减小,c(H+)和c(A-)都增大,可在0.1mol/L的HA溶液中,选择加入________ 试剂。
甲:取纯度、质量、大小相同的锌粒于两只相同气球中,向2支试管中分别加入浓度均为0.1mol/L的HA溶液和稀盐酸各10mL,将气球套在试管上,并同时将锌粒加入试管。
乙:方案一:用pH计测定浓度为0.1mol/L HA溶液的pH;
方案二:取pH=3的HA溶液5mL稀释至500mL,再用pH计测其pH。
(1)甲同学设计的方案中,说明HA是弱电解质的实验现象是
a. 两个试管上方的气球同时鼓起,且一样大
b. 装有HA溶液的试管上方的气球鼓起慢
c. 装有盐酸的试管上方的气球鼓起慢
(2)乙同学设计的方案可证明HA是弱电解质:方案一中,测得0.1mol/L的HA溶液的pH
(3)若从水解原理角度设计一个合理而比较容易进行的方案(药品可任取),证明HA是弱电解质,你的设计方案是
(4)乙同学根据HA在溶液中的电离平衡移动的原理,进一步做下列分析。
①使HA的电离程度和c(H+)都减小,c(A-)增大,可在0.1mol/L的HA溶液中,选择加入
②使HA的电离程度减小,c(H+)和c(A-)都增大,可在0.1mol/L的HA溶液中,选择加入
您最近一年使用:0次
2018-09-20更新
|
247次组卷
|
2卷引用:青海省湟川中学2019-2020学年高二上学期期中考试化学试题
解题方法
5 . 碲(Te)是VIA族非金属元素,其单质和化合物在太阳能、电子、橡胶生产方面具有广泛的应用。
(1)根据碲(Te)在元素周期表中的位置,判断H2TeO4的酸性_____ (填“大于”、“小于”或“无法判断”)H2SO4酸性。
(2)已知TeO2是两性氧化物,微溶于水,可溶于强酸或强碱。TeO2和NaOH溶液发生反应的化学方程式为_________________ 。
(3)已知25℃时,亚碲酸(H2TeO3)的电离常数K1=1×10-3,K2=2×10-8。计算:
①0.1mol/L H2TeO3的电离度α约为_______ (α=已电离弱电解质分子数/电解质分子总数×100%);
②NaHTeO3溶液的pH_____ 7(填“>”、“=”或“<”)。
(4)从粗铜精炼的阳极泥(主要含有Cu2Te)中提取粗碲的一种工芝流程如下:_____________ 。
④防止局部酸度过大的操作方法是___________ 。
⑤对滤渣“酸浸”后,将Na2SO3加入Te(SO4)2溶液中进行“还原”得到固态碲,该反应的离子方程式是____________ 。
⑥“还原”得到固态碲后分离出粗碲的方法是________ ,对粗碲进行洗涤,判断洗涤干净的实验操作和现象是_____________ 。
(1)根据碲(Te)在元素周期表中的位置,判断H2TeO4的酸性
(2)已知TeO2是两性氧化物,微溶于水,可溶于强酸或强碱。TeO2和NaOH溶液发生反应的化学方程式为
(3)已知25℃时,亚碲酸(H2TeO3)的电离常数K1=1×10-3,K2=2×10-8。计算:
①0.1mol/L H2TeO3的电离度α约为
②NaHTeO3溶液的pH
(4)从粗铜精炼的阳极泥(主要含有Cu2Te)中提取粗碲的一种工芝流程如下:

④防止局部酸度过大的操作方法是
⑤对滤渣“酸浸”后,将Na2SO3加入Te(SO4)2溶液中进行“还原”得到固态碲,该反应的离子方程式是
⑥“还原”得到固态碲后分离出粗碲的方法是
您最近一年使用:0次
6 . 铵明矾[NH4Al(SO4)2·12H2O]是分析化学常用的基准试剂,工业上常用铝土矿(主要成分为Al2O3)来生产铵明矾,其中Z的水溶液可用于伤口消毒,其工艺流程图如下:

(1)写出反应Ⅱ的离子方程式____________________ 。
(2)25℃时,将0.2 mol·L-1的氨水与0.1 mol·L-1的Y溶液等体积混合,所得溶液的pH=5,则该温度下氨水的电离常数Kb≈_____________ (忽略混合时溶液体积的变化)。
(3)从反应Ⅳ的铵明矾溶液中获得铵明矾晶体的实验操作依次为_____________ 、____________ 、过滤、洗涤(填操作名称)。
(4)“电解”时,用惰性材料作电极,则阳极电极反应式为__________________________ 。
(5)反应Ⅵ的化学方程式为______________________ 。
(6)废水中含有Fe2+、Mn2+等金属离子对自然环境有严重的破坏作用,,可用(NH4)2S2O8氧化除去。写出Mn2+被氧化生成MnO2的离子方程式为__________________________________ 。Z也有较强氧化性,在实际生产中不用Z氧化Mn2+的原因是_______________________________________ 。

(1)写出反应Ⅱ的离子方程式
(2)25℃时,将0.2 mol·L-1的氨水与0.1 mol·L-1的Y溶液等体积混合,所得溶液的pH=5,则该温度下氨水的电离常数Kb≈
(3)从反应Ⅳ的铵明矾溶液中获得铵明矾晶体的实验操作依次为
(4)“电解”时,用惰性材料作电极,则阳极电极反应式为
(5)反应Ⅵ的化学方程式为
(6)废水中含有Fe2+、Mn2+等金属离子对自然环境有严重的破坏作用,,可用(NH4)2S2O8氧化除去。写出Mn2+被氧化生成MnO2的离子方程式为
您最近一年使用:0次
2018-03-15更新
|
566次组卷
|
3卷引用:青海省西宁市2018届高三下学期复习检测一(一模)理综化学试题



