名校
解题方法
1 . 石油产品中含有H2S及COS等多种有机硫化物,石油化工催生出多种脱硫技术,请回答下列问题:
(1)已知下列反应的热化学方程式:
①2H2S(g)⇌S2(g)+2H2(g) △H1=+180kJ∙mol-1
②CH4(g)+S2(g)⇌CS2(g)+2H2(g) △H2=+81kJ∙mol-1
计算反应③:CH4(g)+2H2S(g)⇌CS2(g)+4H2(g) △H3=___________ kJ∙mol-1。
(2)工业生产中用活性α-Al2O3作催化剂,COS的水解反应为:COS(g)+H2O(g)⇌CO2(g)+H2S(g) △H<0
①恒温恒容条件下投入一定量反应物进行反应,一定能判断反应到达平衡的是___________ (填字母)。
A.容器中气体密度不变 B. 保持不变
保持不变
C.该反应化学平衡常数保持不变 D.υ逆(COS)=υ正(H2S)
②当温度升高到一定值后,发现相同时间内COS(g)的水解转化率降低,猜测可能的原因是_______ ;________ 。

(3)我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除,如图所示。光伏电池的负极为___________ (填字母),阳极区发生的总反应为___________ 。

(4)可用K2CO3溶液吸收H2S,其原理为:K2CO3+H2S⇌KHS+KHCO3。已知:Ka1(H2CO3)=4.2×10-7,Ka2(H2CO3)=5.6×10-11,Ka1(H2S)=5.6×10-8,Ka2(H2S)=1.2×10-15。则该反应的平衡常数为________ 。
(1)已知下列反应的热化学方程式:
①2H2S(g)⇌S2(g)+2H2(g) △H1=+180kJ∙mol-1
②CH4(g)+S2(g)⇌CS2(g)+2H2(g) △H2=+81kJ∙mol-1
计算反应③:CH4(g)+2H2S(g)⇌CS2(g)+4H2(g) △H3=
(2)工业生产中用活性α-Al2O3作催化剂,COS的水解反应为:COS(g)+H2O(g)⇌CO2(g)+H2S(g) △H<0
①恒温恒容条件下投入一定量反应物进行反应,一定能判断反应到达平衡的是
A.容器中气体密度不变 B.
 保持不变
保持不变C.该反应化学平衡常数保持不变 D.υ逆(COS)=υ正(H2S)
②当温度升高到一定值后,发现相同时间内COS(g)的水解转化率降低,猜测可能的原因是

(3)我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除,如图所示。光伏电池的负极为

(4)可用K2CO3溶液吸收H2S,其原理为:K2CO3+H2S⇌KHS+KHCO3。已知:Ka1(H2CO3)=4.2×10-7,Ka2(H2CO3)=5.6×10-11,Ka1(H2S)=5.6×10-8,Ka2(H2S)=1.2×10-15。则该反应的平衡常数为
您最近一年使用:0次
名校
2 . 水溶液中的离子反应和平衡状态与生活、生产及环境保护等息息相关。请回答下列问题:
(1)25℃时,
___________ ;
(2)已知25℃时,HCN的 ,则NaCN溶液显
,则NaCN溶液显___________ (填“酸性”、“中性”或“碱性”),结合离子反应方程式 分析其原因是___________ 。
(3)25℃时,将 的NaOH溶液与
的NaOH溶液与 的
的 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的 ,则NaOH溶液与
,则NaOH溶液与 溶液的体积比为
溶液的体积比为___________ 。
(4)已知25℃时, 的NaA溶液的
的NaA溶液的 ,则NaA溶液中水解平衡常数
,则NaA溶液中水解平衡常数
___________ ,溶液中各离子物质的量浓度由大到小的顺序为___________ 。
(5)25℃时, 的①
的① ②
② ③NaCN④
③NaCN④ 溶液的pH由大到小的顺序是
溶液的pH由大到小的顺序是___________ (填序号)。
(6)某同学用 的NaOH溶液分别滴定
的NaOH溶液分别滴定 的HCl溶液和
的HCl溶液和 的
的 溶液,得到如图所示的两条滴定曲线,请回答有关问题:
溶液,得到如图所示的两条滴定曲线,请回答有关问题:

①NaOH溶液滴定 溶液的曲线是
溶液的曲线是___________ (填“图1”或“图2”)曲线。
②图1和图2中的a=___________ 。
(7)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各含氯元素微粒的组成分数 [
[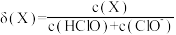 ,X为HClO或
,X为HClO或 ]与pH的关系如图所示。HClO的电离常数
]与pH的关系如图所示。HClO的电离常数 值为
值为___________ 。

(1)25℃时,

(2)已知25℃时,HCN的
 ,则NaCN溶液显
,则NaCN溶液显(3)25℃时,将
 的NaOH溶液与
的NaOH溶液与 的
的 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的 ,则NaOH溶液与
,则NaOH溶液与 溶液的体积比为
溶液的体积比为(4)已知25℃时,
 的NaA溶液的
的NaA溶液的 ,则NaA溶液中水解平衡常数
,则NaA溶液中水解平衡常数
(5)25℃时,
 的①
的① ②
② ③NaCN④
③NaCN④ 溶液的pH由大到小的顺序是
溶液的pH由大到小的顺序是| 电解质 |  |  | HCN |  |
| 电离常数 | 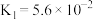  |  | 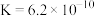 |  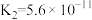 |
(6)某同学用
 的NaOH溶液分别滴定
的NaOH溶液分别滴定 的HCl溶液和
的HCl溶液和 的
的 溶液,得到如图所示的两条滴定曲线,请回答有关问题:
溶液,得到如图所示的两条滴定曲线,请回答有关问题:
①NaOH溶液滴定
 溶液的曲线是
溶液的曲线是②图1和图2中的a=
(7)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各含氯元素微粒的组成分数
 [
[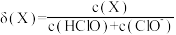 ,X为HClO或
,X为HClO或 ]与pH的关系如图所示。HClO的电离常数
]与pH的关系如图所示。HClO的电离常数 值为
值为
您最近一年使用:0次
名校
3 . 在室温下,下列五种溶液:
①0.1 mol·L-1NH4Cl ②0.1 mol·L-1CH3COONH4 ③0.1 mol·L-1NH4HSO4
④0.1 mol·L-1NH3·H2O和 0.1 mol·L-1NH4Cl混合液 ⑤pH=a的CH3COOH
请根据要求填写下列空白:
(1)溶液①呈酸性的原因是___________ (用离子方程式表示)。
(2)比较溶液②、③中c(NH )的大小关系是②
)的大小关系是②___________ ③(填“>”“<”或“=”)。
(3)在溶液④中,NH3·H2O和______ 物质的量浓度之和为0.2 mol·L-1(填微粒符号)。
(4)室温,溶液②的pH=7,CH3COO-与NH 浓度的大小关系是c(CH3COO-)
浓度的大小关系是c(CH3COO-)______ c(NH )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
(5)溶液⑤稀释100倍后所得溶液pH___ a+2(填“>”或“<”或“=”)。
①0.1 mol·L-1NH4Cl ②0.1 mol·L-1CH3COONH4 ③0.1 mol·L-1NH4HSO4
④0.1 mol·L-1NH3·H2O和 0.1 mol·L-1NH4Cl混合液 ⑤pH=a的CH3COOH
请根据要求填写下列空白:
(1)溶液①呈酸性的原因是
(2)比较溶液②、③中c(NH
 )的大小关系是②
)的大小关系是②(3)在溶液④中,NH3·H2O和
(4)室温,溶液②的pH=7,CH3COO-与NH
 浓度的大小关系是c(CH3COO-)
浓度的大小关系是c(CH3COO-) )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。(5)溶液⑤稀释100倍后所得溶液pH
您最近一年使用:0次
2022-04-01更新
|
696次组卷
|
4卷引用:海南省海口嘉勋高级中学2022-2023学年高二上学期11月期中检测化学试题
解题方法
4 . CO和NO是汽车尾气中的主要污染物,易引起酸雨、温室效应和光化学烟雾等环境污染问题。随着我国机动车保有量的飞速发展,汽车尾气的有效处理变得迫在眉睫。其中的一种方法为2CO(g)+2NO(g)=N2(g)+2CO2(g),请回答下列问题:
(1)已知该反应为自发反应,则该反应的反应热△H___________ 0(填“>”或“<”或“=”)
(2)已知:N2 (g) + O2(g)=2NO(g) △H= a kJ•mol -1
C(s) + O2 (g)=CO2 (g) △H= b kJ•mol -1
2C(s) + O2 (g)=2CO(g) △H= c kJ•mol -1
则 2CO(g)+2NO(g)=N2 (g)+2CO2 (g) △H=___________ kJ•mol-1 (用含 a、b、c 的表达式表示)。
(3)一定温度下,将 2molCO、4molNO 充入一恒压密闭容器。已知起始压强为 1MPa,到达平衡时, 测得N2的物质的量为 0.5 mol,则:
①该温度此反应用平衡分压代替平衡浓度的平衡常数Kp=___________ (写出计算表示式)
②该条件下,可判断此反应到达平衡的标志是___________
A.单位时间内,断裂 2 molC=O 同时形成 1 mol N≡N。
B.混合气体的平均相对分子质量不再改变。
C.混合气体的密度不再改变。
D.CO与NO的转化率比值不再改变。
(4)某研究小组探究催化剂对 CO、NO 转化的影响。将 CO 和 NO 以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中 N2的含量,从而确定尾气脱氮率(即 NO 的转化率),结果如图所示:
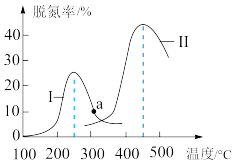
①由图可知:要达到最大脱氮率,该反应应采取的最佳实验条件为___________
②若低于 200℃,图中曲线 I 脱氮率随温度升高变化不大的主要原因为___________
(5)已知常温下,Kb(NH3·H2O)=1.8×10-5,Ka1(H2CO3) =4.4×10-7,Ka2(H2CO3) =4.4×10-11,.此温度下某氨水的浓度为 2mol/L,则溶液中c(OH-)=___________ mol/L,将脱氮反应后生成CO2通入氨水中使溶液恰好呈中性,则此时 =
=___________ (保留小数点后4位数字)
(6)电解NO制备NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3,需要补充物质A,A是___________ ,理由是___________

(1)已知该反应为自发反应,则该反应的反应热△H
(2)已知:N2 (g) + O2(g)=2NO(g) △H= a kJ•mol -1
C(s) + O2 (g)=CO2 (g) △H= b kJ•mol -1
2C(s) + O2 (g)=2CO(g) △H= c kJ•mol -1
则 2CO(g)+2NO(g)=N2 (g)+2CO2 (g) △H=
(3)一定温度下,将 2molCO、4molNO 充入一恒压密闭容器。已知起始压强为 1MPa,到达平衡时, 测得N2的物质的量为 0.5 mol,则:
①该温度此反应用平衡分压代替平衡浓度的平衡常数Kp=
②该条件下,可判断此反应到达平衡的标志是
A.单位时间内,断裂 2 molC=O 同时形成 1 mol N≡N。
B.混合气体的平均相对分子质量不再改变。
C.混合气体的密度不再改变。
D.CO与NO的转化率比值不再改变。
(4)某研究小组探究催化剂对 CO、NO 转化的影响。将 CO 和 NO 以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中 N2的含量,从而确定尾气脱氮率(即 NO 的转化率),结果如图所示:

①由图可知:要达到最大脱氮率,该反应应采取的最佳实验条件为
②若低于 200℃,图中曲线 I 脱氮率随温度升高变化不大的主要原因为
(5)已知常温下,Kb(NH3·H2O)=1.8×10-5,Ka1(H2CO3) =4.4×10-7,Ka2(H2CO3) =4.4×10-11,.此温度下某氨水的浓度为 2mol/L,则溶液中c(OH-)=
 =
=(6)电解NO制备NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3,需要补充物质A,A是

您最近一年使用:0次
2021-05-24更新
|
814次组卷
|
3卷引用:2021年海南高考化学试题变式题11-19
名校
5 . (1)常温下,向20mL0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。回答下列问题

①NaHB溶液呈_______ (填“酸性”“碱性”或“中性”)
②A、D、E三点溶液的pH由大到小为:_______
③F点溶液c(NH4+)_______ 2c(B2-)(填“>”“<”或“=”)
(2)某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
(查阅资料)25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38
(实验探究)向2支均盛有1mL0.1mol/LMgCl2溶液的试管中分别加入2滴2mol/LNaOH溶液,制得等量Mg(OH)2沉淀。
①分别向两支试管中加入不同试剂,请填写下表中的实验现象(用下列选项中字母代号填写)
A 白色沉淀转化为红褐色沉淀 B 白色沉淀不发生改变
C 红褐色沉淀转化为白色沉淀 D 白色沉淀溶解,得无色溶液
②同学们猜想实验Ⅱ中沉淀溶解的主要原因有两种:
猜想1:NH4+结合Mg(OH)2电离出的OH-,使Mg(OH)2的沉淀溶解平衡正向移动。猜想2:_______ 。
(3)为验证猜想,同学们取少量相同质量的氢氧化镁固体盛放在两支试管中,一支试管中加入醋酸铵溶液(pH=7),另一支试管中加入NH4Cl和氨水混合液(pH=8),两者沉淀均溶解。该实验证明正确的是_______ (填“猜想1”或“猜想2”)。

①NaHB溶液呈
②A、D、E三点溶液的pH由大到小为:
③F点溶液c(NH4+)
(2)某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
(查阅资料)25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38
(实验探究)向2支均盛有1mL0.1mol/LMgCl2溶液的试管中分别加入2滴2mol/LNaOH溶液,制得等量Mg(OH)2沉淀。
①分别向两支试管中加入不同试剂,请填写下表中的实验现象(用下列选项中字母代号填写)
| 试管编号 | 加入试剂 | 实验现象 |
| Ⅰ | 2滴0.1mol/LFeCl3溶液 | |
| Ⅱ | 4mL2mol/LNH4Cl溶液 |
A 白色沉淀转化为红褐色沉淀 B 白色沉淀不发生改变
C 红褐色沉淀转化为白色沉淀 D 白色沉淀溶解,得无色溶液
②同学们猜想实验Ⅱ中沉淀溶解的主要原因有两种:
猜想1:NH4+结合Mg(OH)2电离出的OH-,使Mg(OH)2的沉淀溶解平衡正向移动。猜想2:
(3)为验证猜想,同学们取少量相同质量的氢氧化镁固体盛放在两支试管中,一支试管中加入醋酸铵溶液(pH=7),另一支试管中加入NH4Cl和氨水混合液(pH=8),两者沉淀均溶解。该实验证明正确的是
您最近一年使用:0次
2020-03-12更新
|
180次组卷
|
2卷引用:海南省海口市海南中学2020届高三下学期第七次月考化学试题
解题方法
6 . 25℃时,分别向等体积pH均为a的CH3COOH溶液和HCN溶液中加水稀释,稀释过程中溶液的pH变化与溶液体积的关系如图所示:
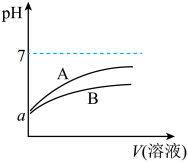
已知25℃时,HCN的电离平衡常数Ka=6.2×10-10,CH3COOH的电离平衡常数Ka=1.7×10-5
(1)表示CH3COOH溶液的pH变化趋势的曲线是____ (填“A”或“B”)。
(2)pH均为a的CH3COOH溶液和HCN溶液,溶质的物质的量浓度较大的是____ (填化学式)。
(3)25℃时,等浓度的NaCN溶液的pH___ 填“>”=”或“<”)CH3 COONa溶液的pH。
(4)25℃时,向20mL0.01mol·L-1CH3COOH溶液中逐滴加入0.01mol·L-1KOH溶液,当pH=7时,所加KOH溶液的体积____ (填或“<”)20mL。
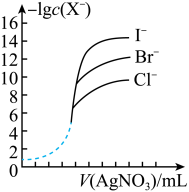
(5)用相同浓度的AgNO3溶液分别滴定浓度相同的含Cl-、Br-及I-的混合溶液,由图可确定首先沉淀的离子是______ 。(填离子符号)

已知25℃时,HCN的电离平衡常数Ka=6.2×10-10,CH3COOH的电离平衡常数Ka=1.7×10-5
(1)表示CH3COOH溶液的pH变化趋势的曲线是
(2)pH均为a的CH3COOH溶液和HCN溶液,溶质的物质的量浓度较大的是
(3)25℃时,等浓度的NaCN溶液的pH
(4)25℃时,向20mL0.01mol·L-1CH3COOH溶液中逐滴加入0.01mol·L-1KOH溶液,当pH=7时,所加KOH溶液的体积
(5)用相同浓度的AgNO3溶液分别滴定浓度相同的含Cl-、Br-及I-的混合溶液,由图可确定首先沉淀的离子是

您最近一年使用:0次
2020-02-26更新
|
511次组卷
|
6卷引用:海南省2020届高三下学期新高考线上诊断性测试化学试题
海南省2020届高三下学期新高考线上诊断性测试化学试题陕西省西安市2019-2020学年高二上学期期末联考化学试题(已下线)考点11 弱电解质的电离及溶液pH-2020年高考化学命题预测与模拟试题分类精编安徽省皖西南名校2019-2020学年高二下学期期末联考化学试题(已下线)第03章 水溶液中的离子平衡(B卷提升篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)广东省云浮市2019-2020学年高二上学期期末考试化学试题
名校
7 . 已知K、Ka、Kb、Kw、Kh、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、弱碱的电离平衡常数、水的离子积常数、盐的水解平衡常数、难溶电解质的溶度积常数。
(1)有关上述常数的说法正确的是______ 。
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
d.一定温度下,在CH3COONa溶液中,Kw=Ka·Kh
(2)25℃时,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl-),则溶液显_____ (填“酸”“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离平衡常数Kb=____ 。
(3)高炉炼铁中发生的反应有FeO(s)+CO(g) Fe(s)+CO2(g) ΔH<0。该反应的平衡常数表达式K=
Fe(s)+CO2(g) ΔH<0。该反应的平衡常数表达式K=_____ ;已知1100 ℃时,K=0.25,则平衡时CO的转化率为________ ;在该温度下,若测得高炉中c(CO2)=0.020 mol·L-1,c(CO)=0.1 mol·L-1,则此时反应速率是υ(正)_____ υ(逆)(填“>”“<”或“=”)。
(4)已知高温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1 mol·L-1的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是______ (已知lg2=0.3)。
(1)有关上述常数的说法正确的是
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
d.一定温度下,在CH3COONa溶液中,Kw=Ka·Kh
(2)25℃时,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl-),则溶液显
(3)高炉炼铁中发生的反应有FeO(s)+CO(g)
 Fe(s)+CO2(g) ΔH<0。该反应的平衡常数表达式K=
Fe(s)+CO2(g) ΔH<0。该反应的平衡常数表达式K=(4)已知高温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1 mol·L-1的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是
您最近一年使用:0次
2019-06-26更新
|
530次组卷
|
2卷引用:海南省北京师范大学万宁附属中学2021-2022学年高二上学期第一次月考化学试题
8 . 硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:
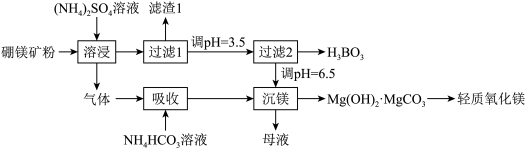
回答下列问题:
(1)在95 ℃“溶浸”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为_________ 。
(2)“滤渣1”的主要成分有_________ 。为检验“过滤1”后的滤液中是否含有Fe3+离子,可选用的化学试剂是_________ 。
(3)根据H3BO3的解离反应:H3BO3+H2O H++B(OH)−4,Ka=5.81×10−10,可判断H3BO3是
H++B(OH)−4,Ka=5.81×10−10,可判断H3BO3是_______ 酸;在“过滤2”前,将溶液pH调节至3.5,目的是_______________ 。
(4)在“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式为__________ ,母液经加热后可返回___________ 工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是_________ 。

回答下列问题:
(1)在95 ℃“溶浸”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为
(2)“滤渣1”的主要成分有
(3)根据H3BO3的解离反应:H3BO3+H2O
 H++B(OH)−4,Ka=5.81×10−10,可判断H3BO3是
H++B(OH)−4,Ka=5.81×10−10,可判断H3BO3是(4)在“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式为
您最近一年使用:0次
2019-06-09更新
|
18225次组卷
|
27卷引用:2020年海南卷化学高考真题变式题9-14
(已下线)2020年海南卷化学高考真题变式题9-14(已下线)2020年海南卷化学高考真题变式题15-19海南省海南枫叶国际学校2021-2022学年高三上学期第三次月考(1月)化学试题2019年全国统一考试化学试题(新课标Ⅰ)【全国百强校】河南省南阳市第一中学2018-2019学年高二下学期第四次月考化学试题2020届高考化学小题狂练(全国通用版)专练18 物质的检验、分离和提纯湖南省株洲市茶陵二中2020届高三上学期第二次月考化学试题专题5.2 化学实验的设计与评价(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升(已下线)专题七 工艺流程题(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训(已下线)专题6.1 无机化工流程题(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升山东省潍坊市诸城一中2021届高三11月份模拟化学试题(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)押全国卷理综第27题 工业流程-备战2021年高考化学临考题号押题(课标全国卷)山东省潍坊市实验中学2021-2022学年高三9月单元测试(入学考试)化学试题(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押全国卷理综第27题 工业流程-备战2022年高考化学临考题号押题(全国卷)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)(已下线)题型65 草酸和草酸盐、硼及其化合物的性质和用途(已下线)专题18 工艺流程题(已下线)T26-工业流程题云南省宣威市第三中学2023-2024学年高三上学期收心考化学试题北京市陈经纶中学2023-2024学年高三上学期10月月考化学试卷 安徽省阜阳市临泉第一中学(高铁分校)2023-2024学年高二上学期期末考试化学试题
解题方法
9 . 完成下列题目:
(1)现有如下两个反应:
A.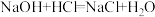
B.
①根据两反应本质判断,_____________ 能设计成原电池(填“A”或“B”)。
②如果(A或B)不能,说明其原因________________________________ 。
(2)研究大气中含硫化合物(主要是SO2和H2S)的转化具有重要意义。
①高湿条件下,写出大气中SO2转化为 的方程式:
的方程式:_____________ 。
②土壤中的微生物可将大气中H2S经两步反应氧化成,两步反应的能量变化示意图如下:

1mol H2S(g)全部氧化成 (aq)的热化学方程式为
(aq)的热化学方程式为___________________ 。
(3)二氧化硫—空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如下:

质子的流动方向为___________ (“从A到B”或“从B到A”)。
(1)现有如下两个反应:
A.
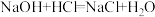
B.

①根据两反应本质判断,
②如果(A或B)不能,说明其原因
(2)研究大气中含硫化合物(主要是SO2和H2S)的转化具有重要意义。
①高湿条件下,写出大气中SO2转化为
 的方程式:
的方程式:②土壤中的微生物可将大气中H2S经两步反应氧化成,两步反应的能量变化示意图如下:

1mol H2S(g)全部氧化成
 (aq)的热化学方程式为
(aq)的热化学方程式为(3)二氧化硫—空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如下:

质子的流动方向为
您最近一年使用:0次
解题方法
10 . 研究硫元素及其化合物的性质具有重要意义。
(1)25 ℃,在0.10 mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与[S2-]关系如下图(忽略溶液体积的变化、H2S的挥发)。

①pH=13时,溶液中的[H2S]+[HS-]=__________ mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH=____________ 时,Mn2+开始沉淀[已知:Ksp(MnS)=2.8×10-13]。
(2)25 ℃,两种酸的电离平衡常数如下表。
①HSO 的电离平衡常数表达式K=
的电离平衡常数表达式K=________ 。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为____________________ 。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为_________________________ 。
(1)25 ℃,在0.10 mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与[S2-]关系如下图(忽略溶液体积的变化、H2S的挥发)。

①pH=13时,溶液中的[H2S]+[HS-]=
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH=
(2)25 ℃,两种酸的电离平衡常数如下表。
| 物质 | Ka1 | Ka2 |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO
 的电离平衡常数表达式K=
的电离平衡常数表达式K=②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为
您最近一年使用:0次
2018-08-28更新
|
248次组卷
|
4卷引用:海南省海南枫叶国际学校2018-2019学年高二下学期期中考试化学试题



