解题方法
1 .  用途广泛。某实验小组同学围绕
用途广泛。某实验小组同学围绕 开展如下实验活动。
开展如下实验活动。
 .配制溶液
.配制溶液
(1)配制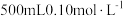 的
的 溶液,需要称量
溶液,需要称量 固体的质量为
固体的质量为___________  。
。
(2)上述配制溶液的过程中,用到的玻璃仪器除玻璃棒、量筒、胶头滴管外,还有___________ (填标号)。 .实验探究
.实验探究
探究温度对 溶液
溶液 的影响,进行如下实验(不考虑水的挥发)。
的影响,进行如下实验(不考虑水的挥发)。
(3) 溶液显碱性的原因是
溶液显碱性的原因是___________ (用离子方程式表示)。
(4)实验1中测得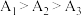 ,可知当
,可知当 时,
时, 溶液的
溶液的 随温度升高而减小,这主要是
随温度升高而减小,这主要是 改变与水解平衡移动共同作用的结果,其中
改变与水解平衡移动共同作用的结果,其中___________ 发挥主导作用。实验1中测得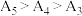 ,且当
,且当 时,实验过程中观察到有气泡产生。
时,实验过程中观察到有气泡产生。
(5)针对(4)中实验现象,小组同学继续开展探究。
查阅资料: 溶液中存在平衡:
溶液中存在平衡: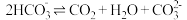 。
。
提出猜想:对于 溶液,当
溶液,当 时,该反应进行程度很小;当
时,该反应进行程度很小;当 时,该反应进行程度明显增大。
时,该反应进行程度明显增大。
实验验证:该小组同学设计如下方案进行实验,进一步验证猜想。补充表格内容。
实验结论:②根据实验1~3的结果,小组同学认为猜想成立,其判断依据是___________ 。
拓展总结:③ 溶液中存在
溶液中存在 的自偶电离平衡:
的自偶电离平衡: 时,
时, 自偶电离的平衡常数为
自偶电离的平衡常数为___________ [保留两位有效数字;已知: 时,
时, ]。当温度升高时,
]。当温度升高时, 更易分解,
更易分解, 从体系逸出,促进了
从体系逸出,促进了 在溶液中的分解。
在溶液中的分解。
(6)写出 在生产或生活中的一种应用
在生产或生活中的一种应用___________ 。
 用途广泛。某实验小组同学围绕
用途广泛。某实验小组同学围绕 开展如下实验活动。
开展如下实验活动。 .配制溶液
.配制溶液(1)配制
 的
的 溶液,需要称量
溶液,需要称量 固体的质量为
固体的质量为 。
。(2)上述配制溶液的过程中,用到的玻璃仪器除玻璃棒、量筒、胶头滴管外,还有
 .实验探究
.实验探究探究温度对
 溶液
溶液 的影响,进行如下实验(不考虑水的挥发)。
的影响,进行如下实验(不考虑水的挥发)。| 实验序号 | 操作 | 测试温度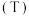 |  |
| 1 | 采用水浴加热,将 溶液从 溶液从 持续升温至 持续升温至 ,每隔 ,每隔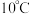 测量并记录溶液 测量并记录溶液 |  |  |
 |  | ||
 |  | ||
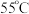 |  | ||
 | 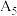 |
(3)
 溶液显碱性的原因是
溶液显碱性的原因是(4)实验1中测得
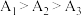 ,可知当
,可知当 时,
时, 溶液的
溶液的 随温度升高而减小,这主要是
随温度升高而减小,这主要是 改变与水解平衡移动共同作用的结果,其中
改变与水解平衡移动共同作用的结果,其中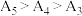 ,且当
,且当 时,实验过程中观察到有气泡产生。
时,实验过程中观察到有气泡产生。(5)针对(4)中实验现象,小组同学继续开展探究。
查阅资料:
 溶液中存在平衡:
溶液中存在平衡: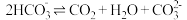 。
。提出猜想:对于
 溶液,当
溶液,当 时,该反应进行程度很小;当
时,该反应进行程度很小;当 时,该反应进行程度明显增大。
时,该反应进行程度明显增大。实验验证:该小组同学设计如下方案进行实验,进一步验证猜想。补充表格内容。
| 实验序号 | 操作 | 测试温度 |  |
| 2 | 采用水浴加热,① ,并记录溶液 ,并记录溶液 |  |  |
| 3 | 采用水浴加热,将 溶液从 溶液从 升温至 升温至 ,然后冷却至 ,然后冷却至 ,并记录溶液 ,并记录溶液 |  |  |
拓展总结:③
 溶液中存在
溶液中存在 的自偶电离平衡:
的自偶电离平衡: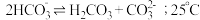 时,
时, 自偶电离的平衡常数为
自偶电离的平衡常数为 时,
时,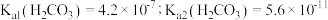 ]。当温度升高时,
]。当温度升高时, 更易分解,
更易分解, 从体系逸出,促进了
从体系逸出,促进了 在溶液中的分解。
在溶液中的分解。(6)写出
 在生产或生活中的一种应用
在生产或生活中的一种应用
您最近一年使用:0次
2024-05-29更新
|
657次组卷
|
2卷引用:2024届湖北省武汉市黄陂区第七高级中学高三下学期二模化学试题
2 . 联氨(又称肼,N2H4无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)联氨分子是___________ 分子(填“极性”或“非极性”),其中氮的杂化方式为___________ 。
(2)①2O2(g)+N2(g)=N2O4(1) H1
H1
②N2(g)+2H2(g)=N2H4(1) H2
H2
③O2(g)+2H2(g)=2H2O(g) H3
H3
④2N2H4(1)+N2O4(1)=3N2(g)+4H2O(g) △H4=-1048.9kJ/mo1
上述反应热效应之间的关系式为△H4=___________ ,联氨和N2O4可作为火箭推进剂的主要原因为___________ 。
(3)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为___________ (已知:N2H4+H+
 的K=8.7×107;Kw=1.0×10-14);联氨与硫酸形成的酸式盐的化学式为
的K=8.7×107;Kw=1.0×10-14);联氨与硫酸形成的酸式盐的化学式为___________ 。
(4)联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶液,观察到的现象是固体逐渐变黑,并有气泡产生﹐发生的化学方程式为___________ 。联氨可用于处理高压锅炉水中的氧。防止锅炉被腐蚀。理论上2kg的联氨可除去水中溶解的O2___________ kg。
(1)联氨分子是
(2)①2O2(g)+N2(g)=N2O4(1)
 H1
H1②N2(g)+2H2(g)=N2H4(1)
 H2
H2③O2(g)+2H2(g)=2H2O(g)
 H3
H3④2N2H4(1)+N2O4(1)=3N2(g)+4H2O(g) △H4=-1048.9kJ/mo1
上述反应热效应之间的关系式为△H4=
(3)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为

 的K=8.7×107;Kw=1.0×10-14);联氨与硫酸形成的酸式盐的化学式为
的K=8.7×107;Kw=1.0×10-14);联氨与硫酸形成的酸式盐的化学式为(4)联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶液,观察到的现象是固体逐渐变黑,并有气泡产生﹐发生的化学方程式为
您最近一年使用:0次
3 . 一定条件下,水气变换反应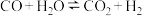 的中间产物是
的中间产物是 。为探究该反应过程,研究
。为探究该反应过程,研究 水溶液在密封石英管中的分解反应:
水溶液在密封石英管中的分解反应:
Ⅰ.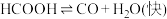
Ⅱ.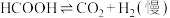
研究发现,在反应Ⅰ、Ⅱ中, 仅对反应Ⅰ有催加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水电离,其浓度视为常数。回答下列问题:
仅对反应Ⅰ有催加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水电离,其浓度视为常数。回答下列问题:
(1)一定条件下,反应Ⅰ、Ⅱ的焓变分别为 、
、 ,则该条件下水气变换反应的焓变
,则该条件下水气变换反应的焓变
_____ (用含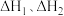 的代数式表示)。
的代数式表示)。
(2)反应Ⅰ正反应速率方程为: ,k为反应速率常数。
,k为反应速率常数。 温度下,
温度下, 电离平衡常数为
电离平衡常数为 ,当
,当 平衡浓度为
平衡浓度为 时,
时, 浓度为
浓度为_____  ,此时反应Ⅰ的反应速率
,此时反应Ⅰ的反应速率
_____  (用含
(用含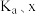 和k的代数式表示)。
和k的代数式表示)。
(3) 温度下,在密封石英管内完全充满
温度下,在密封石英管内完全充满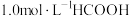 水溶液,使
水溶液,使 分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。
分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。 时刻测得
时刻测得 的浓度分别为
的浓度分别为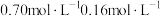 ,反应Ⅱ达平衡时,测得
,反应Ⅱ达平衡时,测得 的浓度为
的浓度为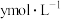 。体系达平衡后
。体系达平衡后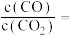
_____ (用含y的代数式表示,下同),反应Ⅱ的平衡常数为_____ 。
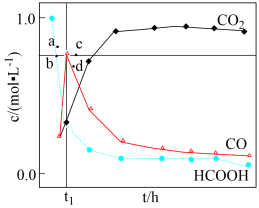
相同条件下,若反应起始时溶液中同时还含有 盐酸,则图示点
盐酸,则图示点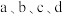 中,
中, 的浓度峰值点可能是
的浓度峰值点可能是_____ (填标号)。与不含盐酸相比, 达浓度峰值时,
达浓度峰值时, 浓度
浓度_____ (填“增大”“减小”或“不变”), 的值
的值_____ (填“增大”“减小”或“不变”)。
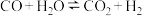 的中间产物是
的中间产物是 。为探究该反应过程,研究
。为探究该反应过程,研究 水溶液在密封石英管中的分解反应:
水溶液在密封石英管中的分解反应:Ⅰ.
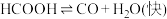
Ⅱ.
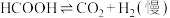
研究发现,在反应Ⅰ、Ⅱ中,
 仅对反应Ⅰ有催加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水电离,其浓度视为常数。回答下列问题:
仅对反应Ⅰ有催加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。忽略水电离,其浓度视为常数。回答下列问题:(1)一定条件下,反应Ⅰ、Ⅱ的焓变分别为
 、
、 ,则该条件下水气变换反应的焓变
,则该条件下水气变换反应的焓变
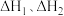 的代数式表示)。
的代数式表示)。(2)反应Ⅰ正反应速率方程为:
 ,k为反应速率常数。
,k为反应速率常数。 温度下,
温度下, 电离平衡常数为
电离平衡常数为 ,当
,当 平衡浓度为
平衡浓度为 时,
时, 浓度为
浓度为 ,此时反应Ⅰ的反应速率
,此时反应Ⅰ的反应速率
 (用含
(用含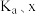 和k的代数式表示)。
和k的代数式表示)。(3)
 温度下,在密封石英管内完全充满
温度下,在密封石英管内完全充满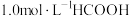 水溶液,使
水溶液,使 分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。
分解,分解产物均完全溶于水。含碳物种浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。 时刻测得
时刻测得 的浓度分别为
的浓度分别为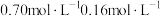 ,反应Ⅱ达平衡时,测得
,反应Ⅱ达平衡时,测得 的浓度为
的浓度为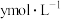 。体系达平衡后
。体系达平衡后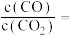

相同条件下,若反应起始时溶液中同时还含有
 盐酸,则图示点
盐酸,则图示点 中,
中, 的浓度峰值点可能是
的浓度峰值点可能是 达浓度峰值时,
达浓度峰值时, 浓度
浓度 的值
的值
您最近一年使用:0次
2023-06-19更新
|
10606次组卷
|
10卷引用:湖北省武汉市第二中学2023-2024学年高二上学期10月月考化学试题
湖北省武汉市第二中学2023-2024学年高二上学期10月月考化学试题湖北省武汉市第二中学2023-2024学年高三上学期10月月考化学试题2023年高考山东卷化学真题四川省宜宾市第四中学校2022-2023学年高二下学期6月期末化学试题(已下线)2023年高考山东卷化学真题变式题(原理综合题)(已下线)专题17 原理综合题(已下线)专题17 原理综合题(已下线)第20练 化学反应原理综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题15 化学反应原理综合题-2023年高考化学真题题源解密(全国通用)(已下线)专题04 电离平衡 水的电离和溶液的pH-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)
4 . Ⅰ.磷化铝(AlP)和磷化氢( )都是粮食储备常用的高效熏蒸杀虫剂。回答下列问题:
)都是粮食储备常用的高效熏蒸杀虫剂。回答下列问题:
(1)上述两种物质中所涉及的三种元素的第一电离能由大到小的顺序为___________ (填元素符号)。
(2)磷化氢( )在常温下是一种无色有大蒜臭味的有毒气体。以下关于
)在常温下是一种无色有大蒜臭味的有毒气体。以下关于 的说法正确的是___________(填序号)。
的说法正确的是___________(填序号)。
(3)工业制备 的流程如图所示:
的流程如图所示:

①黄磷和烧碱溶液反应的离子方程式为___________ ,次磷酸属于___________ (填“一”“二”或“三”)元酸。
②若开始时有 参加反应,则整个工业流程中转移的电子数为
参加反应,则整个工业流程中转移的电子数为___________ 。
(4) 的键角
的键角___________  (填“大于”或“小于”),原因为
(填“大于”或“小于”),原因为___________ 。
(5)已知亚磷酸( )为二元弱酸,其溶液中含磷粒子的物质的量分数与pH的关系如图所示。
)为二元弱酸,其溶液中含磷粒子的物质的量分数与pH的关系如图所示。

下列说法正确的是___________(填字母序号)。
 )都是粮食储备常用的高效熏蒸杀虫剂。回答下列问题:
)都是粮食储备常用的高效熏蒸杀虫剂。回答下列问题:(1)上述两种物质中所涉及的三种元素的第一电离能由大到小的顺序为
(2)磷化氢(
 )在常温下是一种无色有大蒜臭味的有毒气体。以下关于
)在常温下是一种无色有大蒜臭味的有毒气体。以下关于 的说法正确的是___________(填序号)。
的说法正确的是___________(填序号)。A. 是由极性键组成的非极性分子 是由极性键组成的非极性分子 |
B. 的相对分子质量大于 的相对分子质量大于 ,所以沸点高于的 ,所以沸点高于的 |
| C.中心原子的VSEPR构型是四面体形 |
D. 的稳定性大于 的稳定性大于 是因为分子间存在氢键 是因为分子间存在氢键 |
 的流程如图所示:
的流程如图所示:
①黄磷和烧碱溶液反应的离子方程式为
②若开始时有
 参加反应,则整个工业流程中转移的电子数为
参加反应,则整个工业流程中转移的电子数为(4)
 的键角
的键角 (填“大于”或“小于”),原因为
(填“大于”或“小于”),原因为(5)已知亚磷酸(
 )为二元弱酸,其溶液中含磷粒子的物质的量分数与pH的关系如图所示。
)为二元弱酸,其溶液中含磷粒子的物质的量分数与pH的关系如图所示。
下列说法正确的是___________(填字母序号)。
A. 的电离方程式为 的电离方程式为 |
B. 是正盐 是正盐 |
C. 溶液显碱性 溶液显碱性 |
D. 的平衡常数为 的平衡常数为 |
您最近一年使用:0次
5 . 丙酮酸(CH3COCOOH)、硫氰酸( HSCN)和氨硼烷(NH3BH3)是化学中一些热点物质。
(1)氨硼烷的结构式如图所示:
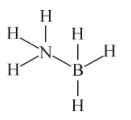
已知:H-N键的共用电子对偏离H,H-B键的共用电子对偏向H。H、B、N元素的电负性由大到小排序为_______ (填元素符号)。
(2)常温下加入蒸馏水分别稀释V0 mL硫氰酸溶液、丙酮酸溶液,得到溶液体积均为VmL。溶液pH与 之间关系如图所示。
之间关系如图所示。
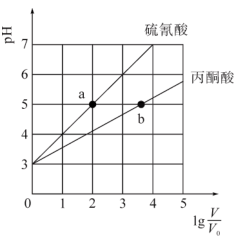
①起始时c( HSCN)_______ c(CH3CO-COOH)(填“>”“<”或“=”),判断的依据是_______ 。
②c(OH-) :a_______ b(填“>”“<”或“=”),判断的依据是_______ 。
③ =3时,加热上述两种溶液,
=3时,加热上述两种溶液, 会
会_______ (填“增大”减小”或“不变”)(不考虑酸挥发等损失)。
④等体积、等物质的量浓度的KSCN溶液(X)、CH3COCOOK溶液(Y)中,离子总浓度:X_______ Y(填“>”“<”或“=”)。
(3)已知:缓冲溶液指的是由弱酸及其盐、弱碱及其盐组成的混合溶液,能在一定程度上抵消、减轻外加少量强酸或强碱对溶液酸碱度的影响,从而保持溶液的pH相对稳定。当缓冲溶液中弱酸(或弱碱)与弱酸根离子(或弱碱的阳离子)浓度相等时缓冲能力最大。CH3COCOONa和CH3COCOOH组成的缓冲溶液中,缓冲能力最大时pH=3。
①室温下,CH3COCOOH的电离常数Ka为_______ 。
②用平衡移动原理解释“缓冲原理”:_______ 。
(1)氨硼烷的结构式如图所示:

已知:H-N键的共用电子对偏离H,H-B键的共用电子对偏向H。H、B、N元素的电负性由大到小排序为
(2)常温下加入蒸馏水分别稀释V0 mL硫氰酸溶液、丙酮酸溶液,得到溶液体积均为VmL。溶液pH与
 之间关系如图所示。
之间关系如图所示。
①起始时c( HSCN)
②c(OH-) :a
③
 =3时,加热上述两种溶液,
=3时,加热上述两种溶液, 会
会④等体积、等物质的量浓度的KSCN溶液(X)、CH3COCOOK溶液(Y)中,离子总浓度:X
(3)已知:缓冲溶液指的是由弱酸及其盐、弱碱及其盐组成的混合溶液,能在一定程度上抵消、减轻外加少量强酸或强碱对溶液酸碱度的影响,从而保持溶液的pH相对稳定。当缓冲溶液中弱酸(或弱碱)与弱酸根离子(或弱碱的阳离子)浓度相等时缓冲能力最大。CH3COCOONa和CH3COCOOH组成的缓冲溶液中,缓冲能力最大时pH=3。
①室温下,CH3COCOOH的电离常数Ka为
②用平衡移动原理解释“缓冲原理”:
您最近一年使用:0次
名校
解题方法
6 . 全球大气 浓度升高对人类生产、生活产生影响,碳及其化合物的资源化利用成为研究热点。回答下列问题:
浓度升高对人类生产、生活产生影响,碳及其化合物的资源化利用成为研究热点。回答下列问题:
(1)已知25℃时,大气中的 溶于水存在以下过程:
溶于水存在以下过程:
①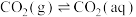
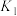
②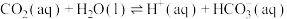

过程①的混合平衡常数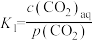 ,其中
,其中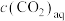 表示溶液中的
表示溶液中的 浓度,
浓度,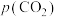 表示大气中
表示大气中 的分压(单位:kPa)。温度升高,
的分压(单位:kPa)。温度升高,
______ (填“增大”或“减小”);当大气压强为akPa,溶液中的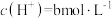 (忽略
(忽略 和水的电离)时,大气中
和水的电离)时,大气中 的体积分数为
的体积分数为______ 。
(2)由 转化制甲醇具有重要的经济效益。反应
转化制甲醇具有重要的经济效益。反应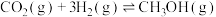
 ,在有、无催化剂条件下的反应机理和相对能量的变化如图所示(吸附在催化剂表面上的粒子用*标注,TS为过渡态)。
,在有、无催化剂条件下的反应机理和相对能量的变化如图所示(吸附在催化剂表面上的粒子用*标注,TS为过渡态)。
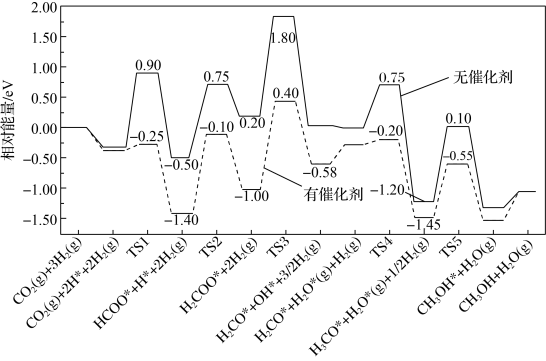
该反应历程中决速步骤的化学方程式为______ ,有催化剂时决速步骤的活化能为______ eV。
(3)一种脱除和利用工厂废气中 方法的示意图如下:
方法的示意图如下:
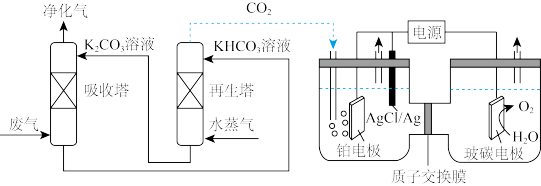
①某温度下,吸收塔中 溶液吸收一定量的
溶液吸收一定量的 后,溶液的
后,溶液的 ,则
,则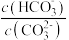 =
=______ (该温度下 的
的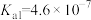 ,
,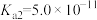 );
);
②再生塔中产生 的离子方程式为
的离子方程式为______ 。
③利用电化学原理将 同时转化为多种燃料(
同时转化为多种燃料( 、
、 、
、 及CO),将
及CO),将 电催化还原为
电催化还原为 ,阴极反应式为
,阴极反应式为______ 。若铂电极上只生成6.4g ,则正极区产生气体标准状况下的体积为
,则正极区产生气体标准状况下的体积为______ L。
 浓度升高对人类生产、生活产生影响,碳及其化合物的资源化利用成为研究热点。回答下列问题:
浓度升高对人类生产、生活产生影响,碳及其化合物的资源化利用成为研究热点。回答下列问题:(1)已知25℃时,大气中的
 溶于水存在以下过程:
溶于水存在以下过程:①
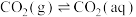
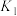
②
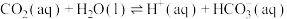

过程①的混合平衡常数
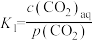 ,其中
,其中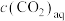 表示溶液中的
表示溶液中的 浓度,
浓度,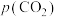 表示大气中
表示大气中 的分压(单位:kPa)。温度升高,
的分压(单位:kPa)。温度升高,
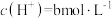 (忽略
(忽略 和水的电离)时,大气中
和水的电离)时,大气中 的体积分数为
的体积分数为(2)由
 转化制甲醇具有重要的经济效益。反应
转化制甲醇具有重要的经济效益。反应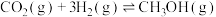
 ,在有、无催化剂条件下的反应机理和相对能量的变化如图所示(吸附在催化剂表面上的粒子用*标注,TS为过渡态)。
,在有、无催化剂条件下的反应机理和相对能量的变化如图所示(吸附在催化剂表面上的粒子用*标注,TS为过渡态)。
该反应历程中决速步骤的化学方程式为
(3)一种脱除和利用工厂废气中
 方法的示意图如下:
方法的示意图如下:
①某温度下,吸收塔中
 溶液吸收一定量的
溶液吸收一定量的 后,溶液的
后,溶液的 ,则
,则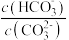 =
= 的
的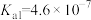 ,
,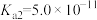 );
);②再生塔中产生
 的离子方程式为
的离子方程式为③利用电化学原理将
 同时转化为多种燃料(
同时转化为多种燃料( 、
、 、
、 及CO),将
及CO),将 电催化还原为
电催化还原为 ,阴极反应式为
,阴极反应式为 ,则正极区产生气体标准状况下的体积为
,则正极区产生气体标准状况下的体积为
您最近一年使用:0次
2022-12-08更新
|
540次组卷
|
2卷引用:湖北省黄冈中学2023 届高三下学期第二次模拟考试化学试题
7 . 利用太阳能等可再生能源,通过光催化、光电催化或电解水制氢,再与一氧化碳反应制甲醇、甲醚。发生的反应有:
Ⅰ.2H2(g)+CO(g) CH3OH(g)ΔH1= —90.8kJ∙mol-1
CH3OH(g)ΔH1= —90.8kJ∙mol-1
Ⅱ.3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)ΔH2=—246.0kJ∙mol-1
CH3OCH3(g)+CO2(g)ΔH2=—246.0kJ∙mol-1
Ⅲ.CO(g) +H2O(g) CO2(g)+H2(g)ΔH3=—41.3kJ∙mol-1
CO2(g)+H2(g)ΔH3=—41.3kJ∙mol-1
(1)反应2CH3OH(g) CH3OCH3(g)+H2O(g)的ΔH=
CH3OCH3(g)+H2O(g)的ΔH=_______ 。
(2)在恒温条件下,将1 molH2和1 mol CO投入到刚性容器中,发生反应Ⅰ,下列说法正确的是_______(填选项序号)。
(3)根据反应Ⅰ,画出H2与CO投料比与CH3OH的平衡体积分数(V%)变化趋势图_______ 。
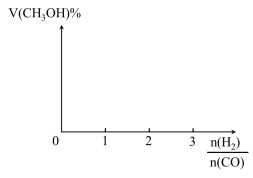
(4)将组成为2:1的H2和CO充入恒温密闭容器中,分别在48MPa和60MPa恒压条件下发生反应Ⅰ,实验测得不同温度下CH3OH的平衡体积分数(V%)随温度(T)变化示意图如图所示:
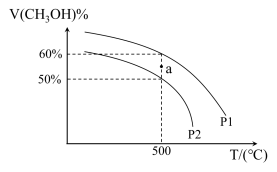
①500℃,48MPa时a点v正_______ v逆;
②计算500℃,60MPa时该反应的平衡常数Kp=_______ Mpa-2(Kp为用气体的平衡分压代替物质的量浓度计算的平衡常数)。
(5)调节溶液pH可实现工业废气CO2的捕获和释放。已知25℃碳酸电离常数为Ka1、Ka2,当溶液pH=12时,c(H2CO3):c( ):c(
):c( )=1:
)=1:_______ :_______ 。(用Ka1、Ka2表示)。
Ⅰ.2H2(g)+CO(g)
 CH3OH(g)ΔH1= —90.8kJ∙mol-1
CH3OH(g)ΔH1= —90.8kJ∙mol-1Ⅱ.3H2(g)+3CO(g)
 CH3OCH3(g)+CO2(g)ΔH2=—246.0kJ∙mol-1
CH3OCH3(g)+CO2(g)ΔH2=—246.0kJ∙mol-1Ⅲ.CO(g) +H2O(g)
 CO2(g)+H2(g)ΔH3=—41.3kJ∙mol-1
CO2(g)+H2(g)ΔH3=—41.3kJ∙mol-1(1)反应2CH3OH(g)
 CH3OCH3(g)+H2O(g)的ΔH=
CH3OCH3(g)+H2O(g)的ΔH=(2)在恒温条件下,将1 molH2和1 mol CO投入到刚性容器中,发生反应Ⅰ,下列说法正确的是_______(填选项序号)。
| A.当容器中混合气体的平均相对分子质量不再变化时反应达到平衡状态 |
| B.当CO的体积分数不变时反应达到平衡状态 |
| C.反应放出的热量等于45.4 kJ |
| D.平衡后,再充入1molH2和1molCO,再次达到平衡,H2和CO的转化率均增大 |

(4)将组成为2:1的H2和CO充入恒温密闭容器中,分别在48MPa和60MPa恒压条件下发生反应Ⅰ,实验测得不同温度下CH3OH的平衡体积分数(V%)随温度(T)变化示意图如图所示:

①500℃,48MPa时a点v正
②计算500℃,60MPa时该反应的平衡常数Kp=
(5)调节溶液pH可实现工业废气CO2的捕获和释放。已知25℃碳酸电离常数为Ka1、Ka2,当溶液pH=12时,c(H2CO3):c(
 ):c(
):c( )=1:
)=1:
您最近一年使用:0次
8 . 电解锰渣主要含MnSO4、MnO2、PbSO4、CaSO4及少量的SiO2、Fe2(SO4)3,利用电解锰渣回收铅的工艺如下图所示:

已知:①Ksp (PbSO4)=2.6×10-8,Ksp(PbCO3)=7.4×10-14,Ksp(CaCO3)=2.8×10-9;
②Pb(CH3COO)2为弱电解质
回答下列问题:
(1)基态Mn2+的核外电子排布式为_______ ,“还原酸浸”时,MnO2被还原的化学方程式为_______ ;
(2)“浸出液”含有的盐类主要有MnSO4和少量的FeSO4、_______ ,经除杂后得到精制MnSO4溶液。如图为MnSO4的溶解度随温度的变化曲线,从精制MnSO4溶液中获得MnSO4晶体的方法为_______ 。

(3)写出“浸铅”PbSO4溶解的离子反应方程式_______ 。
(4)若“浸铅”后所得溶液中 c(Pb2+)=c(Ca2+)=0.1 mol·L-1,为实现铅与钙的分离,应控制“沉铅”溶液中c( )的范围为
)的范围为_______ mol·L-1(当溶液中金属离子浓度小于1×10-5 mol·L-1,可以认为该离子沉淀完全。)
(5)写出“沉铅”的离子方程式_______ 。

已知:①Ksp (PbSO4)=2.6×10-8,Ksp(PbCO3)=7.4×10-14,Ksp(CaCO3)=2.8×10-9;
②Pb(CH3COO)2为弱电解质
回答下列问题:
(1)基态Mn2+的核外电子排布式为
(2)“浸出液”含有的盐类主要有MnSO4和少量的FeSO4、

(3)写出“浸铅”PbSO4溶解的离子反应方程式
(4)若“浸铅”后所得溶液中 c(Pb2+)=c(Ca2+)=0.1 mol·L-1,为实现铅与钙的分离,应控制“沉铅”溶液中c(
 )的范围为
)的范围为(5)写出“沉铅”的离子方程式
您最近一年使用:0次
9 . 钪(Sc)是一种稀土金属。从钛白酸性废水(主要含Ti4+、Fe2+,微量Sc3+)中富集钪,并回收金属钪(Sc)和草酸的工艺流程如图。

已知:①“沉钪3”过程中ScF3与氯化物形成的复盐沉淀3NH4Cl·ScF3·6H2O,在强酸中部分溶解。
②“脱水除铵”是复盐沉淀的热分解过程。
③25℃时,部分物质的相关信息如表所示:
回答下列问题:
(1)“萃取分液”需要的玻璃仪器有____ 。
(2)“酸洗氧化”时加入H2O2的目的是____ 。
(3)“滤液1”中金属阳离子主要为Sc3+,检验“滤液1”中是否含Fe3+的操作为____ 。
(4)写出“沉钪2”时反应的离子化学方程式____ 。
(5)含钪元素的微粒与lgc(F-)、pH的关系如图所示,用氨水调节溶液的pH值,控制pH的范围是3.5<pH<____ 。

(6)向“沉钪2”的滤液中加入PbSO4,过滤,再向滤渣中加入硫酸酸化,可回收草酸。加入PbSO4发生的离子反应为PbSO4(s)+H2C2O4(aq) PbC2O4(s)+2H+(aq)+SO
PbC2O4(s)+2H+(aq)+SO (aq),该反应的平衡常数K=
(aq),该反应的平衡常数K=____ 。
(7)钛白酸性废水中Sc3+含量10.0~20.0mg·L-1,该工艺日处理钛白酸性废水50.0m3,理论上消耗金属Ca的质量最多_____ kg(保留3位有效数字)。

已知:①“沉钪3”过程中ScF3与氯化物形成的复盐沉淀3NH4Cl·ScF3·6H2O,在强酸中部分溶解。
②“脱水除铵”是复盐沉淀的热分解过程。
③25℃时,部分物质的相关信息如表所示:
| Ksp(PbSO4) | Ksp(PbC2O4) | Ka1(H2C2O4) | Ka2(H2C2O4) |
| 2.0×10-8 | 5.0×10-10 | 6.0×10-2 | 6.25×10-5 |
回答下列问题:
(1)“萃取分液”需要的玻璃仪器有
(2)“酸洗氧化”时加入H2O2的目的是
(3)“滤液1”中金属阳离子主要为Sc3+,检验“滤液1”中是否含Fe3+的操作为
(4)写出“沉钪2”时反应的离子化学方程式
(5)含钪元素的微粒与lgc(F-)、pH的关系如图所示,用氨水调节溶液的pH值,控制pH的范围是3.5<pH<

(6)向“沉钪2”的滤液中加入PbSO4,过滤,再向滤渣中加入硫酸酸化,可回收草酸。加入PbSO4发生的离子反应为PbSO4(s)+H2C2O4(aq)
 PbC2O4(s)+2H+(aq)+SO
PbC2O4(s)+2H+(aq)+SO (aq),该反应的平衡常数K=
(aq),该反应的平衡常数K=(7)钛白酸性废水中Sc3+含量10.0~20.0mg·L-1,该工艺日处理钛白酸性废水50.0m3,理论上消耗金属Ca的质量最多
您最近一年使用:0次
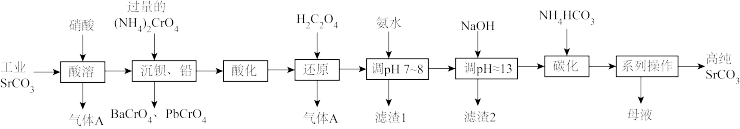
10 . 碳酸锶(SrCO3)难溶于水,主要用于电磁材料和金属冶炼。一种由工业碳酸锶(含少量Ba2+、Ca2+、Mg2+、 Pb2+等)制备高纯碳酸锶的工艺流程如下:
已知:I. Cr(OH)3为两性氢氧化物;
II.常温下,各物质的溶度积常数如下表所示。
回答下列问题:
(1)气体A的电子式为_______ 。
(2)“除钡、铅”时,pH过低会导致(NH4)2CrO4的利用率降低,原因为_______ (用离子方程式解释);“还原”时发生反应的离子方程式为_______ 。
(3)“滤渣1”的主要成分为_______ (填化学式)。
(4)用氨水和NaOH分步调节pH,而不是直接调节溶液的pH≈13的原因为_______ 。
(5)“调pH ≈13”后需对溶液进行煮沸并趁热过滤出滤渣2,煮沸并趁热过滤的原因为_______ 。
(6)已知:碳酸的电离常数Ka1=4.4×10-7、Ka2=4.7×10-11,则“碳化”时,反应Sr2+(aq)+2HCO (aq)
(aq) SrCO3(s)+H2CO3(aq)的平衡常数K=
SrCO3(s)+H2CO3(aq)的平衡常数K=_______ (保留两位有效数字)。
(7)“系列操作”中包含“200°C烘干”操作,烘干过程中除蒸发水分外,还能够除去SrCO3中的微量可溶性杂质,该杂质除NH4HCO3外还可能为_______ (填化学式)。

已知:I. Cr(OH)3为两性氢氧化物;
II.常温下,各物质的溶度积常数如下表所示。
| 化合物 | Cr(OH)3 | Ca(OH)2 | Mg(OH)2 | SrCO3 |
| Ksp近似值 | 1×10-31 | 5.5×10-6 | 1.8×10-11 | 5.6×10-10 |
(1)气体A的电子式为
(2)“除钡、铅”时,pH过低会导致(NH4)2CrO4的利用率降低,原因为
(3)“滤渣1”的主要成分为
(4)用氨水和NaOH分步调节pH,而不是直接调节溶液的pH≈13的原因为
(5)“调pH ≈13”后需对溶液进行煮沸并趁热过滤出滤渣2,煮沸并趁热过滤的原因为
(6)已知:碳酸的电离常数Ka1=4.4×10-7、Ka2=4.7×10-11,则“碳化”时,反应Sr2+(aq)+2HCO
 (aq)
(aq) SrCO3(s)+H2CO3(aq)的平衡常数K=
SrCO3(s)+H2CO3(aq)的平衡常数K=(7)“系列操作”中包含“200°C烘干”操作,烘干过程中除蒸发水分外,还能够除去SrCO3中的微量可溶性杂质,该杂质除NH4HCO3外还可能为
您最近一年使用:0次
2022-04-09更新
|
1200次组卷
|
13卷引用:湖北省宜昌市夷陵中学2022届高三5月第二次限时训练(四模)化学试题
湖北省宜昌市夷陵中学2022届高三5月第二次限时训练(四模)化学试题湖北省宜昌英杰学校2021-2022学年高三上学期9月月考化学试题河北省石家庄市2022届高三毕业班教学质量检测二(一模)化学试题(已下线)秘籍17 工艺流程的条件控制与计算-备战2022年高考化学抢分秘籍(全国通用)(已下线)专项15 工艺流程综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)(已下线)化学-2022年高考押题预测卷01(山东卷)(已下线)化学-2022年高考考前押题密卷(湖南卷)(已下线)化学-2022年高考考前押题密卷(重庆卷)辽宁省抚顺市第二中学2021-2022学年高三上学期10月月考化学试题山东省鄄城县第一中学2022-2023学年高二上学期期末考试化学试题湖南省株洲市九方中学2022-2023学年高三上学期第一次月考化学试题(已下线)河北省石家庄市2022届高三毕业班教学质量检测二(一模)(工业流程题)湖南省邵阳市第一中学2023届高三第五次月考化学试题



