1 . 锰酸锂(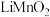 )是锂电池的正极材料。以软锰矿粉(主要成分是
)是锂电池的正极材料。以软锰矿粉(主要成分是 ,含少量
,含少量 、
、 、
、 、
、 等)为原料制备锰酸锂的流程如下:
等)为原料制备锰酸锂的流程如下:
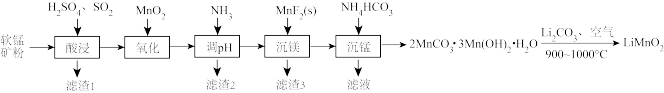
常温下,几种难溶物质的溶度积数据如下表:
请回答下列问题:
(1)“酸浸”时,常在高压下充入 ,其目的是
,其目的是___________ 。
(2)“滤渣1”的主要成分是___________ (填化学式,下同),“酸浸”时,被氧化的物质是___________ 。
(3)“氧化”时 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(4)“调 ”时发生反应:
”时发生反应: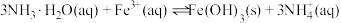 ,该反应的平衡常数
,该反应的平衡常数
___________ 。(已知:常温下, 的电离常数
的电离常数 )
)
(5)测得“沉镁”后溶液中 ,则残留的
,则残留的
___________  。“沉锰”后的滤液与碱加热处理后可返回
。“沉锰”后的滤液与碱加热处理后可返回___________ (填步骤名称)步骤循环利用。
(6)“沉锰”生成碱式碳酸锰[ ]的同时放出
]的同时放出 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。利用碱式碳酸锰制备锰酸锂的化学方程式为___________ 。
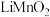 )是锂电池的正极材料。以软锰矿粉(主要成分是
)是锂电池的正极材料。以软锰矿粉(主要成分是 ,含少量
,含少量 、
、 、
、 、
、 等)为原料制备锰酸锂的流程如下:
等)为原料制备锰酸锂的流程如下:
常温下,几种难溶物质的溶度积数据如下表:
| 物质 |  |  |  |  |
 |  |  |  |  |
请回答下列问题:
(1)“酸浸”时,常在高压下充入
 ,其目的是
,其目的是(2)“滤渣1”的主要成分是
(3)“氧化”时
 发生反应的离子方程式为
发生反应的离子方程式为(4)“调
 ”时发生反应:
”时发生反应: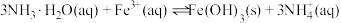 ,该反应的平衡常数
,该反应的平衡常数
 的电离常数
的电离常数 )
)(5)测得“沉镁”后溶液中
 ,则残留的
,则残留的
 。“沉锰”后的滤液与碱加热处理后可返回
。“沉锰”后的滤液与碱加热处理后可返回(6)“沉锰”生成碱式碳酸锰[
 ]的同时放出
]的同时放出 ,该反应的离子方程式为
,该反应的离子方程式为
您最近一年使用:0次
2022-04-15更新
|
1131次组卷
|
5卷引用:甘肃省白银市靖远县2021-2022学年高三下学期开学考试理综化学试题
甘肃省白银市靖远县2021-2022学年高三下学期开学考试理综化学试题陕西省榆林市2022届高三第二次联考化学试题(已下线)化学-2022年高考押题预测卷03(全国甲卷)(已下线)【直抵名校】05-备战2022年高考化学名校进阶模拟卷(通用版)(已下线)微专题26 化学工艺流程题-----核心反应与条件控制-备战2023年高考化学一轮复习考点微专题
名校
2 . 电解质水溶液中存在电离平衡、水解平衡,已知部分弱电解质的电离常数如表:
回答下列问题:
(1)0.1mol·L‒1的NaClO溶液和0.1mol·L‒1的Na2CO3溶液中,c(ClO‒)___ (填“>”“<”或“=”)c(CO )。
)。
(2)HCOO‒、ClO‒、CO 、HCO
、HCO 中,结合质子能力最强的是
中,结合质子能力最强的是___ ,将少量CO2通入NaClO溶液,反应的离子方程式是___ 。
(3)将体积相同,pH=5的HCOOH和pH=5的H2SO4加水稀释到pH=6,需水的体积:HCOOH___ (填“大于”“小于”或者“等于”,下同)H2SO4;分别与足量的锌粉反应,反应过程中的平均反应速率:HCOOH___ H2SO4。
(4)25℃时,0.01mol·L‒1的HCOOH和0.01mol·L‒1的氨水等体积混合后溶液呈___ (填“酸”或“碱”)性;若amol·L‒1的HCOOH与0.01mol·L‒1的NaOH溶液等体积混合,所得溶液中c(HCOO‒)=c(Na+),则该温度下HCOOH的电离常数Ka=___ (用含a的代数式表示)。
(5)室温下,用0.100mol·L‒1的盐酸滴定20.00mL0.100mol·L‒1氨水,滴定曲线如图所示。
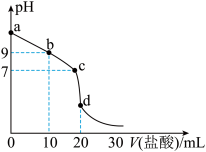
①d点所示的溶液中离子浓度由大到小的顺序为___ 。
②b点所示的溶液中c(NH )-c(NH3·H2O)=
)-c(NH3·H2O)=___ mol·L‒1(写出精确结果,不做近似计算)。
| 弱酸 | HCOOH | HClO | H2CO3 | NH3•H2O |
| 电离常数(25℃) | Ka=1.77×10‒4 | Ka=4.3×10‒10 | Ka1=5.0×10‒7 Ka2=5.6×10‒11 | Kb=1.75×10‒5 |
(1)0.1mol·L‒1的NaClO溶液和0.1mol·L‒1的Na2CO3溶液中,c(ClO‒)
 )。
)。(2)HCOO‒、ClO‒、CO
 、HCO
、HCO 中,结合质子能力最强的是
中,结合质子能力最强的是(3)将体积相同,pH=5的HCOOH和pH=5的H2SO4加水稀释到pH=6,需水的体积:HCOOH
(4)25℃时,0.01mol·L‒1的HCOOH和0.01mol·L‒1的氨水等体积混合后溶液呈
(5)室温下,用0.100mol·L‒1的盐酸滴定20.00mL0.100mol·L‒1氨水,滴定曲线如图所示。

①d点所示的溶液中离子浓度由大到小的顺序为
②b点所示的溶液中c(NH
 )-c(NH3·H2O)=
)-c(NH3·H2O)=
您最近一年使用:0次
2021-01-31更新
|
211次组卷
|
5卷引用:甘肃省武威市民勤一中、天祝一中、古浪一中2022-2023学年高二下学期3月月考化学试题
名校
3 . 已知t ℃时,0.01mol/L NaOH溶液的pH=11,0.1mol/L的HA溶液中c(H+)/c(OH-)=109。
请回答下列问题:
(1)该温度下,水的离子积Kw=_____ ,0.1mol/L的HA溶液中水电离出的c(OH-)=_____ 。
(2)在室温下,蒸馏水稀释0.01mol/L HA溶液时,下列呈减小趋势的是_____ 。
A.水的电离程度 B.c(HA)/c(A-)
C.溶液中c(H+)和c(OH-)的乘积 D.溶液中c(A-)·c(HA)的值
(3)室温下,取pH=2的盐酸和HA溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示:

①图中表示HA溶液pH变化曲线的是____ (填“A”或“B”)。
②设盐酸中加入Zn的质量为m1,HA溶液中加入Zn的质量为m2,则m1_____ m2(填“>”“<”或“=”)。
请回答下列问题:
(1)该温度下,水的离子积Kw=
(2)在室温下,蒸馏水稀释0.01mol/L HA溶液时,下列呈减小趋势的是
A.水的电离程度 B.c(HA)/c(A-)
C.溶液中c(H+)和c(OH-)的乘积 D.溶液中c(A-)·c(HA)的值
(3)室温下,取pH=2的盐酸和HA溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示:

①图中表示HA溶液pH变化曲线的是
②设盐酸中加入Zn的质量为m1,HA溶液中加入Zn的质量为m2,则m1
您最近一年使用:0次
2020-09-27更新
|
136次组卷
|
2卷引用:甘肃省民勤县第一中学2020-2021学年高二下学期(理)开学考试化学试题
名校
解题方法
4 . 物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡。根据所学知识回答下列问题:
(1)下列方法中,可以使0.10mol/LCH3COOH溶液中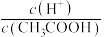 值增大的措施是
值增大的措施是_______________ (填序号)。
a.加水稀释 b.加入少量CH3COONa固体 c.加入少量冰醋酸 d.通入少量HCl气体 e.加少量烧碱溶液 f.升高温度
(2)t℃时,水的离子积常数Kw=1×10-12。
①该温度下,若100体积pH=a的H2SO4溶液与1体积pH=b的NaOH溶液混合后溶液呈中性,则a+b=_________ 。
②该温度下,pH=2的某酸HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。试分析其原因:_______________________ ;该混合溶液中:c(A-)-c(Na+)=______________________ mol/L(填数值)。
(3)25℃下,有浓度均为0.1mol/L的三种溶液:a.NaHCO3;b.NaClO;c.CH3COONa。(已知25℃时电离常数:H2CO3 K1=4.4×10-7,K2=4.7×10-11;HClO K=3.0×10-8;CH3COOH K=1.8×10-5)
①三种溶液pH由小到大的顺序为:_______________________________ (填序号)。
②溶液a的pH大于8,则溶液中c(H2CO3)_____ c(CO32-)(填“>”、“<”或“=”)。
(4)已知25℃时,Ksp(AgCl)=1.8×10-10,现将足量氯化银分别放入:
a.100mL蒸馏水中;
b.100mL 0.2mol/LAgNO3溶液中;
c.100mL 0.1mol/L氯化铝溶液中;
d.100mL 0.1mol/L盐酸溶液中。
充分搅拌后,相同温度下银离子浓度由大到小的顺序是________________ (填写序号);b中氯离子的浓度为_________________ 。
(1)下列方法中,可以使0.10mol/LCH3COOH溶液中
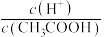 值增大的措施是
值增大的措施是a.加水稀释 b.加入少量CH3COONa固体 c.加入少量冰醋酸 d.通入少量HCl气体 e.加少量烧碱溶液 f.升高温度
(2)t℃时,水的离子积常数Kw=1×10-12。
①该温度下,若100体积pH=a的H2SO4溶液与1体积pH=b的NaOH溶液混合后溶液呈中性,则a+b=
②该温度下,pH=2的某酸HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。试分析其原因:
(3)25℃下,有浓度均为0.1mol/L的三种溶液:a.NaHCO3;b.NaClO;c.CH3COONa。(已知25℃时电离常数:H2CO3 K1=4.4×10-7,K2=4.7×10-11;HClO K=3.0×10-8;CH3COOH K=1.8×10-5)
①三种溶液pH由小到大的顺序为:
②溶液a的pH大于8,则溶液中c(H2CO3)
(4)已知25℃时,Ksp(AgCl)=1.8×10-10,现将足量氯化银分别放入:
a.100mL蒸馏水中;
b.100mL 0.2mol/LAgNO3溶液中;
c.100mL 0.1mol/L氯化铝溶液中;
d.100mL 0.1mol/L盐酸溶液中。
充分搅拌后,相同温度下银离子浓度由大到小的顺序是
您最近一年使用:0次
2020-04-18更新
|
388次组卷
|
3卷引用:甘肃省天水市第一中学2019-2020学年高二上学期期末考试化学试题
5 . 回收利用硫和氮的氧化物是保护环境的重要举措。

I.(1)工业生产可利用CO从燃煤烟气中脱硫。
已知S(s)的燃烧热(△H)为-mkJ/mol。CO与O2反应的能量变化如图所示,则CO从燃煤烟气中脱硫的热化学方程式为______ (△H用含m的代数式表示) 。
(2)在模拟回收硫的实验中,向某恒容密闭容器中通入2.8molCO和1molSO2气体,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。

①与实验a相比,实验c改变的实验条件可能是_________ 。
②请利用体积分数计算该条件下实验b的平衡常数K=________ 。(列出计算式即可)(注:某物质的体积分数=该物质的物质的量/气体的总物质的量)
(3)双碱法除去SO2的原理为:NaOH溶液 Na2SO3溶液。该方法能高效除去SO2并获得石膏。
Na2SO3溶液。该方法能高效除去SO2并获得石膏。
①该过程中NaOH溶液的作用是_______ 。
②25℃时,将一定量的SO2通入到100mL0.1mol/L的NaOH溶液中,两者完全反应得到含Na2SO3、NaHSO3的混合溶液,溶液恰好呈中性,则溶液中H2SO3的物质的量浓度是____ (假设反应前后溶液体积不变;25℃时,H2SO3的电离常数 K1=1.0×10-2 K2=5.0×10-8)。
II.用NH3消除NO污染的反应原理为:4NH3(g)+6NO(g) 5N2(g)+6H2O(l) △H= -1807.98kJ/mol 。不同温度条件下,NH3与NO的物质的量之比分别为4:1、3:1、1:3,得到NO脱除率曲线如图所示。
5N2(g)+6H2O(l) △H= -1807.98kJ/mol 。不同温度条件下,NH3与NO的物质的量之比分别为4:1、3:1、1:3,得到NO脱除率曲线如图所示。

(1)曲线a中NH3的起始浓度为4×10-5mol/L,从A点到B点经过1秒,该时间段内NO的脱除速率为____ mg/(L·s)。
(2)不论以何种比例混合,温度超过900℃,NO脱除率骤然下降,除了在高温条件下氮气与氧气发生反应生成NO,可能的原因还有(一条即可)____ 。

I.(1)工业生产可利用CO从燃煤烟气中脱硫。
已知S(s)的燃烧热(△H)为-mkJ/mol。CO与O2反应的能量变化如图所示,则CO从燃煤烟气中脱硫的热化学方程式为
(2)在模拟回收硫的实验中,向某恒容密闭容器中通入2.8molCO和1molSO2气体,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。

①与实验a相比,实验c改变的实验条件可能是
②请利用体积分数计算该条件下实验b的平衡常数K=
(3)双碱法除去SO2的原理为:NaOH溶液
 Na2SO3溶液。该方法能高效除去SO2并获得石膏。
Na2SO3溶液。该方法能高效除去SO2并获得石膏。①该过程中NaOH溶液的作用是
②25℃时,将一定量的SO2通入到100mL0.1mol/L的NaOH溶液中,两者完全反应得到含Na2SO3、NaHSO3的混合溶液,溶液恰好呈中性,则溶液中H2SO3的物质的量浓度是
II.用NH3消除NO污染的反应原理为:4NH3(g)+6NO(g)
 5N2(g)+6H2O(l) △H= -1807.98kJ/mol 。不同温度条件下,NH3与NO的物质的量之比分别为4:1、3:1、1:3,得到NO脱除率曲线如图所示。
5N2(g)+6H2O(l) △H= -1807.98kJ/mol 。不同温度条件下,NH3与NO的物质的量之比分别为4:1、3:1、1:3,得到NO脱除率曲线如图所示。
(1)曲线a中NH3的起始浓度为4×10-5mol/L,从A点到B点经过1秒,该时间段内NO的脱除速率为
(2)不论以何种比例混合,温度超过900℃,NO脱除率骤然下降,除了在高温条件下氮气与氧气发生反应生成NO,可能的原因还有(一条即可)
您最近一年使用:0次
2019-06-06更新
|
788次组卷
|
3卷引用:甘肃省张掖市临泽县第一中学2019-2020学年高二11月月考化学试题
甘肃省张掖市临泽县第一中学2019-2020学年高二11月月考化学试题【市级联考】山东省淄博市2019届高三三模考试理科综合化学试题(已下线)专题15 化学反应原理大题不丢分-2021年高考化学必做热点专题
名校
解题方法
6 . 氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a.CH4(g)+H2O(g) CO(g)+3H2(g) ΔH1=+216.4 kJ·mol-1
CO(g)+3H2(g) ΔH1=+216.4 kJ·mol-1
b.CO(g)+H2O(g) CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1
则反应CH4(g)+2H2O(g) CO2(g)+4H2(g) ΔH=
CO2(g)+4H2(g) ΔH=_________________________ 。
(2)起始时投入氮气和氢气的物质的量分别为1 mol、3 mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。

①恒压时,反应一定达到平衡状态的标志是________ (填序号)。
A N2和H2的转化率相等 B 反应体系密度保持不变
C c(H2)/c(NH3 )保持不变 D c(NH3 )/c(N2)=2
②p1________ (填“>”、“<”、“=”或“不确定”,下同)p2;反应的平衡常数:B点________ D点。
③C点H2的转化率为________ ;在A、B两点条件下,该反应从开始到平衡时生成氨气的平均速率:v(A)________ v(B)。
(3)N2H4可作火箭推进剂,NH3和NaClO在一定条件下反应可生成N2H4。
①写出NH3和NaClO反应生成N2H4的化学方程式________________________________ 。
②已知25 ℃时,N2H4的水溶液呈弱碱性:N2H4+H2O N2H5++OH-K1=1×10-a N2H5++H2O
N2H5++OH-K1=1×10-a N2H5++H2O N2H62++OH- K2=1×10-b25 ℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+),应控制溶液pH的范围为
N2H62++OH- K2=1×10-b25 ℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+),应控制溶液pH的范围为__________________________________ (用含a、b的式子表示)。
(1)合成氨中的氢气可由下列反应制取:
a.CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH1=+216.4 kJ·mol-1
CO(g)+3H2(g) ΔH1=+216.4 kJ·mol-1b.CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1则反应CH4(g)+2H2O(g)
 CO2(g)+4H2(g) ΔH=
CO2(g)+4H2(g) ΔH=(2)起始时投入氮气和氢气的物质的量分别为1 mol、3 mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。

①恒压时,反应一定达到平衡状态的标志是
A N2和H2的转化率相等 B 反应体系密度保持不变
C c(H2)/c(NH3 )保持不变 D c(NH3 )/c(N2)=2
②p1
③C点H2的转化率为
(3)N2H4可作火箭推进剂,NH3和NaClO在一定条件下反应可生成N2H4。
①写出NH3和NaClO反应生成N2H4的化学方程式
②已知25 ℃时,N2H4的水溶液呈弱碱性:N2H4+H2O
 N2H5++OH-K1=1×10-a N2H5++H2O
N2H5++OH-K1=1×10-a N2H5++H2O N2H62++OH- K2=1×10-b25 ℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+),应控制溶液pH的范围为
N2H62++OH- K2=1×10-b25 ℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+),应控制溶液pH的范围为
您最近一年使用:0次
解题方法
7 . 现有常温条件下甲、乙、丙三种溶液,甲为0.1mol·L-1的NaOH溶液,乙为0.1mol·L-1的HCl溶液,丙为0.1mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=_______ ;
(2)丙溶液中存在的电离平衡为________________ (用电离平衡方程式表示);
(3)甲、乙、丙三种溶液中由水电离出的c(OH-)的由小到大顺序为________ ;

(4)某同学用甲溶液分别滴定20.00mL乙溶液和20.00mL丙溶液,得到如图所示两条滴定曲线,请完成有关问题:
①甲溶液滴定丙溶液的曲线是________ (填“图1”或“图2”);
②a=_________ mL
③pH试纸测定溶液pH的操作方法为_______________________________ 。
(1)甲溶液的pH=
(2)丙溶液中存在的电离平衡为
(3)甲、乙、丙三种溶液中由水电离出的c(OH-)的由小到大顺序为

(4)某同学用甲溶液分别滴定20.00mL乙溶液和20.00mL丙溶液,得到如图所示两条滴定曲线,请完成有关问题:
①甲溶液滴定丙溶液的曲线是
②a=
③pH试纸测定溶液pH的操作方法为
您最近一年使用:0次
8 . 煤气中主要的含硫杂质有H2S以及COS(有机硫),煤气燃烧后含硫杂质会转化成SO2从而引起大气污染,因此煤气中H2S的脱出程度已成为煤气洁净度的一个重要指标。请回答下列问题:
(1)H2S在水溶液中的电离方程式为___________ 。
(2)脱除煤气中COS的方法有Br2的KOH溶液氧化法、H2还原法、水解法等。
①COS的分子结构与CO2相似,COS的结构式为___________ 。
②Br2的KOH溶液将COS氧化为硫酸盐的离子方程式为______________ 。
③已知:H2、COS、H2S、CO的燃烧热依次为285kJ/mol、299kJ/mol、586kJ/mol、283kJ/mol;H2还原COS发生的反应为H2(g)+COS(g)=H2S(g)+CO(g),该反应的ΔH=_________ kJ/mol。
④用活性α-Al2O3催化COS水解反应为COS(g)+H2O(g) CO2(g)+H2S(g) ΔH<0,相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与n(H2O)/n(COS)的关系如图2所示。
CO2(g)+H2S(g) ΔH<0,相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与n(H2O)/n(COS)的关系如图2所示。

由图1可知,催化剂活性最大时对应的温度约为______ ,COS的转化率在后期下降的原因是_______________________________________ 。由图2可知,P点时平衡常数K=______ (保留2位有效数字)。Q点转化率高于P点的原因是__________________________________ 。
(1)H2S在水溶液中的电离方程式为
(2)脱除煤气中COS的方法有Br2的KOH溶液氧化法、H2还原法、水解法等。
①COS的分子结构与CO2相似,COS的结构式为
②Br2的KOH溶液将COS氧化为硫酸盐的离子方程式为
③已知:H2、COS、H2S、CO的燃烧热依次为285kJ/mol、299kJ/mol、586kJ/mol、283kJ/mol;H2还原COS发生的反应为H2(g)+COS(g)=H2S(g)+CO(g),该反应的ΔH=
④用活性α-Al2O3催化COS水解反应为COS(g)+H2O(g)
 CO2(g)+H2S(g) ΔH<0,相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与n(H2O)/n(COS)的关系如图2所示。
CO2(g)+H2S(g) ΔH<0,相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与n(H2O)/n(COS)的关系如图2所示。
由图1可知,催化剂活性最大时对应的温度约为
您最近一年使用:0次
2017-12-26更新
|
467次组卷
|
5卷引用:甘肃省白银市二中2017-2018学年下学期高三年级第二次模拟理综化学试卷
甘肃省白银市二中2017-2018学年下学期高三年级第二次模拟理综化学试卷广东省“六校联盟”2018届高三第二次高考模拟理综化学试卷(已下线)2017-2018学年第一学期期末复习备考之精准复习模拟题高三化学(理综)(C卷)(已下线)黄金30题系列 高二化学(选修4) 大题易丢分北京师大附中2017-2018学年下学期高三年级第二次模拟理综化学试卷
名校
解题方法
9 . 草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)制取CoC2O4·2H2O工艺流程如下图所示:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②酸性条件下,ClO 不会氧化Co2+,ClO
不会氧化Co2+,ClO 转化为Cl-;
转化为Cl-;
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中加入Na2SO3的主要目的是_______ 。
(2)向浸出液中加入NaClO3的离子反应方程式:_______ 。
(3)已知:常温下NH3·H2O NH
NH +OH- Kb=1.8×10-5
+OH- Kb=1.8×10-5
H2C2O4 H++HC2O
H++HC2O Ka1=5.4×10-2
Ka1=5.4×10-2
HC2O
 H++C2O
H++C2O Ka2=5.4×10-5
Ka2=5.4×10-5
则该流程中所用(NH4)2C2O4溶液的pH_______ 7(填“>”或“<”或“=”)。
(4)加入(NH4)2C2O4溶液后析出晶体,再过滤、洗涤,洗涤时可选用的试剂有_______(填字母代号)。
(5)萃取剂对金属离子的萃取率与pH的关系如图1所示,萃取剂的作用是_______ ;其使用的适宜pH范围是_______ (填字母代号)。
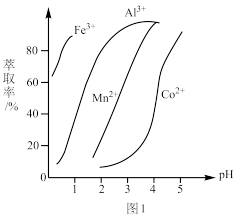
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(6)CoC2O4·2H2O热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600℃以后是在空气中加热。A、B、C均为纯净物;C点所示产物的化学式是_______。


已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②酸性条件下,ClO
 不会氧化Co2+,ClO
不会氧化Co2+,ClO 转化为Cl-;
转化为Cl-;③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(2)向浸出液中加入NaClO3的离子反应方程式:
(3)已知:常温下NH3·H2O
 NH
NH +OH- Kb=1.8×10-5
+OH- Kb=1.8×10-5H2C2O4
 H++HC2O
H++HC2O Ka1=5.4×10-2
Ka1=5.4×10-2HC2O

 H++C2O
H++C2O Ka2=5.4×10-5
Ka2=5.4×10-5则该流程中所用(NH4)2C2O4溶液的pH
(4)加入(NH4)2C2O4溶液后析出晶体,再过滤、洗涤,洗涤时可选用的试剂有_______(填字母代号)。
| A.蒸馏水 | B.自来水 | C.饱和的(NH4)2C2O4溶液 | D.稀盐酸 |

A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(6)CoC2O4·2H2O热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600℃以后是在空气中加热。A、B、C均为纯净物;C点所示产物的化学式是_______。

您最近一年使用:0次
2017-04-09更新
|
635次组卷
|
7卷引用:甘肃省师范大学附属中学2019高三上学期期中复习化学试题



