名校
1 . 回答下列问题
(1) 催化释氢。在催化剂作用下,
催化释氢。在催化剂作用下, 与水反应生成
与水反应生成 ,可能的反应机理如图所示:
,可能的反应机理如图所示:

①其他条件不变时,以 代替
代替 催化释氢,所得气体的分子式为
催化释氢,所得气体的分子式为___________ 。
②已知: 为一元弱酸,
为一元弱酸, 水溶液呈酸性的原因是
水溶液呈酸性的原因是___________ (用离子方程式表示)。
(2)将 和
和 以一定的流速分别通过甲、乙两种催化剂进行反应,相同时间内测量逸出气体中
以一定的流速分别通过甲、乙两种催化剂进行反应,相同时间内测量逸出气体中 含量,从而确定尾气脱氮率(即
含量,从而确定尾气脱氮率(即 的转化率),结果如图所示,a点
的转化率),结果如图所示,a点___________ (填“是”或“不是”)平衡状态,原因是___________ 。

(3)氨是重要的基础化工产品之一,在一定条件下,向某反应容器中投入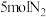 、
、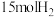 在不同温度下反应生成
在不同温度下反应生成 ,平衡体系中
,平衡体系中 的质量分数随压强变化曲线如图所示:
的质量分数随压强变化曲线如图所示:

①温度 、
、 、
、 中,最大的是
中,最大的是___________ ,M点 的转化率为
的转化率为___________ 。
②1939年捷姆金和佩热夫推出氨合成反应在接近平衡时净速率方程式为 ,
, 、
、 分别为正反应和逆反应的速率常数;
分别为正反应和逆反应的速率常数;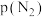 、
、 、
、 代表各组分的分压(分压=总压×物质的量分数);a是常数,工业上以铁为催化剂时,
代表各组分的分压(分压=总压×物质的量分数);a是常数,工业上以铁为催化剂时,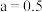 ,由M点数据计算
,由M点数据计算
___________ 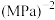 (保留两位有效数字)。
(保留两位有效数字)。
(1)
 催化释氢。在催化剂作用下,
催化释氢。在催化剂作用下, 与水反应生成
与水反应生成 ,可能的反应机理如图所示:
,可能的反应机理如图所示:
①其他条件不变时,以
 代替
代替 催化释氢,所得气体的分子式为
催化释氢,所得气体的分子式为②已知:
 为一元弱酸,
为一元弱酸, 水溶液呈酸性的原因是
水溶液呈酸性的原因是(2)将
 和
和 以一定的流速分别通过甲、乙两种催化剂进行反应,相同时间内测量逸出气体中
以一定的流速分别通过甲、乙两种催化剂进行反应,相同时间内测量逸出气体中 含量,从而确定尾气脱氮率(即
含量,从而确定尾气脱氮率(即 的转化率),结果如图所示,a点
的转化率),结果如图所示,a点
(3)氨是重要的基础化工产品之一,在一定条件下,向某反应容器中投入
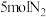 、
、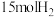 在不同温度下反应生成
在不同温度下反应生成 ,平衡体系中
,平衡体系中 的质量分数随压强变化曲线如图所示:
的质量分数随压强变化曲线如图所示:
①温度
 、
、 、
、 中,最大的是
中,最大的是 的转化率为
的转化率为②1939年捷姆金和佩热夫推出氨合成反应在接近平衡时净速率方程式为
 ,
, 、
、 分别为正反应和逆反应的速率常数;
分别为正反应和逆反应的速率常数;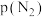 、
、 、
、 代表各组分的分压(分压=总压×物质的量分数);a是常数,工业上以铁为催化剂时,
代表各组分的分压(分压=总压×物质的量分数);a是常数,工业上以铁为催化剂时,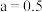 ,由M点数据计算
,由M点数据计算
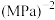 (保留两位有效数字)。
(保留两位有效数字)。
您最近一年使用:0次
名校
2 . 滴定法是化学分析的常用方法,是一种简便、快速和应用广泛的定量分析方法,在常量分析中有较高的准确度。酸碱滴定和氧化还原滴定是常见的两种滴定方法:
Ⅰ.氧化还原滴定:双氧水常用于医用伤口消毒、环境消毒和食品消毒。化学兴趣小组欲准确测定某市售双氧水中H2O2的含量:取双氧水25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释。用一定浓度的高锰酸钾标准液滴定,其反应的离子方程式为2MnO +5H2O2+6H+=2Mn2++5O2↑+8H2O。
+5H2O2+6H+=2Mn2++5O2↑+8H2O。
(1)滴定时,将高锰酸钾标准溶液注入___________ (填“酸”或“碱”)式滴定管中。
(2)滴定到达终点的现象是___________ 。
Ⅱ.酸碱中和滴定:常温下,用0.1000 mol·L-1NaOH溶液分别滴定20.00 mL等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如图所示:

(3)滴定盐酸的曲线是图___________ (填“1”或“2”)。
(4)达到B、D状态时,反应消耗的NaOH溶液的体积a___________ (填“>”“<”或“=”)b。
(5)D状态时,溶液中的溶质是___________ 。
Ⅰ.氧化还原滴定:双氧水常用于医用伤口消毒、环境消毒和食品消毒。化学兴趣小组欲准确测定某市售双氧水中H2O2的含量:取双氧水25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释。用一定浓度的高锰酸钾标准液滴定,其反应的离子方程式为2MnO
 +5H2O2+6H+=2Mn2++5O2↑+8H2O。
+5H2O2+6H+=2Mn2++5O2↑+8H2O。(1)滴定时,将高锰酸钾标准溶液注入
(2)滴定到达终点的现象是
Ⅱ.酸碱中和滴定:常温下,用0.1000 mol·L-1NaOH溶液分别滴定20.00 mL等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如图所示:

(3)滴定盐酸的曲线是图
(4)达到B、D状态时,反应消耗的NaOH溶液的体积a
(5)D状态时,溶液中的溶质是
您最近一年使用:0次
2022-12-06更新
|
93次组卷
|
2卷引用:山西省太原市英才学校2021-2022学年高二上学期第二次月考化学试题
名校
3 . 回答下列问题:
(1)已知碳酸:H2CO3,Ka1=4.5×10-7,Ka2=4.7×10-11,草酸:H2C2O4,Ka1=5.6×10-2,Ka2=1.5×10-4。
①0.1mol·L-1Na2CO3溶液的pH_______ (填“大于”“小于”或“等于”)0.1mol·L-1Na2C2O4溶液的pH。
②等浓度草酸溶液和碳酸溶液中,氢离子浓度较大的是_______ 。
③若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种粒子浓度大小的顺序正确的是_______ (填字母)。
a.c(H+)>c( )>c(
)>c( )>c(
)>c( )
)
b.c( )>c(
)>c( )>c(
)>c(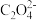 )>c(
)>c( )
)
c.c(H+)>c( )>c(
)>c(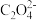 )>c(
)>c( )
)
d.c(H2CO3)>c( )>c(
)>c( )>c(
)>c( )
)
(2)SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少SO2的排放,回答下列方法中的问题。
方法1(双碱法):用NaOH溶液吸收SO2,并用CaO使NaOH再生
NaOH溶液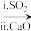 Na2SO3溶液
Na2SO3溶液
①写出过程ⅰ的离子方程式:_______ ;
②CaO在水中存在如下转化:CaO(s)+H2O(l)=Ca(OH)2(s) Ca2+(aq)+2OH-(aq)
Ca2+(aq)+2OH-(aq)
从平衡移动的角度,简述过程ⅱ中NaOH再生的原理:_______ 。
方法2:用氨水除去SO2
③已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.4×10-2,Ka2=6.0×10-8。若氨水的浓度为2.0mol·L-1,溶液中的c(OH-)=_______ mol·L-1。将SO2通入该氨水中,当c(OH-)降至1.0×10-7mol·L-1时,溶液中的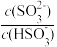 =
=_______ 。
(1)已知碳酸:H2CO3,Ka1=4.5×10-7,Ka2=4.7×10-11,草酸:H2C2O4,Ka1=5.6×10-2,Ka2=1.5×10-4。
①0.1mol·L-1Na2CO3溶液的pH
②等浓度草酸溶液和碳酸溶液中,氢离子浓度较大的是
③若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种粒子浓度大小的顺序正确的是
a.c(H+)>c(
 )>c(
)>c( )>c(
)>c( )
)b.c(
 )>c(
)>c( )>c(
)>c(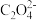 )>c(
)>c( )
)c.c(H+)>c(
 )>c(
)>c(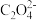 )>c(
)>c( )
)d.c(H2CO3)>c(
 )>c(
)>c( )>c(
)>c( )
)(2)SO2会对环境和人体健康带来极大的危害,工业上采取多种方法减少SO2的排放,回答下列方法中的问题。
方法1(双碱法):用NaOH溶液吸收SO2,并用CaO使NaOH再生
NaOH溶液
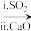 Na2SO3溶液
Na2SO3溶液①写出过程ⅰ的离子方程式:
②CaO在水中存在如下转化:CaO(s)+H2O(l)=Ca(OH)2(s)
 Ca2+(aq)+2OH-(aq)
Ca2+(aq)+2OH-(aq)从平衡移动的角度,简述过程ⅱ中NaOH再生的原理:
方法2:用氨水除去SO2
③已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.4×10-2,Ka2=6.0×10-8。若氨水的浓度为2.0mol·L-1,溶液中的c(OH-)=
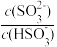 =
=
您最近一年使用:0次
2022-10-01更新
|
244次组卷
|
5卷引用:山西省忻州市第一中学2020-2021学年高二下学期4月月考化学试题
解题方法
4 . “神光二号”是我国研制的巨型激光器,其中使用了一种大型非线性光学晶体磷酸二氢钾(KH2PO4)。利用氟磷灰石[化学式为Ca5F(PO4)3]制备磷酸二氢钾晶体的工艺流程如图所示(不涉及本题的部分流程已省略)。
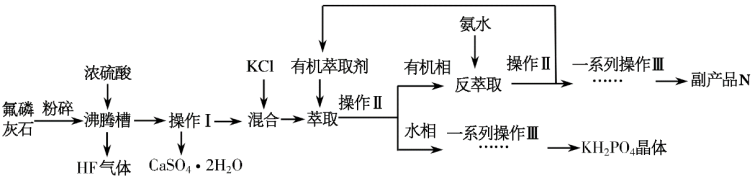
已知:萃取的主要反应原理为KCl+H3PO4 KH2PO4+HCl,其中反应产生的HCl易溶于有机萃取剂。
KH2PO4+HCl,其中反应产生的HCl易溶于有机萃取剂。
请回答下列问题:
(1)写出氟磷灰石在沸腾槽中发生的主要反应的化学方程式___________ ;已知盐酸的酸性比磷酸强,但萃取过程中可以通过反应KCl+H3PO4 KH2PO4+HCl在水相里得到KH2PO4,其原因是
KH2PO4+HCl在水相里得到KH2PO4,其原因是___________ 。
(2)沸腾槽不能使用二氧化硅陶瓷材质,其主要原因是___________ (用化学方程式表示)。
(3)通过一系列操作可得副产品N,写出N的化学式___________ ;得到KH2PO4晶体的一系列操作Ⅲ,其主要包括___________ 、过滤、洗涤、干燥等。
(4)用1000kg质量分数为50.4%的氟磷灰石样品来制取磷酸二氢钾晶体,实际得到316.2kg的KH2PO4,则其产率为___________ 。
(5)已知25℃时H3PO4的Ka1=7.1×10-3、Ka2=6.2×10-8、Ka3=4.5×10-13,试分析常温下KH2PO4溶液呈酸性的原因___________ 。
(6)工业上还可以用氟磷灰石与焦炭、石英砂混合,在电炉中加热到1500℃制得白磷,同时逸出SiF4和CO,该反应的化学方程式为___________ 。

已知:萃取的主要反应原理为KCl+H3PO4
 KH2PO4+HCl,其中反应产生的HCl易溶于有机萃取剂。
KH2PO4+HCl,其中反应产生的HCl易溶于有机萃取剂。请回答下列问题:
(1)写出氟磷灰石在沸腾槽中发生的主要反应的化学方程式
 KH2PO4+HCl在水相里得到KH2PO4,其原因是
KH2PO4+HCl在水相里得到KH2PO4,其原因是(2)沸腾槽不能使用二氧化硅陶瓷材质,其主要原因是
(3)通过一系列操作可得副产品N,写出N的化学式
(4)用1000kg质量分数为50.4%的氟磷灰石样品来制取磷酸二氢钾晶体,实际得到316.2kg的KH2PO4,则其产率为
(5)已知25℃时H3PO4的Ka1=7.1×10-3、Ka2=6.2×10-8、Ka3=4.5×10-13,试分析常温下KH2PO4溶液呈酸性的原因
(6)工业上还可以用氟磷灰石与焦炭、石英砂混合,在电炉中加热到1500℃制得白磷,同时逸出SiF4和CO,该反应的化学方程式为

您最近一年使用:0次
2021-06-03更新
|
252次组卷
|
2卷引用:山西省运城市新康国际实验学校2020-2021学年高二下学期4月份测试理综化学试题
名校
5 . 电解质水溶液中存在电离平衡、水解平衡,已知部分弱电解质的电离常数如表:
回答下列问题:
(1)0.1mol·L‒1的NaClO溶液和0.1mol·L‒1的Na2CO3溶液中,c(ClO‒)___ (填“>”“<”或“=”)c(CO )。
)。
(2)HCOO‒、ClO‒、CO 、HCO
、HCO 中,结合质子能力最强的是
中,结合质子能力最强的是___ ,将少量CO2通入NaClO溶液,反应的离子方程式是___ 。
(3)将体积相同,pH=5的HCOOH和pH=5的H2SO4加水稀释到pH=6,需水的体积:HCOOH___ (填“大于”“小于”或者“等于”,下同)H2SO4;分别与足量的锌粉反应,反应过程中的平均反应速率:HCOOH___ H2SO4。
(4)25℃时,0.01mol·L‒1的HCOOH和0.01mol·L‒1的氨水等体积混合后溶液呈___ (填“酸”或“碱”)性;若amol·L‒1的HCOOH与0.01mol·L‒1的NaOH溶液等体积混合,所得溶液中c(HCOO‒)=c(Na+),则该温度下HCOOH的电离常数Ka=___ (用含a的代数式表示)。
(5)室温下,用0.100mol·L‒1的盐酸滴定20.00mL0.100mol·L‒1氨水,滴定曲线如图所示。
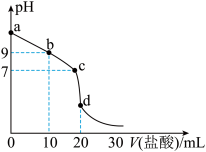
①d点所示的溶液中离子浓度由大到小的顺序为___ 。
②b点所示的溶液中c(NH )-c(NH3·H2O)=
)-c(NH3·H2O)=___ mol·L‒1(写出精确结果,不做近似计算)。
| 弱酸 | HCOOH | HClO | H2CO3 | NH3•H2O |
| 电离常数(25℃) | Ka=1.77×10‒4 | Ka=4.3×10‒10 | Ka1=5.0×10‒7 Ka2=5.6×10‒11 | Kb=1.75×10‒5 |
(1)0.1mol·L‒1的NaClO溶液和0.1mol·L‒1的Na2CO3溶液中,c(ClO‒)
 )。
)。(2)HCOO‒、ClO‒、CO
 、HCO
、HCO 中,结合质子能力最强的是
中,结合质子能力最强的是(3)将体积相同,pH=5的HCOOH和pH=5的H2SO4加水稀释到pH=6,需水的体积:HCOOH
(4)25℃时,0.01mol·L‒1的HCOOH和0.01mol·L‒1的氨水等体积混合后溶液呈
(5)室温下,用0.100mol·L‒1的盐酸滴定20.00mL0.100mol·L‒1氨水,滴定曲线如图所示。

①d点所示的溶液中离子浓度由大到小的顺序为
②b点所示的溶液中c(NH
 )-c(NH3·H2O)=
)-c(NH3·H2O)=
您最近一年使用:0次
2021-01-31更新
|
211次组卷
|
5卷引用:山西省三重教育2021-2022学年高二上学期名校联考化学试题
解题方法
6 . 氮元素的单质及其化合物在工农业生产、生活中有着重要作用。
(1)已知:反应i:N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ/mol
2NH3(g)△H=-92.4kJ/mol
反应ii:2H2(g)+O2(g) =2H2O(g)△H=-483.6kJ/mol
则氨气完全燃烧生成氮气和水蒸气的热化学方程式____________ 。
(2)图1表示反应i在500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中M点数据计算N2的平衡体积分数____________ ;该反应的化学平衡常数K的表达式____________ 。

(3)图2是合成氨反应平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是____________ (填“温度”或“压强”);L1____________ L2(填“>”、“<”)。
(4)电化学气敏传感器可用于检测环境中NH3的含量,其工作原理如图所示:

①反应消耗NH3和O2的物质的量之比为____________ 。
②a极的电极反应式为____________ 。
(5)在25℃下,将amol•L-1的氨水与0.01mol•L-1的盐酸等体积混合,反应完后溶液中c( )=c(Cl-),用含a的代数式表示NH3•H2O的电离平衡常数Kb=
)=c(Cl-),用含a的代数式表示NH3•H2O的电离平衡常数Kb=____________ 。
(1)已知:反应i:N2(g)+3H2(g)
 2NH3(g)△H=-92.4kJ/mol
2NH3(g)△H=-92.4kJ/mol反应ii:2H2(g)+O2(g) =2H2O(g)△H=-483.6kJ/mol
则氨气完全燃烧生成氮气和水蒸气的热化学方程式
(2)图1表示反应i在500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中M点数据计算N2的平衡体积分数

(3)图2是合成氨反应平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是
(4)电化学气敏传感器可用于检测环境中NH3的含量,其工作原理如图所示:

①反应消耗NH3和O2的物质的量之比为
②a极的电极反应式为
(5)在25℃下,将amol•L-1的氨水与0.01mol•L-1的盐酸等体积混合,反应完后溶液中c(
 )=c(Cl-),用含a的代数式表示NH3•H2O的电离平衡常数Kb=
)=c(Cl-),用含a的代数式表示NH3•H2O的电离平衡常数Kb=
您最近一年使用:0次
解题方法
7 . 磷酸是重要的化学试剂和工业原料。请回答下列问题:
(1)已知:25℃时,磷酸和氢氟酸的电离常数如下表所示。
向NaF溶液中滴加少量H3PO4溶液,反应的离子方程式为____________
(2)已知:
Ⅰ.CaO(s)+H2SO4(l) CaSO4(s)+H2O(l) ΔH=-271kJ·mol−1
CaSO4(s)+H2O(l) ΔH=-271kJ·mol−1
Ⅱ.5CaO(s)+3H3PO4(l)+HF(g) Ca5(PO4)3F(s)+5H2O(l) ΔH=-937kJ·mol−1
Ca5(PO4)3F(s)+5H2O(l) ΔH=-937kJ·mol−1
则:①工业上用Ca5(PO4)3F和硫酸反应制备磷酸的热化学方程式为____________ 。
②一定条件下,在密闭容器中只发生反应Ⅱ,达到平衡后缩小容器容积,HF的平衡转化率________ (填“增大”“减小”或“不变”,下同);HF的平衡浓度________ 。
(3)工业上用磷尾矿制备Ca5(PO4)3F时生成的副产物CO可用于制备H2,原理为CO(g)+H2O(g) CO2(g)+H2(g) ΔH。
CO2(g)+H2(g) ΔH。
①一定温度下,向10L密闭容器中充入0.5mol CO和1mol H2O(g),2min达到平衡时,测得0~2min内用CO2表示的反应速率v(CO2)=0.02mol·L−1·min−1。则CO的平衡转化率α=________ ;该反应的平衡常数K=________ 。
②在压强不变的密闭容器中发生上述反应,设起始的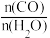 =y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的ΔH
=y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的ΔH___ 0(填“>”“<”或“=”,下同)。a_____ 1,理由为_____________

(1)已知:25℃时,磷酸和氢氟酸的电离常数如下表所示。
| 物质 | H3PO4 | HF |
| 电离常数 | Ka1=7.1×10−3; Ka2=6.3×10−8; Ka3=4.2×10−13 | Ka=6.6×10−4 |
向NaF溶液中滴加少量H3PO4溶液,反应的离子方程式为
(2)已知:
Ⅰ.CaO(s)+H2SO4(l)
 CaSO4(s)+H2O(l) ΔH=-271kJ·mol−1
CaSO4(s)+H2O(l) ΔH=-271kJ·mol−1Ⅱ.5CaO(s)+3H3PO4(l)+HF(g)
 Ca5(PO4)3F(s)+5H2O(l) ΔH=-937kJ·mol−1
Ca5(PO4)3F(s)+5H2O(l) ΔH=-937kJ·mol−1则:①工业上用Ca5(PO4)3F和硫酸反应制备磷酸的热化学方程式为
②一定条件下,在密闭容器中只发生反应Ⅱ,达到平衡后缩小容器容积,HF的平衡转化率
(3)工业上用磷尾矿制备Ca5(PO4)3F时生成的副产物CO可用于制备H2,原理为CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH。
CO2(g)+H2(g) ΔH。①一定温度下,向10L密闭容器中充入0.5mol CO和1mol H2O(g),2min达到平衡时,测得0~2min内用CO2表示的反应速率v(CO2)=0.02mol·L−1·min−1。则CO的平衡转化率α=
②在压强不变的密闭容器中发生上述反应,设起始的
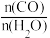 =y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的ΔH
=y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的ΔH
您最近一年使用:0次
解题方法
8 . 磷酸是重要的化学试剂和工业原料。请回答下列问题:
(1)已知:25°C时,磷酸和碳酸的电离常数如下表所示。
向Na2CO3溶液中滴加少量H3PO4溶液,反应的离子方程式为__ 。
(2)已知:
I.CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) ∆H= -271kJ·mol-1
II.5CaO(s)+3H3PO4(l)+HF(g)=Ca3(PO4)3F(s)+5H2O(l) ∆H=-937 kJ·mol-1
回答下列问题:
①工业上用Ca3(PO4)3F和硫酸反应制备磷酸的热化学方程式为__ 。
②一定条件下,在密闭容器中只发生反应II,达到平衡后缩小容器容积,HF的平衡转化率__ (填“增大”“减小”或“不变”,下同);HF的平衡浓度__ 。
(3)工业上用磷尾矿制备Ca3(PO4)3F时生成的副产物CO可用于制备H2,原理为CO(g)+H2O(g)=CO2(g)+H2(g) ∆H。
①一定温度下,向10L密闭容器中充入0.5molCO和lmolH2O(g),2min达到平衡时,测得0~2min内用CO2表示的反应速率v(CO2)=0.02mol·L-1·min-1。则CO的平衡转化率a=__ ,该反应的平衡常数K=__ 。
②在压强不变的密闭容器中发生上述反应,设起始的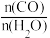 =y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的∆H
=y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的∆H__ 0(填“>”“<”或“=”,下同)。a_ 1,理由为__ 。

(1)已知:25°C时,磷酸和碳酸的电离常数如下表所示。
物质 | H3PO4 | H2CO3 |
电离常数 | Ka1=7.1×10-3 Ka2= 6.3×10-8 Ka3= 4.2×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
(2)已知:
I.CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) ∆H= -271kJ·mol-1
II.5CaO(s)+3H3PO4(l)+HF(g)=Ca3(PO4)3F(s)+5H2O(l) ∆H=-937 kJ·mol-1
回答下列问题:
①工业上用Ca3(PO4)3F和硫酸反应制备磷酸的热化学方程式为
②一定条件下,在密闭容器中只发生反应II,达到平衡后缩小容器容积,HF的平衡转化率
(3)工业上用磷尾矿制备Ca3(PO4)3F时生成的副产物CO可用于制备H2,原理为CO(g)+H2O(g)=CO2(g)+H2(g) ∆H。
①一定温度下,向10L密闭容器中充入0.5molCO和lmolH2O(g),2min达到平衡时,测得0~2min内用CO2表示的反应速率v(CO2)=0.02mol·L-1·min-1。则CO的平衡转化率a=
②在压强不变的密闭容器中发生上述反应,设起始的
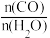 =y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的∆H
=y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的∆H
您最近一年使用:0次
9 . 能源问题是人类社会面临的重大问题,合理的开发利用至关重要。
(1)丁烯是石油化工中的重要产物,正丁烷脱氢可制备1-丁烯:C4H10(g) =C4Hg(g) +H2(g) △H。 下表为该反应中所涉及物质的键能数据:
则△H=_______
(2)甲醇是未来重要的绿色能源之一,常见的合成反应为CO(g) +2H2(g) CH3OH(g)∆H<0;为了探究反应物的浓度对反应速率的影响,进行了相关实验,测得的实验数据如下表所示:
CH3OH(g)∆H<0;为了探究反应物的浓度对反应速率的影响,进行了相关实验,测得的实验数据如下表所示:
该反应速率的通式为v正=k正cm(CO).cn(H2)(k是与温度有关的速率常数)。由表中数据可确定反应速率通式中m和n分别_____ 、_____ ( 取正整数)。
(3)合成甲醇的原料气既可由煤气化提供,也可由天然气与水蒸气通过下列反应制备:CH4(g) + H2O(g) CO(g) +3H2(g)∆H>0。向100 L刚性密闭容器中充人1 mol CH4和3 mol水蒸气进行反应,不同温度和压强下平衡体系中CH4的平衡转化率情况如图1所示:
CO(g) +3H2(g)∆H>0。向100 L刚性密闭容器中充人1 mol CH4和3 mol水蒸气进行反应,不同温度和压强下平衡体系中CH4的平衡转化率情况如图1所示:


图1 图2
①p1____ p2(填“<”“>”或“=")。
②已知压强为P1,温度为100°C时,反应达到平衡所需的时间为5min,则0~5min内用H2表示的平均反应速率为______ ;该温度下的平衡常数K=_______ mol2·L-2。
(4)近年来,有人研究用温室气体二氧化碳通过电催化生成多种燃料,其工作原理如图2所示。
①写出Cu电极上产生乙烯的电极反应式:_____________ ;如果Cu电极上生成0.17molCO和0.33molHCOOH,则Pt电极上产生O2的物质的量为__________ mol。
②HCOOH为一元弱酸,常温下将0.1mol·L-1HCOOH溶液与0.1mol·L-1NaOH溶液按体积比a:b混合(忽略溶液体积的变化),混合后溶液恰好显中性,则HCOOH的电离常数为______ (用含a、b的代数式表示)。
(1)丁烯是石油化工中的重要产物,正丁烷脱氢可制备1-丁烯:C4H10(g) =C4Hg(g) +H2(g) △H。 下表为该反应中所涉及物质的键能数据:
| 化学键 | C—C | C—H | H—H | C=C |
| 键能/(kJ·mol-1) | 348 | 414 | 436 | 615 |
(2)甲醇是未来重要的绿色能源之一,常见的合成反应为CO(g) +2H2(g)
 CH3OH(g)∆H<0;为了探究反应物的浓度对反应速率的影响,进行了相关实验,测得的实验数据如下表所示:
CH3OH(g)∆H<0;为了探究反应物的浓度对反应速率的影响,进行了相关实验,测得的实验数据如下表所示:| 组别 | 起始浓度/(mol·L-1) | 起始速率/(mol·L-1·min-1) | |
| CO | H2 | ||
| 1 | 0.24 | 0.48 | 0.361 |
| 2 | 0.24 | 0.96 | 0.720 |
| 3 | 0.48 | 0.48 | 0.719 |
(3)合成甲醇的原料气既可由煤气化提供,也可由天然气与水蒸气通过下列反应制备:CH4(g) + H2O(g)
 CO(g) +3H2(g)∆H>0。向100 L刚性密闭容器中充人1 mol CH4和3 mol水蒸气进行反应,不同温度和压强下平衡体系中CH4的平衡转化率情况如图1所示:
CO(g) +3H2(g)∆H>0。向100 L刚性密闭容器中充人1 mol CH4和3 mol水蒸气进行反应,不同温度和压强下平衡体系中CH4的平衡转化率情况如图1所示:

图1 图2
①p1
②已知压强为P1,温度为100°C时,反应达到平衡所需的时间为5min,则0~5min内用H2表示的平均反应速率为
(4)近年来,有人研究用温室气体二氧化碳通过电催化生成多种燃料,其工作原理如图2所示。
①写出Cu电极上产生乙烯的电极反应式:
②HCOOH为一元弱酸,常温下将0.1mol·L-1HCOOH溶液与0.1mol·L-1NaOH溶液按体积比a:b混合(忽略溶液体积的变化),混合后溶液恰好显中性,则HCOOH的电离常数为
您最近一年使用:0次
2020-02-24更新
|
486次组卷
|
2卷引用:山西省大同市第一中学2020届高三3月月考理综化学试题
名校
10 . (山西省晋中市2019届高三1月高考适应性考试理科综合)碲被誉为“现代工业、国防与尖端技术的维生素”,工业上常用铜阳极泥(主要成分是Cu2Te,含Ag、Au等杂质)为原料提取碲并回收金属其工艺流程如下:
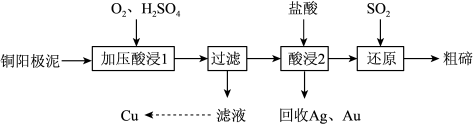
已知:TeO2是两性氧化物,微溶于水,易溶于较浓的强酸和强碱。回答下列问题:
(1)“加压酸浸1”过程中将碲元素转化成TeO2,应控制溶液的pH为4.5~5.0,酸度不能过高,原因是_________ ,其中“加压”的目的是_____ 。写出“加压酸浸1”过程中Cu2Te发生反应的化学方程式__________ 。
(2)“酸浸2”时温度过高会使碲的浸出率降低,原因为_______ 。要从Ag和Au中分离出Au,可以向回收的Ag和Au中加入的试剂是_________ 。
(3)写出“还原”反应中发生的离子方程式__________ 。
(4)工业上另一种提取碲的方法是将铜阳极泥在空气中焙烧,使碲转化成TeO2,再加NaOH碱浸,以石墨为电极电解溶液获得Te。电解过程中阴极的电极反应式为____ 。
(5)25℃时,向1mol/L的Na2TeO3溶液中滴加盐酸,当溶液pH值约为6时,此时溶液中c(TeO32-):c(HTeO3-)=____ (已知:H2TeO3的Ka1=1.0×10-3,Ka2=2.0×10-8)

已知:TeO2是两性氧化物,微溶于水,易溶于较浓的强酸和强碱。回答下列问题:
(1)“加压酸浸1”过程中将碲元素转化成TeO2,应控制溶液的pH为4.5~5.0,酸度不能过高,原因是
(2)“酸浸2”时温度过高会使碲的浸出率降低,原因为
(3)写出“还原”反应中发生的离子方程式
(4)工业上另一种提取碲的方法是将铜阳极泥在空气中焙烧,使碲转化成TeO2,再加NaOH碱浸,以石墨为电极电解溶液获得Te。电解过程中阴极的电极反应式为
(5)25℃时,向1mol/L的Na2TeO3溶液中滴加盐酸,当溶液pH值约为6时,此时溶液中c(TeO32-):c(HTeO3-)=
您最近一年使用:0次



