1 . 水溶液广泛存在于生命体及其赖以生存的环境中,与生命活动、日常生活、工农业生产和环境保护等息息相关。请回答:
(1)人体血浆中的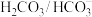 对稳定血液酸碱度有重要作用,正常情况下,人体血液的pH约为7.4,血液呈弱碱性的原因是
对稳定血液酸碱度有重要作用,正常情况下,人体血液的pH约为7.4,血液呈弱碱性的原因是_______ (用离子方程式表示),肾脏通过分泌 调节血液pH,分泌
调节血液pH,分泌 可使血液pH
可使血液pH_______ (填“升高”或“降低”)。人体血液的pH=7.4[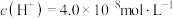 ]时,
]时, 和
和 浓度比值约为20∶1,该条件下
浓度比值约为20∶1,该条件下 的
的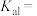
_______ 。
(2) 可用作白色颜料和阻燃剂等,在实验室可利用
可用作白色颜料和阻燃剂等,在实验室可利用 的水解反应制取。为得到较多的
的水解反应制取。为得到较多的 ,操作时先将
,操作时先将 缓缓加入大量水中,反应中产生难溶于水的中间产物SbOCl,该反应的化学方程式为
缓缓加入大量水中,反应中产生难溶于水的中间产物SbOCl,该反应的化学方程式为_______ ;反应后期还要加入少量氨水,目的是_______ 。
(3)工业上处理废水时,可采用FeS除去废水中的 ,原因是
,原因是_______ (用离子方程式表示),已知: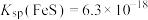 、
、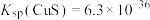 ,则上述反应的化学平衡常数K=
,则上述反应的化学平衡常数K=_______ 。
(1)人体血浆中的
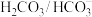 对稳定血液酸碱度有重要作用,正常情况下,人体血液的pH约为7.4,血液呈弱碱性的原因是
对稳定血液酸碱度有重要作用,正常情况下,人体血液的pH约为7.4,血液呈弱碱性的原因是 调节血液pH,分泌
调节血液pH,分泌 可使血液pH
可使血液pH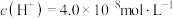 ]时,
]时, 和
和 浓度比值约为20∶1,该条件下
浓度比值约为20∶1,该条件下 的
的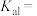
(2)
 可用作白色颜料和阻燃剂等,在实验室可利用
可用作白色颜料和阻燃剂等,在实验室可利用 的水解反应制取。为得到较多的
的水解反应制取。为得到较多的 ,操作时先将
,操作时先将 缓缓加入大量水中,反应中产生难溶于水的中间产物SbOCl,该反应的化学方程式为
缓缓加入大量水中,反应中产生难溶于水的中间产物SbOCl,该反应的化学方程式为(3)工业上处理废水时,可采用FeS除去废水中的
 ,原因是
,原因是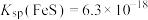 、
、 ,则上述反应的化学平衡常数K=
,则上述反应的化学平衡常数K=
您最近一年使用:0次
2 . 人体内尿酸(HUr)含量偏高,关节滑液中产生尿酸钠晶体(NaUr)会引发痛风和关节炎,有关平衡有:①HUr(尿酸,aq) (尿酸根,aq)
(尿酸根,aq) 、
、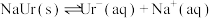 ②。某课题组配制“模拟关节滑液”进行研究,回答下列问题:
②。某课题组配制“模拟关节滑液”进行研究,回答下列问题:
已知:①37℃时, ,
, ,
,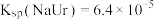 。
。
②37℃时,模拟关节滑液pH=7.4, 。
。
(1)37℃时, HUr溶液的pH约为
HUr溶液的pH约为_______ (已知 )。
)。
(2)下列事实可以证明尿酸是弱电解质的是_______(填字母)。
(3)37℃时,向HUr溶液中加入NaOH溶液配制“模拟关节滑液”,溶液中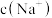
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(4)37℃时,向模拟关节滑液中加入NaCl(s)至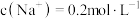 时,通过计算判断是否有NaUr晶体析出,请写出判断过程:
时,通过计算判断是否有NaUr晶体析出,请写出判断过程:_______ 。
(5)关节炎发作大都在脚趾和手指的关节处,反应②是_______ (填“放热”或“吸热”)反应。
(6)对于尿酸偏高的人群,下列建议正确的是_______(填字母)。
 (尿酸根,aq)
(尿酸根,aq) 、
、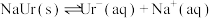 ②。某课题组配制“模拟关节滑液”进行研究,回答下列问题:
②。某课题组配制“模拟关节滑液”进行研究,回答下列问题:已知:①37℃时,
 ,
, ,
,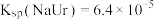 。
。②37℃时,模拟关节滑液pH=7.4,
 。
。(1)37℃时,
 HUr溶液的pH约为
HUr溶液的pH约为 )。
)。(2)下列事实可以证明尿酸是弱电解质的是_______(填字母)。
| A.NaUr溶液显碱性 |
| B.HUr溶液可使石蕊溶液变红 |
| C.常温下,等浓度的尿酸溶液导电性比盐酸弱 |
D.10mL 溶液与10mL 溶液与10mL NaOH溶液完全反应 NaOH溶液完全反应 |
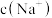
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(4)37℃时,向模拟关节滑液中加入NaCl(s)至
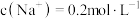 时,通过计算判断是否有NaUr晶体析出,请写出判断过程:
时,通过计算判断是否有NaUr晶体析出,请写出判断过程:(5)关节炎发作大都在脚趾和手指的关节处,反应②是
(6)对于尿酸偏高的人群,下列建议正确的是_______(填字母)。
| A.多喝水,食用新鲜蔬果 |
| B.饮食宜多盐、多脂 |
| C.适度运动,注意关节保暖 |
| D.减少摄入易代谢出尿酸的食物 |
您最近一年使用:0次
2022-12-16更新
|
109次组卷
|
2卷引用:山西省运城市教育发展联盟20222023学年高二上学期12月联考化学试题
3 . 根据电离平衡常数的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如表所示。
根据表中数据,回答下列问题:
(1)等浓度的F-、 、CH3COO-、HS-结合H+的能力最强的为
、CH3COO-、HS-结合H+的能力最强的为_______ 。
(2)溶液中不可能大量共存的离子组是______ (填序号)。
a. HS-、 b.HF、CH3COO- c. HS-、
b.HF、CH3COO- c. HS-、 d.
d. 、
、
(3)Na2CO3溶液通入过量H2S,反应的离子方程式是______ 。HS-
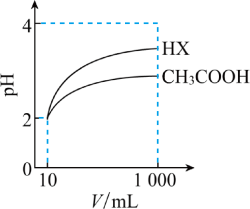
(4)已知pH=-lgc(H+),体积为10mL、pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数_______ (填“ ”“
”“ ”或“
”或“ ”)醋酸的电离平衡常数。任意写一种方法证明醋酸是弱电解质:
”)醋酸的电离平衡常数。任意写一种方法证明醋酸是弱电解质:_______ 。
化学式 | 电离平衡常数 |
HF | 7.2×10-4 |
CH3COOH | 1.8×10-5 |
H2SO3 | K1=1.54×10-2K2=1.02×10-7 |
H2CO3 | K1=4.4×10-7K2=4.7×10-11 |
H2S | K1=1.3×10-7K2=7.1×10-15 |
(1)等浓度的F-、
 、CH3COO-、HS-结合H+的能力最强的为
、CH3COO-、HS-结合H+的能力最强的为(2)溶液中不可能大量共存的离子组是
a. HS-、
 b.HF、CH3COO- c. HS-、
b.HF、CH3COO- c. HS-、 d.
d. 、
、
(3)Na2CO3溶液通入过量H2S,反应的离子方程式是

(4)已知pH=-lgc(H+),体积为10mL、pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数
 ”“
”“ ”或“
”或“ ”)醋酸的电离平衡常数。任意写一种方法证明醋酸是弱电解质:
”)醋酸的电离平衡常数。任意写一种方法证明醋酸是弱电解质:
您最近一年使用:0次
2020-09-20更新
|
812次组卷
|
4卷引用:山西省沁源县第一中学2020-2021学年高二下学期开学考试化学试题
名校
解题方法
4 . 已知:25 ℃时,Ka1(H2SO3)=1.5×10-2,Ka2(H2SO3)=6×10‑8,Ka1 (H2A)=1.3×10-7, Ka2 (H2A)=7.1×10-10,Ksp(CaSO3)=3.1 × 10-7。
(1)H2SO3溶液和NaHA溶液反应的主要离子方程式为_______ (不考虑H2SO3与HA-发生氧化还原反应)。
(2)0.1mol/L Na2SO3溶液中离子浓度由大到小的顺序为____ 。
(3)25℃时.将10mL0.20mol·L-1的HCOOH溶液和10mL0.20mol·L-1的CH3COOH溶液分别与10mL0.20mol·L-1的NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示:

①HCO 的电离平衡常数表达式K=
的电离平衡常数表达式K=____ 。
②反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是______ ,反应结束后所得两溶液中,c(HCOO- )_________ c(CH3COO-)(填“>”“<”或“=”)。
(4)25℃ 时,某溶液中含有0.001 mol/LCa2+、0.010 mol/L H2SO3,加入KOH固体以调节溶液pH(忽略溶液体积的变化、忽略H2SO3的挥发和分解)。当pH为7时,能否有CaSO3沉淀生成_______ (填“能”或“否”)。
(1)H2SO3溶液和NaHA溶液反应的主要离子方程式为
(2)0.1mol/L Na2SO3溶液中离子浓度由大到小的顺序为
(3)25℃时.将10mL0.20mol·L-1的HCOOH溶液和10mL0.20mol·L-1的CH3COOH溶液分别与10mL0.20mol·L-1的NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示:

①HCO
 的电离平衡常数表达式K=
的电离平衡常数表达式K=②反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是
(4)25℃ 时,某溶液中含有0.001 mol/LCa2+、0.010 mol/L H2SO3,加入KOH固体以调节溶液pH(忽略溶液体积的变化、忽略H2SO3的挥发和分解)。当pH为7时,能否有CaSO3沉淀生成
您最近一年使用:0次
2020-08-24更新
|
589次组卷
|
8卷引用:山西省孝义市2022-2023学年高二4月月考化学试卷
5 . (1)已知:常温下浓度为0.1mol/L的下列溶液的pH如表
①等体积等物质的量浓度的NaCl溶液与NaClO溶液中Cl-和ClO-离子个数:Cl-_________ ClO-,浓度相等的NaClO和CH3COOK溶液中:[c(Na+)-c(ClO-)]__________ [c(K+)-c(CH3COO-)](填“>”“<”或“=”)
②HCO3-的水解常数为__________ (填写具体数值),在相同温度下,同浓度的CH3COOH、H2CO3、HClO三种酸溶液的导电能力大小为__________
(2)常温下,向pH=a的醋酸中加入等体积NaOH时后呈中性,则此NaOH的pH_____ 14-a(>、<、=)
(3)常温下,已知0.1mol﹒L-1一元酸HA溶液中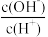 =1×10-6。
=1×10-6。
①常温下,0.1mol﹒L-1HA溶液的pH=_____ ;
②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是:_____ 。
(4)常温下,amol/L氨水与等体积0.1mol/LH2SO4溶液混合后溶液显中性,则NH3·H2O的电离平衡常数Kb=_____
| 溶质 | NaCl | CH3COOK | Na2CO3 | NaClO | NaHCO3 |
| pH | 7 | 8.1 | 11.6 | 9.7 | 8.3 |
①等体积等物质的量浓度的NaCl溶液与NaClO溶液中Cl-和ClO-离子个数:Cl-
②HCO3-的水解常数为
(2)常温下,向pH=a的醋酸中加入等体积NaOH时后呈中性,则此NaOH的pH
(3)常温下,已知0.1mol﹒L-1一元酸HA溶液中
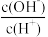 =1×10-6。
=1×10-6。①常温下,0.1mol﹒L-1HA溶液的pH=
②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是:
(4)常温下,amol/L氨水与等体积0.1mol/LH2SO4溶液混合后溶液显中性,则NH3·H2O的电离平衡常数Kb=
您最近一年使用:0次
2020-04-28更新
|
103次组卷
|
2卷引用:山西大学附属中学2020-2021学年高二上学期期中考试化学试题
名校
6 . 已知:25 ℃时,CH3COOH和NH3·H2O的电离常数相等。
(1)25 ℃时,取10 mL 0.1 mol·L-1醋酸溶液测得其pH=3。
①将上述(1)溶液加水稀释至1 000 mL,溶液pH数值范围为___________ ,溶液中c(CH3COO-)/[c(CH3COOH)·c(OH-)]___________ (填“增大”“减小”“不变”或“不能确定”)。
②25 ℃时,0.1 mol·L-1氨水(NH3·H2O溶液)的pH=___________ 。用pH试纸测定该氨水pH的操作方法为_______________________________________________________ 。
③氨水(NH3·H2O溶液)电离平衡常数表达式Kb=_______________________________ ,25 ℃时,氨水电离平衡常数约为___________ 。
(2)25 ℃时,现向10 mL 0.1 mol·L-1氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中c(NH4+)/c(NH3.H2O)___________ (填序号)。
a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(3)某温度下,向V1mL 0.1 mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=- lgc(OH-)。
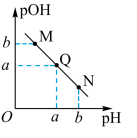
图中M、Q、N三点所示溶液呈中性的点是___________ (填字母,下同)。
图中M、Q、N三点所示溶液中水的电离程度最大的点可能是___________ 。
(1)25 ℃时,取10 mL 0.1 mol·L-1醋酸溶液测得其pH=3。
①将上述(1)溶液加水稀释至1 000 mL,溶液pH数值范围为
②25 ℃时,0.1 mol·L-1氨水(NH3·H2O溶液)的pH=
③氨水(NH3·H2O溶液)电离平衡常数表达式Kb=
(2)25 ℃时,现向10 mL 0.1 mol·L-1氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中c(NH4+)/c(NH3.H2O)
a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(3)某温度下,向V1mL 0.1 mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=- lgc(OH-)。

图中M、Q、N三点所示溶液呈中性的点是
图中M、Q、N三点所示溶液中水的电离程度最大的点可能是
您最近一年使用:0次
2019-07-22更新
|
1656次组卷
|
19卷引用:山西省吕梁市岚县中学2019—2020学年高二上学期期末考试化学试题(实验班、重点班)
山西省吕梁市岚县中学2019—2020学年高二上学期期末考试化学试题(实验班、重点班)2016-2017学年山东省曲阜师大附中高二上期中化学试卷云南省丘北二中2018-2019学年高二下学期期末考试化学试题云南省鹤庆三中2018-2019学年高二下学期期末考试化学试题云南省元江县一中2020届高三上学期开学考试化学试题云南省屏边县第一中学2019-2020学年高二上学期12月月考化学试题云南省河口县第一中学2019-2020学年高二上学期12月月考化学试题贵州省麻江县第一中学2019-2020学年高二上学期期末考试化学试题云南省迪庆州维西县第二中学2019-2020学年上学期高二期末考试化学试题云南省福贡县一中2019-2020学年高二上学期期末考试化学试题云南省陇川县民族中学2019-2020学年高二上学期期末考试化学试题云南省昭通市永善县明志高级中学2019—2020学年高二上学期期末考试化学试题贵州省长顺县二中2019-2020学年高二上学期期末考试化学试题云南省曲靖市罗平县第三中学2019-2020学年高二上学期期末考试化学试题云南省曲靖市富源县第六中学2019-2020学年高二上学期期末考试化学试题云南省曲靖市沾益县炎方一中2019-2020学年高二上学期期末考试化学试题甘肃省天水市甘谷第一中学2019-2020学年高二下学期开学考试化学试题四川省宜宾市叙州区第一中学校2019-2020学年高二下学期期中考试化学试题(已下线)3.2.1+水的电离和溶液的酸碱性-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)
名校
解题方法
7 . 次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性,回答下列问题:
(1)①H3PO2是一元中强酸,写出其电离方程式______________________ 。
②NaH2PO2为___________ (填“正盐”或“酸式盐”),其溶液显___________ (填“弱酸性”“中性”或“弱碱性”)。
③H3PO2中,P元素的化合价为___________ ;
(2)H3PO2可用于化学镀银,反应中Ag+还原为银,H3PO2氧化为H3PO4,该反应中氧化剂与还原剂的物质的量之比为________ 。
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4 反应,写出白磷与Ba(OH)2溶液反应的化学方程式______________________ 。
(1)①H3PO2是一元中强酸,写出其电离方程式
②NaH2PO2为
③H3PO2中,P元素的化合价为
(2)H3PO2可用于化学镀银,反应中Ag+还原为银,H3PO2氧化为H3PO4,该反应中氧化剂与还原剂的物质的量之比为
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4 反应,写出白磷与Ba(OH)2溶液反应的化学方程式
您最近一年使用:0次
11-12高二下·安徽六安·课时练习
名校
8 . 现有25 ℃时0.1 mol/L的氨水。请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中 c(OH-) / c(NH3·H2O)________ (填“增大”“减小”或“不变”);
(2)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式:
_____________________________________________________________________ ;
所得溶液的pH________ 7(填“>”“<”或“=”),用离子方程式表示其原因:
_____________________________________________________________________ 。
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol/L,则c(SO42-)=________ ;
(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则所得溶液中各离子物质的量浓度由大到小的关系是______________________________________ 。
(1)若向氨水中加入少量硫酸铵固体,此时溶液中 c(OH-) / c(NH3·H2O)
(2)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式:
所得溶液的pH
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol/L,则c(SO42-)=
(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则所得溶液中各离子物质的量浓度由大到小的关系是
您最近一年使用:0次
2019-01-30更新
|
463次组卷
|
9卷引用:2015-2016学年山西省晋城一中高二上12月月考化学试卷
2015-2016学年山西省晋城一中高二上12月月考化学试卷(已下线)2011-2012学年安徽省舒城晓天中学高二下学期质量测试5化学试卷(已下线)2012-2013学年福建省南安一中高二上学期期末考试化学试卷(已下线)2013届河北省石家庄市第二实验中学高二上学期期中考试理科化学试卷2014-2015学年江西省南昌二中高二上学期期中化学试卷2016-2017学年辽宁省瓦房店市高级中学高二上10月月考化学试卷【全国百强校】甘肃省天水一中2018-2019学年高二下学期寒假作业检测化学试题新疆哈密市第十五中学2019-2020学年高二下学期期中考试化学试题湖南省长沙市铁路一中2020-2021学年高二上学期第三次月考化学试题
名校
9 . 下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃)。
回答下列问题:
(1)由上表分析,若①CH3COOH,②HCO3-,③C6H5OH,④H2PO4-均可看做酸,则它们酸性由强到弱的顺序为_____________ (填编号)。
(2)写出C6H5OH与Na3PO4反应的离子方程式_______________________________ 。
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)____ c(NH4+)(填“>”、“=”或“<”)。
(4)25℃时,向10mL0.01mol/L苯酚溶液中滴加VmL0.01mol/L氨水,混合液中粒子浓度关系正确的是__________ (填字母序号)。
A.若混合液pH>7,则V≥10
B.若混合液 pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
C.V=10时,混合液中水的电离程度小于10mL0.01mol/L苯酚溶液中水的电离程度
D.V= 5时,2c(NH3·H2O)+2c(NH4+)=c(C6H5O-)+c(C6H5OH)
(5)水解反应是典型的可逆反应,水解反应的化学平衡常数称为水解常数(用Kb表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式:____________ 。
(6)I,如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
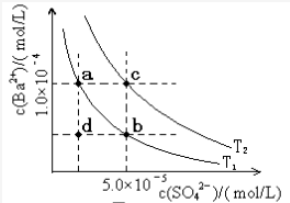
①T1______ T2(填“>”、“=”或‘‘<”),T2温度时 Ksp(BaSO4)=_______________ ;
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是______ (填字母序号)。
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a,b之间的某一点(不含a,b)
D.升温可使溶液由b点变为d点
II.现有0.2mol的BaSO4沉淀,每次用1L饱和Na2CO3溶液(浓度为1.7mol/L)处理。若使BaSO4中的SO42-全部转化到溶液中,需要反复处理_____ 次。[提示:BaSO4(s)+CO32-(aq) BaCO3(s)+SO42-(aq)]
BaCO3(s)+SO42-(aq)]
| 电解质 | 电离方程式 | 电离常数K或Ksp |
| CH3COOH | CH3COO CH3COO-+H+ CH3COO-+H+ | 1.76×10-5 |
| H2CO3 | H2CO3 H++HCO3- H++HCO3-HCO3-  H++CO32- H++CO32- | K1=4.31×10-7 K2=5.61×10-11 |
| C6H5OH | C6H5OH C6H5O-+H+ C6H5O-+H+ | 1.1×10-10 |
| H3PO4 | H3PO4  H++H2PO4- H++H2PO4-H2PO4-  H++HPO42- H++HPO42-HPO42-  H++PO43- H++PO43- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
| NH3·H2O | NH3·H2O NH4++OH- NH4++OH- | 1.76×10-5 |
| BaSO4 | BaSO4(s) Ba2+(aq)+SO42-(aq) Ba2+(aq)+SO42-(aq) | 1.07×10-10 |
| BaCO3 | BaCO3(s) Ba2+(aq)+CO2-(aq) Ba2+(aq)+CO2-(aq) | 2.58×10-9 |
回答下列问题:
(1)由上表分析,若①CH3COOH,②HCO3-,③C6H5OH,④H2PO4-均可看做酸,则它们酸性由强到弱的顺序为
(2)写出C6H5OH与Na3PO4反应的离子方程式
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)
(4)25℃时,向10mL0.01mol/L苯酚溶液中滴加VmL0.01mol/L氨水,混合液中粒子浓度关系正确的是
A.若混合液pH>7,则V≥10
B.若混合液 pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
C.V=10时,混合液中水的电离程度小于10mL0.01mol/L苯酚溶液中水的电离程度
D.V= 5时,2c(NH3·H2O)+2c(NH4+)=c(C6H5O-)+c(C6H5OH)
(5)水解反应是典型的可逆反应,水解反应的化学平衡常数称为水解常数(用Kb表示),类比化学平衡常数的定义,请写出Na2CO3第一步水解反应的水解常数的表达式:
(6)I,如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:

①T1
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a,b之间的某一点(不含a,b)
D.升温可使溶液由b点变为d点
II.现有0.2mol的BaSO4沉淀,每次用1L饱和Na2CO3溶液(浓度为1.7mol/L)处理。若使BaSO4中的SO42-全部转化到溶液中,需要反复处理
 BaCO3(s)+SO42-(aq)]
BaCO3(s)+SO42-(aq)]
您最近一年使用:0次
10 . 含氮化合物在生活、生产和科技等方面有重要的应用。
⑴已知298 K时,亚硝酸(HNO2)的电离平衡常数Ka=5.1×10-4,H2CO3的电离平衡常数 Ka1=4.2×10-7、Ka2=5.61×10-11。
① NaNO2溶液呈____ (填“酸性”“碱性”或“中性”),原因是_________ (用离子方程式表示)。
②向含有1 mol碳酸钠的溶液中加入1 mol HNO2后,溶液中c(CO32-)、c(HCO3-)、c(NO2-)由大到小的顺序为________________ 。
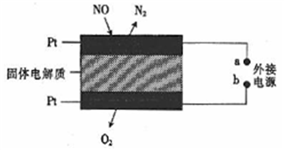
(2)电化学催化净化NO是处理含氮化合物的一种新方法,原理如图所示,固体电解质起到传导O2-的作用。b极为电源的_____ (填“正极”或“负极”),通入NO的电极上的电极反应式为______ 。
⑶N2O5是绿色硝化剂,能溶于水生成硝酸。常温下,向0.1 mol·L-1的氨水中加入少量N2O5,使溶液中c(NH3•H2O):c(NH4+)=5 : 9,此时溶液中 c(NH4+)+c(H+) — c(NO3-)=_____ 。 (25℃时,NH3•H2O的电离常数Kb=1.8×10-5)
⑴已知298 K时,亚硝酸(HNO2)的电离平衡常数Ka=5.1×10-4,H2CO3的电离平衡常数 Ka1=4.2×10-7、Ka2=5.61×10-11。
① NaNO2溶液呈
②向含有1 mol碳酸钠的溶液中加入1 mol HNO2后,溶液中c(CO32-)、c(HCO3-)、c(NO2-)由大到小的顺序为
(2)电化学催化净化NO是处理含氮化合物的一种新方法,原理如图所示,固体电解质起到传导O2-的作用。b极为电源的
⑶N2O5是绿色硝化剂,能溶于水生成硝酸。常温下,向0.1 mol·L-1的氨水中加入少量N2O5,使溶液中c(NH3•H2O):c(NH4+)=5 : 9,此时溶液中 c(NH4+)+c(H+) — c(NO3-)=
您最近一年使用:0次



