1 . 根据信息回答下列问题:
(1) 和
和 的相对分子质量相近,但沸点
的相对分子质量相近,但沸点 较高,主要原因是
较高,主要原因是_______ 。
(2)常温下,四种酸的电离平衡常数如下:回答下列问题:
①下列四种离子结合质子能力最强的是_______ (填字母)。
a. b.
b. c.
c. d.
d. e.
e.
②下列反应不能发生的是_______ (填字母)。
a.
b.
c.
d.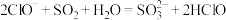
③工业上可用氨水除去尾气 ,常温下将
,常温下将 通入氨水中,当
通入氨水中,当 降至
降至 时,溶液中的
时,溶液中的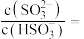
_______ (保留三位有效数字)。
(1)
 和
和 的相对分子质量相近,但沸点
的相对分子质量相近,但沸点 较高,主要原因是
较高,主要原因是(2)常温下,四种酸的电离平衡常数如下:回答下列问题:
| 化学式 |  |  |  |  |
| 电离平衡常数 |  |   |  | 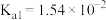 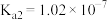 |
a.
 b.
b. c.
c. d.
d. e.
e.
②下列反应不能发生的是
a.

b.

c.

d.
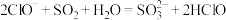
③工业上可用氨水除去尾气
 ,常温下将
,常温下将 通入氨水中,当
通入氨水中,当 降至
降至 时,溶液中的
时,溶液中的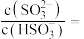
您最近一年使用:0次
名校
2 . 完成下列问题。
(1)一定温度下,利用pH计测定不同浓度醋酸溶液的pH值,得到如下数据:
①求该温度下醋酸的电离平衡常数___________ 。
②当醋酸浓度为0.1mol·L-1时,则电离度为___________ 。
(2)相同条件下,相同物质的量浓度的下列溶液:①NaClO②NaHCO3③Na2CO3④CH3COONa等溶液,pH值由大到小的顺序___________ (填序号)(已知:CH3COOH Ka=1.76×10-5,H2CO3 Ka1=4.30×10-7 Ka2=5.61×10-11,HClO Ka=2.95×10-8)
(1)一定温度下,利用pH计测定不同浓度醋酸溶液的pH值,得到如下数据:
| 醋酸浓度(mol·L-1) | 1 | 0.1 | 0.01 |
| pH值 | 2.50 | 3.00 | 3.50 |
①求该温度下醋酸的电离平衡常数
②当醋酸浓度为0.1mol·L-1时,则电离度为
(2)相同条件下,相同物质的量浓度的下列溶液:①NaClO②NaHCO3③Na2CO3④CH3COONa等溶液,pH值由大到小的顺序
您最近一年使用:0次
2021-11-26更新
|
176次组卷
|
2卷引用:浙江省温州新力量联盟2021-2022学年高二上学期期中联考化学试题
3 . 最近几年雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一、
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g) 2CO2(g)+N2(g),在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。据此判断:
2CO2(g)+N2(g),在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。据此判断:

①该反应的ΔH___________ 0(选填“>”、“<”)。
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在图甲中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线________ 。
③研究表明在紫外线照射下,由于TiO2的催化作用,空气中的某些物质会产生OH自由基,如图乙所示,OH与NO2反应为NO2+OH=HNO3,写出NO与OH反应的化学方程式___________ 。

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。NH3与CO2在120oC,催化剂作用下反应生成尿素:CO2(g)+2NH3(g)⇌(NH2)2CO(s)+H2O(g)。现将物质的量为1︰1的NH3与CO2混合在密闭固体容器中反应,平衡后,NH3的体积分数为20%,则NH3的平衡转化率为___________ 。
②25℃时,将amol•L-1的氨水与bmol•L-1盐酸等体积混合,反应后溶液恰好显中性,用a、b表示NH3•H2O的电离平衡常数为___________ 。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)
 2CO2(g)+N2(g),在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。据此判断:
2CO2(g)+N2(g),在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。据此判断:
①该反应的ΔH
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在图甲中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线
③研究表明在紫外线照射下,由于TiO2的催化作用,空气中的某些物质会产生OH自由基,如图乙所示,OH与NO2反应为NO2+OH=HNO3,写出NO与OH反应的化学方程式

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。NH3与CO2在120oC,催化剂作用下反应生成尿素:CO2(g)+2NH3(g)⇌(NH2)2CO(s)+H2O(g)。现将物质的量为1︰1的NH3与CO2混合在密闭固体容器中反应,平衡后,NH3的体积分数为20%,则NH3的平衡转化率为
②25℃时,将amol•L-1的氨水与bmol•L-1盐酸等体积混合,反应后溶液恰好显中性,用a、b表示NH3•H2O的电离平衡常数为
您最近一年使用:0次
解题方法
4 . NH2OH (羟胺)是一种无色针状结晶,羟胺及其盐类常用作有机合成的还原剂,回答下列问题:
(1)NH2OH的电子式为_______ 。
(2)室温时,NH2OH会发生分解反应,分解产生的无色气体遇浓盐酸产生白烟,与空气接触变为红棕色;且其分解产物会使无水CuSO4变蓝色,则NH2OH分解反应的化学方程式_______ ,NH2OH水溶液显碱性,其电离方式类似于氨水的电离,写出其电离方程式:_______
(1)NH2OH的电子式为
(2)室温时,NH2OH会发生分解反应,分解产生的无色气体遇浓盐酸产生白烟,与空气接触变为红棕色;且其分解产物会使无水CuSO4变蓝色,则NH2OH分解反应的化学方程式
您最近一年使用:0次
20-21高三下·浙江·期中
解题方法
5 . (1) Al(OH)3具有一元弱酸的性质,在水中电离时产生的含铝微粒具有正四面体结构,写出电离方程式:___________ 。
(2)人体血液里主要通过碳酸氢盐缓冲体系( )维持pH稳定。已知正常体温人体血液中,H2CO3的一级电离常数Ka1=10-6.1,
)维持pH稳定。已知正常体温人体血液中,H2CO3的一级电离常数Ka1=10-6.1, ≈
≈ ,1g2=03.由题给数据可算得正常人体血液的pH约为
,1g2=03.由题给数据可算得正常人体血液的pH约为___________ ,当过量的酸进入血液中时,血液缓冲体系中 的值将
的值将___________ (填“变大、变小、不变”)。
(2)人体血液里主要通过碳酸氢盐缓冲体系(
 )维持pH稳定。已知正常体温人体血液中,H2CO3的一级电离常数Ka1=10-6.1,
)维持pH稳定。已知正常体温人体血液中,H2CO3的一级电离常数Ka1=10-6.1, ≈
≈ ,1g2=03.由题给数据可算得正常人体血液的pH约为
,1g2=03.由题给数据可算得正常人体血液的pH约为 的值将
的值将
您最近一年使用:0次
20-21高二下·浙江·阶段练习
6 . (1)元素N与Cl的非金属性均较强,但常温下氮气远比氯气稳定,主要原因是___ 。
(2)CO2的电子式是___ 。
(3)六亚甲基四胺( )的水溶液呈弱碱性,室温下其电离常数K1≈1.0×10-8。室温下,0.01mol·L-1六亚甲基四胺水溶液的pH等于
)的水溶液呈弱碱性,室温下其电离常数K1≈1.0×10-8。室温下,0.01mol·L-1六亚甲基四胺水溶液的pH等于___ (只考虑六亚甲基四胺的一级电离,忽略H2O的电离)。
(4)比较等浓度的NaHCO3和C6H5ONa溶液的碱性强弱:NaHCO3___ C6H5ONa。
(5) ,请用系统命名法对该有机物命名
,请用系统命名法对该有机物命名___ 。
(2)CO2的电子式是
(3)六亚甲基四胺(
 )的水溶液呈弱碱性,室温下其电离常数K1≈1.0×10-8。室温下,0.01mol·L-1六亚甲基四胺水溶液的pH等于
)的水溶液呈弱碱性,室温下其电离常数K1≈1.0×10-8。室温下,0.01mol·L-1六亚甲基四胺水溶液的pH等于(4)比较等浓度的NaHCO3和C6H5ONa溶液的碱性强弱:NaHCO3
(5)
 ,请用系统命名法对该有机物命名
,请用系统命名法对该有机物命名
您最近一年使用:0次
解题方法
7 . (1)已知氯乙酸的酸性强于醋酸,则酸性:
___________  (填:>、<或=)。
(填:>、<或=)。
(2)次磷酸( )与足量
)与足量 溶液反应生成
溶液反应生成 ,据此写出
,据此写出 的结构式
的结构式___________ 。
注:磷酸的结构式为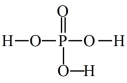
(3)常压下,苯和甲苯的熔、沸点如下表:
①苯的沸点比甲苯的沸点更低,主要原因是___________ 。
②苯晶体的熔点比甲苯的熔点更高,主要原因是___________ 。

 (填:>、<或=)。
(填:>、<或=)。(2)次磷酸(
 )与足量
)与足量 溶液反应生成
溶液反应生成 ,据此写出
,据此写出 的结构式
的结构式注:磷酸的结构式为

(3)常压下,苯和甲苯的熔、沸点如下表:
| 苯的模型 |  | 熔点: | 甲苯模型 |  | 熔点: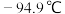 |
沸点: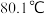 | 沸点: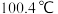 |
②苯晶体的熔点比甲苯的熔点更高,主要原因是
您最近一年使用:0次
8 . 已知 的
的 、
、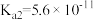 ,HClO的
,HClO的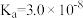 ,HF的
,HF的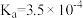 。
。
(1)NaClO溶液中通入少量 反应的离子方程式为
反应的离子方程式为_______ 。
(2)常温下,将pH和体积都相同的氢氟酸和次氯酸分别加蒸馏水稀释,pH随溶液体积变化如图所示。

①曲线Ⅰ为_______ 稀释时pH的变化曲线。
②取A点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗_______ 体积较小。
(3)25℃时,将0.40 HCN溶液与0.20
HCN溶液与0.20 NaOH溶液各100mL混合后,测得溶液的
NaOH溶液各100mL混合后,测得溶液的 。则该溶液中所有离子浓度大小关系为
。则该溶液中所有离子浓度大小关系为_______ ;
_______  。(用a的代数式表示)
。(用a的代数式表示)
 的
的 、
、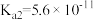 ,HClO的
,HClO的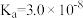 ,HF的
,HF的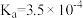 。
。(1)NaClO溶液中通入少量
 反应的离子方程式为
反应的离子方程式为(2)常温下,将pH和体积都相同的氢氟酸和次氯酸分别加蒸馏水稀释,pH随溶液体积变化如图所示。

①曲线Ⅰ为
②取A点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗
(3)25℃时,将0.40
 HCN溶液与0.20
HCN溶液与0.20 NaOH溶液各100mL混合后,测得溶液的
NaOH溶液各100mL混合后,测得溶液的 。则该溶液中所有离子浓度大小关系为
。则该溶液中所有离子浓度大小关系为
 。(用a的代数式表示)
。(用a的代数式表示)
您最近一年使用:0次
20-21高二下·浙江·阶段练习
9 . 常温下,有浓度均为0.1mol/L的下列4种溶液:
①NaCN溶液;②NaOH溶液;③CH3COONa溶液;④NaHCO3溶液
已知:
(1)这4种溶液pH大到小的顺序是___________ (填序号)。
(2)常温下, 的水解常数Kh=2×10-4,当Na2CO3溶液中c(
的水解常数Kh=2×10-4,当Na2CO3溶液中c( ):c(
):c( )=2:1时,试求该溶液的pH=
)=2:1时,试求该溶液的pH=___________ 。
(3)25℃时,某HCN和NaCN的混合溶液的pH=11,则 为
为___________ 。
(4)往NaCN溶液通入少量CO2气体时,发生的化学反应方程式___________ 。
①NaCN溶液;②NaOH溶液;③CH3COONa溶液;④NaHCO3溶液
已知:
| HCN | H2CO3 | CH3COOH |
| Ka=5.0×10-10 | Ka1=4×10-7 Ka2=5.0×10-11 | Ka=1.7×10-5 |
(2)常温下,
 的水解常数Kh=2×10-4,当Na2CO3溶液中c(
的水解常数Kh=2×10-4,当Na2CO3溶液中c( ):c(
):c( )=2:1时,试求该溶液的pH=
)=2:1时,试求该溶液的pH=(3)25℃时,某HCN和NaCN的混合溶液的pH=11,则
 为
为(4)往NaCN溶液通入少量CO2气体时,发生的化学反应方程式
您最近一年使用:0次
名校
解题方法
10 . 研究电解质在水溶液中的平衡能了解它的存在形式。
①常温下,0.01 mol . L-1HA溶液中由水电离出的c(H+) =_________ mol/L。
②常温下一定浓度的MA稀溶液的pH=a,则a___ 7(填 “>”、“<”或“=”),用离子方程式表示其原因为_______________ 。
③K点时,溶液中c(H+)+c(M+)-c(OH-)=_____________ mol/L。
(2)20°C时,有c(H2C2O4)+c( )+c(
)+c( ) = 0.100 mol/L的H2C2O4、NaOH混合溶液,图乙中曲线①、②、③分别对应H2C2O4、
) = 0.100 mol/L的H2C2O4、NaOH混合溶液,图乙中曲线①、②、③分别对应H2C2O4、 、
、  三种微粒的物质的量分数δ随溶液pH变化的关系。请回答以下两个问题:
三种微粒的物质的量分数δ随溶液pH变化的关系。请回答以下两个问题:
①Q点:c(H2C2O4)___ c( ) (填 “>”、“<”或“=”)
) (填 “>”、“<”或“=”)
②该温度下 的电离常数K =
的电离常数K =_______________ 。
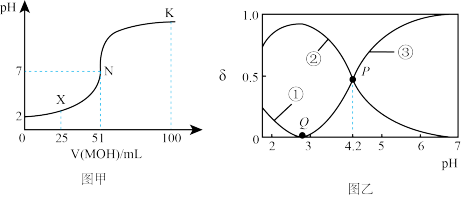
①常温下,0.01 mol . L-1HA溶液中由水电离出的c(H+) =
②常温下一定浓度的MA稀溶液的pH=a,则a
③K点时,溶液中c(H+)+c(M+)-c(OH-)=
(2)20°C时,有c(H2C2O4)+c(
 )+c(
)+c( ) = 0.100 mol/L的H2C2O4、NaOH混合溶液,图乙中曲线①、②、③分别对应H2C2O4、
) = 0.100 mol/L的H2C2O4、NaOH混合溶液,图乙中曲线①、②、③分别对应H2C2O4、 、
、  三种微粒的物质的量分数δ随溶液pH变化的关系。请回答以下两个问题:
三种微粒的物质的量分数δ随溶液pH变化的关系。请回答以下两个问题:①Q点:c(H2C2O4)
 ) (填 “>”、“<”或“=”)
) (填 “>”、“<”或“=”)②该温度下
 的电离常数K =
的电离常数K =
您最近一年使用:0次
2020-09-02更新
|
361次组卷
|
3卷引用:浙江省宁波市余姚中学2019-2020学年高二下学期期中考试化学试题



