1 . 常温下,有四种溶液:①0.1mol·L-1CH3COOH溶液②0.1mol·L-1CH3COONa溶液③0.1mol·L-1NaHSO3溶液④0.1mol·L-1NaHCO3溶液。
(1)溶液①的pH_______ (填“>”“<”或“=”)7,溶液中离子的电荷守恒关系式是_______ 。
(2)溶液②呈_______ (填“酸”“碱”或“中”)性。其原因是_______ (用离子方程式和适当的叙述说明)。
(3)NaHSO3溶液的pH<7,NaHCO3溶液的pH>7,则NaHSO3溶液中c(H2SO3)_______ (填“>”“<”或“=”,下同)c(SO ),NaHCO3溶液中c(H2CO3)
),NaHCO3溶液中c(H2CO3)_______ c(CO )。
)。
(1)溶液①的pH
(2)溶液②呈
(3)NaHSO3溶液的pH<7,NaHCO3溶液的pH>7,则NaHSO3溶液中c(H2SO3)
 ),NaHCO3溶液中c(H2CO3)
),NaHCO3溶液中c(H2CO3) )。
)。
您最近一年使用:0次
名校
解题方法
2 . (I)已知常温下部分弱电解质的电离平衡常数如表:
(1)常温下,物质的量浓度相同的三种溶液①NaF溶液②NaClO溶液③Na2CO3溶液,其pH由大到小的顺序是_______ (填序号)。
(2)25℃时,pH=4的NH4Cl溶液中各离子浓度的大小关系为_______ ,水电离出的氢离子的浓度为_______
(3)NaClO溶液中的质子守恒关系为_______ 。
(4)向足量的次氯酸钠中通入少量的二氧化碳的离子方程式_______
(5)25℃下,将pH=12的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=_______ 。
(II)在25℃时对氨水进行如下操作。请填写下列空白。
(6)若向氨水中加入少量硫酸铵固体,则溶液中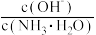 将
将_______ (填“增大”“减小”或“不变”)。
(7)若向氨水中加入稀硫酸,使氨水恰好被中和,写出反应的离子方程式:_______ ;所得溶液的pH_______ 7(填“>”“<”或“=”)。
(8)等浓度的①氨水,②氯化铵,③碳酸氢铵,④硫酸氢铵中c( )浓度的由大到小排序:
)浓度的由大到小排序:_______ (用序号)。
| 化学式 | HF | HClO | H2CO3 | NH3·H2O |
| 电离常数 | 6.8×10−4 | 4.7×10−8 | K1=4.3×10−7 K2=5.6×10−11 | Kb=1.7×10−5 |
(2)25℃时,pH=4的NH4Cl溶液中各离子浓度的大小关系为
(3)NaClO溶液中的质子守恒关系为
(4)向足量的次氯酸钠中通入少量的二氧化碳的离子方程式
(5)25℃下,将pH=12的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2=
(II)在25℃时对氨水进行如下操作。请填写下列空白。
(6)若向氨水中加入少量硫酸铵固体,则溶液中
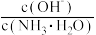 将
将(7)若向氨水中加入稀硫酸,使氨水恰好被中和,写出反应的离子方程式:
(8)等浓度的①氨水,②氯化铵,③碳酸氢铵,④硫酸氢铵中c(
 )浓度的由大到小排序:
)浓度的由大到小排序:
您最近一年使用:0次
3 . 弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问题:
(1)生活中明矾常作净水剂,其净水的原理是_______ (用离子方程式表示)。
(2)某温度下, 和
和 的电离常数数值相等,物质的量浓度相同的
的电离常数数值相等,物质的量浓度相同的 溶液和氨水混合后,溶液中
溶液和氨水混合后,溶液中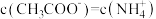 ,则所加入
,则所加入 溶液的体积
溶液的体积_______ (填“大于”“小于”或“等于”)氨水的体积。
(3)常温下,取 溶液与
溶液与 溶液等体积混合,测得混合后溶液的
溶液等体积混合,测得混合后溶液的 。写出
。写出 的电离方程式
的电离方程式_______ ,并写出所得溶液中离子浓度大小关系_______ 。
(4)含 的废水毒性较大,某工厂废水中含
的废水毒性较大,某工厂废水中含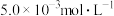 的
的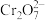 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理:

①绿矾为 ,反应(I)中
,反应(I)中 与
与 的物质的量之比为
的物质的量之比为_______ 。
②常温下若处理后的废水中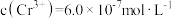 ,则处理后的废水的pH=
,则处理后的废水的pH=_______ 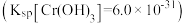 。
。
(1)生活中明矾常作净水剂,其净水的原理是
(2)某温度下,
 和
和 的电离常数数值相等,物质的量浓度相同的
的电离常数数值相等,物质的量浓度相同的 溶液和氨水混合后,溶液中
溶液和氨水混合后,溶液中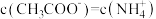 ,则所加入
,则所加入 溶液的体积
溶液的体积(3)常温下,取
 溶液与
溶液与 溶液等体积混合,测得混合后溶液的
溶液等体积混合,测得混合后溶液的 。写出
。写出 的电离方程式
的电离方程式(4)含
 的废水毒性较大,某工厂废水中含
的废水毒性较大,某工厂废水中含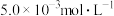 的
的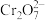 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理:
①绿矾为
 ,反应(I)中
,反应(I)中 与
与 的物质的量之比为
的物质的量之比为②常温下若处理后的废水中
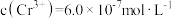 ,则处理后的废水的pH=
,则处理后的废水的pH=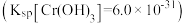 。
。
您最近一年使用:0次
名校
解题方法
4 . 常温下,有四种溶液:
①0.1 mol·L-1 CH3COOH溶液 ②0.1 mol·L-1 CH3COONa溶液 ③0.1 mol·L-1 NaHSO3溶液④0.1 mol·L-1 NaHCO3溶液
(1)溶液①的pH____ (填“>”“<”或“=”)7,溶液中离子的电荷守恒关系式是___ 。
(2)溶液②呈______ (填“酸”“碱”或“中”)性。其原因是___ (用离子方程式说明)。
(3)下列有关①和②两种溶液的说法正确的是____ (填字母)。
a. 两种溶液中c(CH3COO-) 都小于0.1 mol·L-1
b. 两种溶液中c(CH3COO-) 都等于0.1 mol·L-1
c. CH3COOH溶液中c(CH3COO-) 小于CH3COONa溶液中c(CH3COO-)
(4)NaHCO3溶液的pH>7,NaHSO3溶液的pH<7,则,NaHCO3溶液中c(H2CO3)______ (填“>”“<”或“=”,下同)c( ),NaHSO3溶液中c(H2SO3)
),NaHSO3溶液中c(H2SO3)____ c( )
)
①0.1 mol·L-1 CH3COOH溶液 ②0.1 mol·L-1 CH3COONa溶液 ③0.1 mol·L-1 NaHSO3溶液④0.1 mol·L-1 NaHCO3溶液
(1)溶液①的pH
(2)溶液②呈
(3)下列有关①和②两种溶液的说法正确的是
a. 两种溶液中c(CH3COO-) 都小于0.1 mol·L-1
b. 两种溶液中c(CH3COO-) 都等于0.1 mol·L-1
c. CH3COOH溶液中c(CH3COO-) 小于CH3COONa溶液中c(CH3COO-)
(4)NaHCO3溶液的pH>7,NaHSO3溶液的pH<7,则,NaHCO3溶液中c(H2CO3)
 ),NaHSO3溶液中c(H2SO3)
),NaHSO3溶液中c(H2SO3) )
)
您最近一年使用:0次
2022-12-05更新
|
581次组卷
|
9卷引用:黑龙江省哈尔滨市宾县第二中学2022-2023学年高二上学期期中考试化学试题
黑龙江省哈尔滨市宾县第二中学2022-2023学年高二上学期期中考试化学试题江苏省海安市2020-2021学年高二上学期期中考试化学试题(已下线)第03章 水溶液中的离子反应与平衡(A卷基础强化篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)云南省通海县一中2020-2021学年高二下学期期中考试化学试题(已下线)第3章 水溶液中的离子反应与平衡(基础过关卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)【石家庄新东方】2021-2022石家庄23中高二10月月考化学试题辽宁省朝阳市建平县高级中学2021-2022学年高二上学期第二次月考化学试题广东省广州市第八十六中学2022-2023学年高二上学期期中考试化学试题(已下线)专题突破卷09 水溶液中的离子反应与平衡 ?-2024年高考化学一轮复习考点通关卷(新教材新高考)
5 . 回答下列问题:
(1)常温下,向20 mL 0.010 mol·L-1的HA溶液中逐滴加入0.010 mol·L-1的NaOH溶液,溶液中lg c(OH-)与所加NaOH溶液的体积(V)的关系如图。
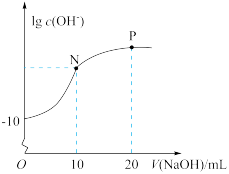
HA是__________ (“强酸”或“弱酸”)。N点溶液中2c(H+)-2c(OH-)=____________ (用含A微粒的符号表示)
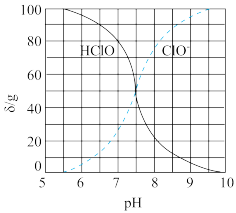
(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ(X)= ,X为HClO或ClO-与pH的关系如图所示。HClO的电离常数Ka值为
,X为HClO或ClO-与pH的关系如图所示。HClO的电离常数Ka值为__________ 。常温下向0.1 mol·L-1的HClO溶液中加入等体积的0.1mol·L-1的NaOH溶液后,c(ClO-)+c(HClO)=__________ mol·L-1。
(3)PH相同、等体积的两份溶液A(盐酸)和B(CH3COOH)分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是____ (填序号)。
①反应所需要的时间B>A ②开始反应时的速率A>B
③参加反应的锌的物质的量A=B ④反应过程的平均速率B>A
⑤A中有锌剩余 ⑥B中有锌剩余
(4)已知草酸为二元弱酸:H2C2O4 HC2O
HC2O +H+ Ka1,HC2O
+H+ Ka1,HC2O
 C2O
C2O +H+ Ka2,常温下,向某浓度的H2C2O4溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O
+H+ Ka2,常温下,向某浓度的H2C2O4溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O 、C2O
、C2O 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示。
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示。
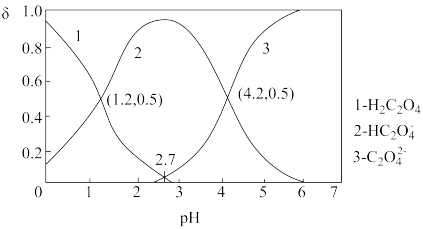
①则常温下0.1 mol/L的NaHC2O4溶液显_________ 填酸性、碱性或中性)
②pH=2.7时,溶液中 =
=______ 。
(1)常温下,向20 mL 0.010 mol·L-1的HA溶液中逐滴加入0.010 mol·L-1的NaOH溶液,溶液中lg c(OH-)与所加NaOH溶液的体积(V)的关系如图。

HA是
(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ(X)=
 ,X为HClO或ClO-与pH的关系如图所示。HClO的电离常数Ka值为
,X为HClO或ClO-与pH的关系如图所示。HClO的电离常数Ka值为
(3)PH相同、等体积的两份溶液A(盐酸)和B(CH3COOH)分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是
①反应所需要的时间B>A ②开始反应时的速率A>B
③参加反应的锌的物质的量A=B ④反应过程的平均速率B>A
⑤A中有锌剩余 ⑥B中有锌剩余
(4)已知草酸为二元弱酸:H2C2O4
 HC2O
HC2O +H+ Ka1,HC2O
+H+ Ka1,HC2O
 C2O
C2O +H+ Ka2,常温下,向某浓度的H2C2O4溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O
+H+ Ka2,常温下,向某浓度的H2C2O4溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O 、C2O
、C2O 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示。
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示。
①则常温下0.1 mol/L的NaHC2O4溶液显
②pH=2.7时,溶液中
 =
=
您最近一年使用:0次
2022-11-21更新
|
327次组卷
|
3卷引用:黑龙江省哈尔滨市兆麟中学2023-2024学年高二上学期期中考试化学试题
6 . Ⅰ.请回答下列问题:
(1)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如图所示:

a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是____ 。
(2)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
①物质的量浓度均为0.1mol/L的四种溶液:pH由小到大排列的顺序是____ (用编号填写)。
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:____ 。
(3)已知常温时,amol/L醋酸在水中与0.1mol/LNaOH等体积混合,溶液为中性,则醋酸钠的水解平衡常数Kh=_____ (用含a的代数式表示)。
Ⅱ.结合表格回答下列问题(均为常温下的数据):
(4)0.1mol/L的KHC2O4溶液呈酸性,该溶液中各离子浓度由大到小的顺序为____ 。
(5)pH相同的NaClO和CH3COOK溶液中,[c(Na+)-c(C1O-)]____ [c(K+)-c(CH3COO-)](填“>”、“<”或“=”)。
(6)向0.1mol/LCH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=____ 。(CH3COOH的电离平衡常数Ka=1.8×10-5)
(1)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如图所示:

a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是
(2)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:
(3)已知常温时,amol/L醋酸在水中与0.1mol/LNaOH等体积混合,溶液为中性,则醋酸钠的水解平衡常数Kh=
Ⅱ.结合表格回答下列问题(均为常温下的数据):
| 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
| CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 | H2C2O4 | K1=5.4×10-2 | H2S | K1=1.3×10-7 |
| HClO | 3×10-8 | K2=4.7×10-11 | K2=5.4×10-5 | K2=7.1×10-15 |
(5)pH相同的NaClO和CH3COOK溶液中,[c(Na+)-c(C1O-)]
(6)向0.1mol/LCH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=
您最近一年使用:0次
名校
7 . 已知如表数据(25℃):
(1)25℃时,将等体积等浓度的醋酸和氨水混合,混合溶液的pH___ 7(填“>”、“=”或“<”,该混合溶液中水的电离会受到____ (填“促进”、“抑制”、“既不促进也不抑制”)。
(2)NaCN溶液呈___ 性,用离子方程式解释原因____ 。
(3)25℃时,相同物质的量浓度的下列溶液①CH3COOH②NH3·H2O③NaCN④Na2CO3⑤H2A中pH由大到小的顺序是___ (填序号)。
(4)下列溶液中,分别是由等体积0.1mol/L的2种溶液混合而成.①NH4Cl和H2A②NH4Cl和Na2CO3③NH4Cl和CH3COONa溶液中NH3·H2O浓度由大到小的排列顺序是:____ 。(用序号排列)
(5)写出泡沫灭火器原理____ (离子方程式)。
(6)现有浓度为0.02mol/L的HCN溶液与0.01mol/LNaOH溶液等体积混合之后(忽略混合过程中溶液体积的改变),测得c(Na+)>c(CN-),下列关系正确的是___ 。
| 物质 | CH3COOH | NH3·H2O | HCN | H2CO3 | H2A |
| 电离常数(K) | 1.7×10-5 | 1.7×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 | K1=1×106 K2=1×10-2 |
(1)25℃时,将等体积等浓度的醋酸和氨水混合,混合溶液的pH
(2)NaCN溶液呈
(3)25℃时,相同物质的量浓度的下列溶液①CH3COOH②NH3·H2O③NaCN④Na2CO3⑤H2A中pH由大到小的顺序是
(4)下列溶液中,分别是由等体积0.1mol/L的2种溶液混合而成.①NH4Cl和H2A②NH4Cl和Na2CO3③NH4Cl和CH3COONa溶液中NH3·H2O浓度由大到小的排列顺序是:
(5)写出泡沫灭火器原理
(6)现有浓度为0.02mol/L的HCN溶液与0.01mol/LNaOH溶液等体积混合之后(忽略混合过程中溶液体积的改变),测得c(Na+)>c(CN-),下列关系正确的是
| A.c(H+)>c(OH-) |
| B.c(HCN)>c(CN-) |
| C.c(H+)+c(HCN)=c(OH-)+c(CN-) |
| D.c(HCN)+c(CN-)=0.01mol/L |
您最近一年使用:0次
2022-03-16更新
|
226次组卷
|
3卷引用:黑龙江省哈尔滨市第六中学2021-2022学年高二上学期期末考试化学试题
8 . 水溶液是生命体赖以生存的环境,许多化学反应都是在水溶液中进行的。
I.25℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)室温下,关于 的
的 溶液,下列分析正确的是
溶液,下列分析正确的是
(2)物质的量浓度均为0.1 的六种溶液①
的六种溶液① ②
② ③NaClO④
③NaClO④ ⑤
⑤ ⑥
⑥ ,pH由小到大的顺序
,pH由小到大的顺序___________ (填序号)。
(3)向次氯酸钠溶液通入少量 发生反应的离子方程式
发生反应的离子方程式___________ 。
(4)碳酸氢铵溶液显___________ (填“酸”、“中”或“碱”)性。
(5)向a 的
的 溶液加入等体积的未知浓度的稀盐酸,溶液恰好呈中性,则所加稀盐酸的物质的量浓度
溶液加入等体积的未知浓度的稀盐酸,溶液恰好呈中性,则所加稀盐酸的物质的量浓度___________  (用含a的式子表示)。
(用含a的式子表示)。
II. 是一种液态化合物,在盛有10mL水的锥形瓶中,小心地滴加8——10滴
是一种液态化合物,在盛有10mL水的锥形瓶中,小心地滴加8——10滴 ,发生剧烈反应,液面上有白色酸雾形成,产生有刺激性气味的气体,该气体可使湿润的品红试纸褪色。
,发生剧烈反应,液面上有白色酸雾形成,产生有刺激性气味的气体,该气体可使湿润的品红试纸褪色。
(6)则 和水反应的化学方程式为:
和水反应的化学方程式为:___________ 。
(7)若将 溶液直接蒸干得不到无水
溶液直接蒸干得不到无水 ,用
,用 与
与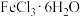 混合共热,则可得到无水
混合共热,则可得到无水 ,其原因是
,其原因是___________ 。(用简要的文字回答)
I.25℃时,部分物质的电离平衡常数如表所示:
| 化学式 |  |  |  |  |
| 电离平衡常数 |  |  |   | 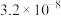 |
请回答下列问题:
(1)室温下,关于
 的
的 溶液,下列分析正确的是
溶液,下列分析正确的是 A.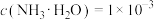  |
B.由水电离出的  |
C.加入少量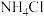 固体, 固体, 的电离平衡逆向移动, 的电离平衡逆向移动, 的值减小 的值减小 |
D.加入等体积 的盐酸,所得溶液: 的盐酸,所得溶液: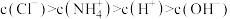 |
 的六种溶液①
的六种溶液①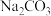 ②
② ③NaClO④
③NaClO④ ⑤
⑤ ⑥
⑥ ,pH由小到大的顺序
,pH由小到大的顺序(3)向次氯酸钠溶液通入少量
 发生反应的离子方程式
发生反应的离子方程式(4)碳酸氢铵溶液显
(5)向a
 的
的 溶液加入等体积的未知浓度的稀盐酸,溶液恰好呈中性,则所加稀盐酸的物质的量浓度
溶液加入等体积的未知浓度的稀盐酸,溶液恰好呈中性,则所加稀盐酸的物质的量浓度 (用含a的式子表示)。
(用含a的式子表示)。II.
 是一种液态化合物,在盛有10mL水的锥形瓶中,小心地滴加8——10滴
是一种液态化合物,在盛有10mL水的锥形瓶中,小心地滴加8——10滴 ,发生剧烈反应,液面上有白色酸雾形成,产生有刺激性气味的气体,该气体可使湿润的品红试纸褪色。
,发生剧烈反应,液面上有白色酸雾形成,产生有刺激性气味的气体,该气体可使湿润的品红试纸褪色。(6)则
 和水反应的化学方程式为:
和水反应的化学方程式为:(7)若将
 溶液直接蒸干得不到无水
溶液直接蒸干得不到无水 ,用
,用 与
与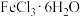 混合共热,则可得到无水
混合共热,则可得到无水 ,其原因是
,其原因是
您最近一年使用:0次
2022-02-04更新
|
395次组卷
|
2卷引用:黑龙江省大庆中学2021-2022学年高二下学期开学考试化学试题
解题方法
9 . 生活中常用到酸和碱,根据所学知识回答下列问题:(以下所有溶液均处于常温下)
(1)现有0.01 mol·L-1的CH3COOH和0.01 mol·L-1的NH3·H2O两种溶液。[已知Ka(CH3COOH)=1.6×10-5,Kb(NH3·H2O)=1.6×10-5,lg2=0.3]
①NH3·H2O的电离方程式为___________ 。
②0.01 mol·L-1的NH3·H2O的pH=___________ 。
③若上述酸和碱等体积充分混合,混合后所得溶液的pH___________ (填“>”、“<”或“=”)7,此时溶液中各离子浓度由大到小的顺序为___________ 。
(2)甲酸钠(HCOONa)属于_______ (填“强”或“弱”)电解质,HCOONa溶液呈碱性的原因是_________ (用离子方程式表示)。0.01 mol·L-1的HCOONa溶液中c(HCOO-)+c(OH-)-c(H+)=_______ mol·L-1。
(1)现有0.01 mol·L-1的CH3COOH和0.01 mol·L-1的NH3·H2O两种溶液。[已知Ka(CH3COOH)=1.6×10-5,Kb(NH3·H2O)=1.6×10-5,lg2=0.3]
①NH3·H2O的电离方程式为
②0.01 mol·L-1的NH3·H2O的pH=
③若上述酸和碱等体积充分混合,混合后所得溶液的pH
(2)甲酸钠(HCOONa)属于
您最近一年使用:0次
2022-01-10更新
|
493次组卷
|
7卷引用:黑龙江省齐齐哈尔市三立高级中学2021-2022学年高二下学期开学考试化学试题
黑龙江省齐齐哈尔市三立高级中学2021-2022学年高二下学期开学考试化学试题湖南省百所名校大联考2021-2022学年高二上学期期中考试化学试题辽宁省葫芦岛市协作校2021-2022学年高三上学期第二次联考化学试题河北金太阳2021-2022学年高二上学期期中联考化学试题重庆市九校联盟2021-2022学年高二上学期12月联考化学试题陕西省榆林市2021-2022学年高二上学期期末考试化学试题(已下线)解密10 水溶液中的离子平衡(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)
名校
10 . 研究弱电解质的电离,有重要的实际意义。
Ⅰ.有机酸醋酸
(1)保持温度不变,向醋酸溶液中通入一定量的氨气,下列量将变小的是___________。
(2)将0.1 mol∙L−1CH3COOH溶液加水稀释,c(CH3COO-)/c(CH3COOH)的比值将___________ (填“变大”、“不变”或“变小”)。
Ⅱ.对比弱酸酸性相对强弱
(3)某些弱酸在25℃时的电离常数如下:
①下列反应可以发生的是___________ (填字母)。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.NaHCO3+HCN=NaCN+H2O+CO2↑
②将20mL 1 mol∙L−1 CH3COOH溶液和20mL 1 mol∙L−1HSCN溶液分别与20mL 1 mol∙L−1 NaHCO3溶液混合,画出产生的CO2气体体积(V)随时间(t)的变化关系图,并注明对应酸的化学式 ___________ 。

Ⅰ.有机酸醋酸
(1)保持温度不变,向醋酸溶液中通入一定量的氨气,下列量将变小的是___________。
| A.c(CH3COO-) | B.c(H+) |
| C.c(OH-) | D.CH3COOH电离平衡常数 |
Ⅱ.对比弱酸酸性相对强弱
(3)某些弱酸在25℃时的电离常数如下:
| 化学式 | CH3COOH | HSCN | HCN | HClO | H2CO3 |
| 电离常数 |  | 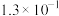 |  |  | 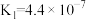 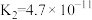 |
①下列反应可以发生的是
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
D.NaHCO3+HCN=NaCN+H2O+CO2↑
②将20mL 1 mol∙L−1 CH3COOH溶液和20mL 1 mol∙L−1HSCN溶液分别与20mL 1 mol∙L−1 NaHCO3溶液混合,画出产生的CO2气体体积(V)随时间(t)的变化关系图,并注明

您最近一年使用:0次
2021-12-24更新
|
646次组卷
|
3卷引用:黑龙江省齐齐哈尔市三立高级中学2021-2022学年高二下学期开学考试化学试题
黑龙江省齐齐哈尔市三立高级中学2021-2022学年高二下学期开学考试化学试题北京师范大学附属中学2021-2022学年高二上学期期中考试化学试题(已下线)3.1.2 电离平衡常数-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)



