名校
1 . 电解质水溶液中存在电离平衡,水解平衡、沉淀溶解平衡。请回答下列问题:
(1)常温下,部分弱酸的电离平衡常数如表:
①等浓度 、
、 、
、 和
和 溶液中,碱性最强的是
溶液中,碱性最强的是___________ (写化学式)。
②等浓度的 与
与 混合溶液中离子浓度由大到小的顺序为
混合溶液中离子浓度由大到小的顺序为___________ 。
(2)室温下,用 盐酸溶液滴定
盐酸溶液滴定 氨水溶液,滴定曲线如图所示。
氨水溶液,滴定曲线如图所示。___________ (填“甲基橙”或“酚酞”)作指示剂。
②室温下, 氨水溶液中
氨水溶液中 的电离平衡常数约为
的电离平衡常数约为___________ 
③b点所示的溶液中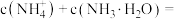
___________ (用溶液的其它离子浓度表示)。
(3)工业上向锅炉里注入所得到的 溶液浸泡,将水垢中的
溶液浸泡,将水垢中的 转化为
转化为 ,写出该反应的离子方程式:
,写出该反应的离子方程式:___________ 。当把水垢中 完全转化时,混合溶液中的
完全转化时,混合溶液中的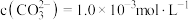 ,则
,则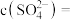
___________  (保留小数点后一位)。
(保留小数点后一位)。
已知: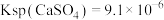 ,
,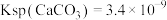
(1)常温下,部分弱酸的电离平衡常数如表:
| 弱酸 |  |  |  |
| 电离平衡常数 | 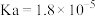 | 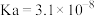 | 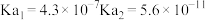 |
 、
、 、
、 和
和 溶液中,碱性最强的是
溶液中,碱性最强的是②等浓度的
 与
与 混合溶液中离子浓度由大到小的顺序为
混合溶液中离子浓度由大到小的顺序为(2)室温下,用
 盐酸溶液滴定
盐酸溶液滴定 氨水溶液,滴定曲线如图所示。
氨水溶液,滴定曲线如图所示。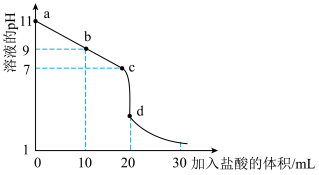
②室温下,
 氨水溶液中
氨水溶液中 的电离平衡常数约为
的电离平衡常数约为
③b点所示的溶液中
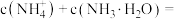
(3)工业上向锅炉里注入所得到的
 溶液浸泡,将水垢中的
溶液浸泡,将水垢中的 转化为
转化为 ,写出该反应的离子方程式:
,写出该反应的离子方程式: 完全转化时,混合溶液中的
完全转化时,混合溶液中的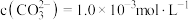 ,则
,则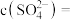
 (保留小数点后一位)。
(保留小数点后一位)。已知:
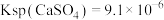 ,
,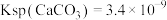
您最近一年使用:0次
2024-02-22更新
|
65次组卷
|
2卷引用:江西省上饶市第一中学2023-2024学年高二下学期开学考试化学试题
2 . 已知:25 ℃时,CH3COOH和NH3·H2O的电离常数相等。
(1)25 ℃时,取10 mL 0.1 mol·L-1醋酸溶液测得其pH=3。
①将上述(1)溶液加水稀释至1 000 mL溶液中c(CH3COO-)/[c(CH3COOH)·c(OH-)]___________ (填“增大”“减小”“不变”或“不能确定”)。
②25 ℃时,0.1 mol·L-1氨水(NH3·H2O溶液)的pH=___________ 。用pH试纸测定该氨水pH的操作方法为___________ 。
(2)25 ℃时,现向10 mL 0.1 mol·L-1氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中c(NH )/c(NH3.H2O)
)/c(NH3.H2O)___________ (填序号)。
a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(3)某温度下,向V1mL 0.1 mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=-lgc(OH-)。

图中M、Q、N三点所示溶液呈中性的点是___________ (填字母)。
(1)25 ℃时,取10 mL 0.1 mol·L-1醋酸溶液测得其pH=3。
①将上述(1)溶液加水稀释至1 000 mL溶液中c(CH3COO-)/[c(CH3COOH)·c(OH-)]
②25 ℃时,0.1 mol·L-1氨水(NH3·H2O溶液)的pH=
(2)25 ℃时,现向10 mL 0.1 mol·L-1氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中c(NH
 )/c(NH3.H2O)
)/c(NH3.H2O)a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(3)某温度下,向V1mL 0.1 mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=-lgc(OH-)。

图中M、Q、N三点所示溶液呈中性的点是
您最近一年使用:0次
3 . 按要求完成下列问题。
(1)25°C时,pH试纸测得0.1 mol/L醋酸溶液的pH约为3,则估算出醋酸的电离常数约为___________ ; 向10 mL此溶液中加水稀释的 值将
值将___________ (填“增大”、“减小”或“无法确定”)
(2)常温下,已知H2A为二元弱酸,溶液M由20 mLl mol·L-1NaHA溶液与20 mL 1mol·L-1NaOH溶液等体积混合而得,则溶液M的pH___________ 7(填“>”“<”或“=”), 溶液M中各微粒的浓度关系正确的是___________ 。
A. c(A2-)+c(HA-)+c(OH-)=c(Na+ )+c(H+)
B. c(HA-)+c(H2A)+c(H+)=c(OH-)
C. c(A2-)+c(HA-)+c(H2A)=lmol·L-l
D. c(Na+)> c(A2-)> c(OH-)>c(H+)
(1)25°C时,pH试纸测得0.1 mol/L醋酸溶液的pH约为3,则估算出醋酸的电离常数约为
 值将
值将(2)常温下,已知H2A为二元弱酸,溶液M由20 mLl mol·L-1NaHA溶液与20 mL 1mol·L-1NaOH溶液等体积混合而得,则溶液M的pH
A. c(A2-)+c(HA-)+c(OH-)=c(Na+ )+c(H+)
B. c(HA-)+c(H2A)+c(H+)=c(OH-)
C. c(A2-)+c(HA-)+c(H2A)=lmol·L-l
D. c(Na+)> c(A2-)> c(OH-)>c(H+)
您最近一年使用:0次
名校
4 . 回答下列问题:
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。
①Na2CO3俗称纯碱,因 水解而使其水溶液呈碱性,试写出
水解而使其水溶液呈碱性,试写出 水解的离子方程式(忽略第二步水解):
水解的离子方程式(忽略第二步水解):____ 。
②已知25℃时, 的水解常数Kh=2×10-4,则当Na2CO3溶液中c(
的水解常数Kh=2×10-4,则当Na2CO3溶液中c( ):c(
):c( )=2:1时,试求该溶液的pH=
)=2:1时,试求该溶液的pH=____ 。
③0.1mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=____ [用含c( )、c(H2CO3)的关系式表示]。
)、c(H2CO3)的关系式表示]。
④向Na2CO3溶液中加入明矾会产生沉淀和气体,请写出相关的离子方程式:____ 。
(2)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2molNaOH的水溶液与0.2molNO2恰好完全反应得1L溶液A,溶液B为0.1mol•L-1的CH3COONa溶液,则两溶液中c( )、c(
)、c( )和c(CH3COO-)由大到小的顺序为
)和c(CH3COO-)由大到小的顺序为____ (已知:HNO2的电离常数Ka=7.1×10-4mol•L-1,CH3COOH的电离常数Ka=1.7×10-5mol•L-1,可使溶液A和溶液B的pH相等的方法是____ (填选项字母)。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。
①Na2CO3俗称纯碱,因
 水解而使其水溶液呈碱性,试写出
水解而使其水溶液呈碱性,试写出 水解的离子方程式(忽略第二步水解):
水解的离子方程式(忽略第二步水解):②已知25℃时,
 的水解常数Kh=2×10-4,则当Na2CO3溶液中c(
的水解常数Kh=2×10-4,则当Na2CO3溶液中c( ):c(
):c( )=2:1时,试求该溶液的pH=
)=2:1时,试求该溶液的pH=③0.1mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=
 )、c(H2CO3)的关系式表示]。
)、c(H2CO3)的关系式表示]。④向Na2CO3溶液中加入明矾会产生沉淀和气体,请写出相关的离子方程式:
(2)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2molNaOH的水溶液与0.2molNO2恰好完全反应得1L溶液A,溶液B为0.1mol•L-1的CH3COONa溶液,则两溶液中c(
 )、c(
)、c( )和c(CH3COO-)由大到小的顺序为
)和c(CH3COO-)由大到小的顺序为a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
您最近一年使用:0次
名校
解题方法
5 . Ⅰ.已知:在相同条件下醋酸与氨水电离程度相同,现有浓度均为0.1mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵、⑧氨水。
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是 填序号
填序号
____ 。
(2)若④、⑤、⑥、⑦、⑧五种溶液中NH 浓度相等,则五种溶液的物质的量浓度由大到小的顺序是
浓度相等,则五种溶液的物质的量浓度由大到小的顺序是 填序号
填序号
___ 。
Ⅱ 已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
(3)pH相等的下列溶液,它们的物质的量浓度由大到小排列的顺序是____ (用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(4)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:____ 。
(5)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=____ (填准确数值 。
。
(6)25℃时,将amol•L-1的醋酸与bmol•L-1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为____ 。
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是
 填序号
填序号
(2)若④、⑤、⑥、⑦、⑧五种溶液中NH
 浓度相等,则五种溶液的物质的量浓度由大到小的顺序是
浓度相等,则五种溶液的物质的量浓度由大到小的顺序是 填序号
填序号
Ⅱ
 已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4,.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(4)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:
(5)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=
 。
。(6)25℃时,将amol•L-1的醋酸与bmol•L-1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为
您最近一年使用:0次
2022-03-29更新
|
223次组卷
|
2卷引用:江西省宜春市铜鼓中学2021-2022学年高二下学期开学考化学试题
名校
6 . 25℃时,有关物质的电离平衡常数如下:
(1)体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者___________ 后者(填“>”、“<”或“=”);
(2)25℃时,pH之和为14的CH3COOH溶液与NaOH溶液混合,充分反应后溶液显中性,则所耗溶液的体积前者___________ 后者(填“>”、“<”或“=”);
(3)若用NaOH标准溶液滴定未知浓度的醋酸,选择的指示剂应为___________ ;
(4)下列离子CH3COO-、 、
、 、
、 、
、 在溶液中结合H+的能力由大到小的顺序为
在溶液中结合H+的能力由大到小的顺序为___________ 。
| 化学式 | CH3COOH | H2CO3 | H2SO3 |
| 电离平衡常数K | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(2)25℃时,pH之和为14的CH3COOH溶液与NaOH溶液混合,充分反应后溶液显中性,则所耗溶液的体积前者
(3)若用NaOH标准溶液滴定未知浓度的醋酸,选择的指示剂应为
(4)下列离子CH3COO-、
 、
、 、
、 、
、 在溶液中结合H+的能力由大到小的顺序为
在溶液中结合H+的能力由大到小的顺序为
您最近一年使用:0次
2022-02-18更新
|
85次组卷
|
2卷引用:江西省峡江中学2021-2022学年高二上学期第一次月考化学(理科)试题
7 . 水是生命的源泉、工业的血液、城市的命脉。河水是主要的饮用水源,污染物通过饮用水可宵接毒害人体,也可通过食物链和灌溉农田间接危及健康。请回答下列问题:
(1)纯水在100℃时,pH=6,该温度下1mol·L-1的NaOH溶液中,由水电离出的c(OH-)=_____ mol·L-1。
(2)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为___________ 。
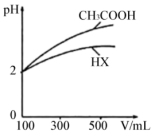
(3)体积均为100mLpH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则相同温度时,HX的电离平衡常数___________ (填“大于”或“小于”或“等于”)CH3COOH的电离平衡常数,理由是___________ 。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
①25℃时,有等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,三种溶液的pH由大到小的顺序为___________ 。
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为___________ 。
(5)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=___________ mol·L-1(填精确值)。
(1)纯水在100℃时,pH=6,该温度下1mol·L-1的NaOH溶液中,由水电离出的c(OH-)=
(2)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为
(3)体积均为100mLpH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则相同温度时,HX的电离平衡常数

(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为
(5)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=
您最近一年使用:0次
2021-12-25更新
|
358次组卷
|
7卷引用:江西省赣州市信丰中学2021-2022学年高二下学期A+班段考化学试题
江西省赣州市信丰中学2021-2022学年高二下学期A+班段考化学试题江西省吉安市2021-2022学年高二上学期期末教学质量检测化学试题河南省洛阳市2019-2020学年高二上学期期末考试化学试题(已下线)3.2.1 水的电离 溶液的酸碱性与pH 练习-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)山东省2021-2022学年高二12月“山东学情”联考(鲁科版)化学试题甘肃省白银市白银区大成学校2022-2023学年高二下学期开学考试(上期末)化学试题四川省江油市太白中学2023-2024学年高二下学期开学考试化学试题
8 . 25℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)CH3COOH、H2CO3、HClO、HCN的酸性由强到弱的顺序_____ 。
(2)向NaCN中通入少量的CO2,发生反应的离子方程式为_____ 。
(3)取0.10molCH3COOH(冰醋酸)作导电性实验,测得其平衡时的导电率随加入的水量变化如图所示:

①常温下,b点醋酸溶液的浓度约为0.02mol⋅L-1,该溶液中的CH3COOH的电离度为_____ ,若使此溶液中CH3COOH的电离程度增大且c(H+)也增大的方法是_____ 。
②从图象可知,在一定浓度的醋酸溶液中加水,c(CH3COO-)_____ (填“增大”,“减小”或“不确定”)。
③若实验测得c点处溶液中c(CH3COOH)=amol⋅L-1,c(CH3COO-)=bmol⋅L-1,则该条件下CH3COOH的电离常数Ka=_____ 。(用含a、b的代数式表示)
④H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分别与不同质量的锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是_____ (填写序号)。
a.反应所需要的时间:B>A b.开始反应时的速率:A>B
c.参加反应的锌物质的量:A=B d.A中有锌剩余
| 化学式 | CH3COOH | H2CO3 | HClO | HCN |
| 电离平衡常数(Ka) | 1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | 3.0×10-8 | 5.0×10-10 |
(1)CH3COOH、H2CO3、HClO、HCN的酸性由强到弱的顺序
(2)向NaCN中通入少量的CO2,发生反应的离子方程式为
(3)取0.10molCH3COOH(冰醋酸)作导电性实验,测得其平衡时的导电率随加入的水量变化如图所示:

①常温下,b点醋酸溶液的浓度约为0.02mol⋅L-1,该溶液中的CH3COOH的电离度为
②从图象可知,在一定浓度的醋酸溶液中加水,c(CH3COO-)
③若实验测得c点处溶液中c(CH3COOH)=amol⋅L-1,c(CH3COO-)=bmol⋅L-1,则该条件下CH3COOH的电离常数Ka=
④H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分别与不同质量的锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是
a.反应所需要的时间:B>A b.开始反应时的速率:A>B
c.参加反应的锌物质的量:A=B d.A中有锌剩余
您最近一年使用:0次
2021-06-24更新
|
861次组卷
|
4卷引用:江西省赣州市赣县第三中学2021-2022学年高二上学期9月考试化学试题
江西省赣州市赣县第三中学2021-2022学年高二上学期9月考试化学试题陕西省西安市高新一中2020-2021学年高一下学期5月月考化学试题(已下线)第15讲 电离平衡常数-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)湖北省荆州市沙市中学2022-2023学年高二上学期11月期中考试化学试题
9 . 25℃时,三种酸的电离平衡常数如表所示。
回答下列问题:
(1)浓度均为0.1mol/L的CH3COOH,HClO,H3PO3溶液中,c(H+)最小的是___ 。
(2)亚磷酸(H3PO3)为二元酸,具有较强的还原性Na2HPO3是___ (填“酸式盐”“碱式盐”或“正盐”)。H3PO3的第二级电离方程式为___ 。此时的电离平衡常数表达式K=___ 。
(3)常温下,0.1mol/L的CH3COOH溶液加水稀释的过程中,下列表达式的数值变大的是___ (填字母)。
A.c(H+) B. C.c(CH3COO-) D.c(CH3COOH)
C.c(CH3COO-) D.c(CH3COOH)
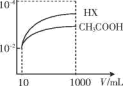
(4)体积均为10mL、c(H+)均为10-2mol/L的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中c(H+)的变化如图所示测HX的电离平衡常数___ (填“大于”、“小于”或“等于”)醋酸的电离平衡常数,理由是___ 。
| 化学式 | CH3COOH | HClO | H3PO3 |
| 名称 | 醋酸 | 次氯酸 | 亚磷酸 |
| 电离平衡常数 | 1.8×10-5 | 3.0×10-8 | Ki=8.3×10-3 K2=5.6×10-6 |
回答下列问题:
(1)浓度均为0.1mol/L的CH3COOH,HClO,H3PO3溶液中,c(H+)最小的是
(2)亚磷酸(H3PO3)为二元酸,具有较强的还原性Na2HPO3是
(3)常温下,0.1mol/L的CH3COOH溶液加水稀释的过程中,下列表达式的数值变大的是
A.c(H+) B.
 C.c(CH3COO-) D.c(CH3COOH)
C.c(CH3COO-) D.c(CH3COOH)(4)体积均为10mL、c(H+)均为10-2mol/L的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中c(H+)的变化如图所示测HX的电离平衡常数

您最近一年使用:0次
2021-06-14更新
|
1026次组卷
|
4卷引用:江西省兴国县将军中学2021-2022学年高二上学期10月月考化学试题
江西省兴国县将军中学2021-2022学年高二上学期10月月考化学试题青海省海南州贵德高级中学2020-2021学年高二下学期期中化学试题(已下线)3.1.2 电离平衡常数-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)3.1.2 电离平衡常数(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)
名校
解题方法
10 . (1)用0.1 mol·L-1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。

①滴定醋酸的曲线是___ (填“Ⅰ”或“Ⅱ”)。
②V1和V2的关系:V1__ V2(填“>”、“=”或“<”)。
(2)25℃时,a mol·L-1的醋酸与0.01 mol·L-1的氢氧化钠溶液等体积混合后呈中性,则醋酸的电离常数为___ (用含a的代数式表示)。
(3)曲线I中pH=7时各离子浓度大小的关系为___ 。

①滴定醋酸的曲线是
②V1和V2的关系:V1
(2)25℃时,a mol·L-1的醋酸与0.01 mol·L-1的氢氧化钠溶液等体积混合后呈中性,则醋酸的电离常数为
(3)曲线I中pH=7时各离子浓度大小的关系为
您最近一年使用:0次



