1 . 水溶液中的离子反应与我们的生产、生活等息息相关。回答下列问题:
(1) 时,
时, ,在该温度下,测得
,在该温度下,测得 的
的 溶液
溶液 。
。
① 在水溶液中的电离方程式为
在水溶液中的电离方程式为______ 。
②体积相等, 相同的盐酸与
相同的盐酸与 溶液分别与足量的
溶液分别与足量的 反应,与盐酸相比,
反应,与盐酸相比, 溶液产生的
溶液产生的
______ (填“多”“少”或“一样多”)。
(2)将 的
的 溶液与
溶液与 的
的 溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液中
溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液中 。
。
①混合溶液中
______ (填“>”“<”或“=”,下同) 。
。
②混合溶液中
______  。
。
(3)已知在常温下常见弱酸的电离平衡常数Ka如表所示:
①写出 溶液与少量
溶液与少量 溶液反应的离子方程式:
溶液反应的离子方程式:______ 。
②若将体积相同,浓度均为 的盐酸和
的盐酸和 溶液,分别加水稀释10倍,溶液的
溶液,分别加水稀释10倍,溶液的 分别变为m,n,则m和n的大小关系为
分别变为m,n,则m和n的大小关系为______ 。
(4)已知常温下, ,向
,向 溶液中加入等体积
溶液中加入等体积 的稀盐酸,混合后溶液中的
的稀盐酸,混合后溶液中的
______  。
。
(1)
 时,
时, ,在该温度下,测得
,在该温度下,测得 的
的 溶液
溶液 。
。①
 在水溶液中的电离方程式为
在水溶液中的电离方程式为②体积相等,
 相同的盐酸与
相同的盐酸与 溶液分别与足量的
溶液分别与足量的 反应,与盐酸相比,
反应,与盐酸相比, 溶液产生的
溶液产生的
(2)将
 的
的 溶液与
溶液与 的
的 溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液中
溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液中 。
。①混合溶液中

 。
。②混合溶液中

 。
。(3)已知在常温下常见弱酸的电离平衡常数Ka如表所示:
弱酸 | HCOOH | H2C2O4 |
| 电离平衡常数K | 1.8×10-4 | Ka1=5.9×10-2,Ka26.4×10-5 |
 溶液与少量
溶液与少量 溶液反应的离子方程式:
溶液反应的离子方程式:②若将体积相同,浓度均为
 的盐酸和
的盐酸和 溶液,分别加水稀释10倍,溶液的
溶液,分别加水稀释10倍,溶液的 分别变为m,n,则m和n的大小关系为
分别变为m,n,则m和n的大小关系为(4)已知常温下,
 ,向
,向 溶液中加入等体积
溶液中加入等体积 的稀盐酸,混合后溶液中的
的稀盐酸,混合后溶液中的
 。
。
您最近一年使用:0次
2 . 硼及其化合物在制造、化工等领域都有广泛应用,回答下列问题:
(1)基态硼原子的价电子排布图为__________ ,其占据最高能级电子的电子云轮廓图形状为__________ ,基态硼原子比基态氮原子的第一电离能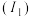 小,其原因为
小,其原因为__________ 。
(2) 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得:
反应制得:
① 由
由 和
和 构成,
构成, 的空间结构为
的空间结构为__________ 。
② 中B原子的杂化轨道类型为
中B原子的杂化轨道类型为__________ 。
③ 的键角为
的键角为__________ 。
(3)写出B与 溶液反应的离子方程式:
溶液反应的离子方程式:__________ 。
(4) 为一元弱酸[常温下,
为一元弱酸[常温下,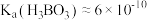 ]:
]:
① 与
与 溶液反应的离子方程式为
溶液反应的离子方程式为__________ 。
②常温下, 的硼酸的pH约为
的硼酸的pH约为__________ (已知: ,
, )。
)。
(1)基态硼原子的价电子排布图为
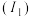 小,其原因为
小,其原因为(2)
 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得:
反应制得:①
 由
由 和
和 构成,
构成, 的空间结构为
的空间结构为②
 中B原子的杂化轨道类型为
中B原子的杂化轨道类型为③
 的键角为
的键角为(3)写出B与
 溶液反应的离子方程式:
溶液反应的离子方程式:(4)
 为一元弱酸[常温下,
为一元弱酸[常温下,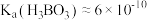 ]:
]:①
 与
与 溶液反应的离子方程式为
溶液反应的离子方程式为②常温下,
 的硼酸的pH约为
的硼酸的pH约为 ,
, )。
)。
您最近一年使用:0次
2024-03-07更新
|
128次组卷
|
2卷引用:河南省许平汝名校2023-2024学年高二下学期开学化学试题
3 . 已知,常温下,碳酸和草酸的电离常数 、
、 如下表所示:
如下表所示:
已知: 、
、
(1)常温下,在浓度均为 的四种溶液中:①
的四种溶液中:① 、②
、② 、③
、③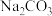 、④
、④ ,溶液中水的电离受到抑制的是
,溶液中水的电离受到抑制的是_______ (填序号,下同),溶液的 最大的是
最大的是_______ 。
(2)常温下, 草酸溶液中
草酸溶液中 、
、 、
、 的物质的量分数
的物质的量分数 随溶液
随溶液 的变化关系如图1所示[已知:
的变化关系如图1所示[已知: ],
], 或
或 与混合滂液的
与混合滂液的 的变化关系如图2所示:
的变化关系如图2所示:

①图1中的
_______ 。
②图2中直线ef纵坐标代表的是_______ [填“ ”或“
”或“ ”],其中
”],其中 点纵坐标的值为
点纵坐标的值为_______ 。
 、
、 如下表所示:
如下表所示:| 二元弱酸 |  |  |
 (简写 (简写 ) ) |  |  |
 (简写 (简写 ) ) | 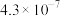 | 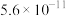 |
 、
、
(1)常温下,在浓度均为
 的四种溶液中:①
的四种溶液中:① 、②
、② 、③
、③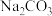 、④
、④ ,溶液中水的电离受到抑制的是
,溶液中水的电离受到抑制的是 最大的是
最大的是(2)常温下,
 草酸溶液中
草酸溶液中 、
、 、
、 的物质的量分数
的物质的量分数 随溶液
随溶液 的变化关系如图1所示[已知:
的变化关系如图1所示[已知: ],
], 或
或 与混合滂液的
与混合滂液的 的变化关系如图2所示:
的变化关系如图2所示:
①图1中的

②图2中直线ef纵坐标代表的是
 ”或“
”或“ ”],其中
”],其中 点纵坐标的值为
点纵坐标的值为
您最近一年使用:0次
4 . 常温下,一元酸HA的 。有两种
。有两种 [溶液中
[溶液中 ]相同,pH分别为7和4的溶液Ⅰ和Ⅱ。回答下列问题:
]相同,pH分别为7和4的溶液Ⅰ和Ⅱ。回答下列问题:
(1)溶液Ⅰ中
___________ (填“>”“=”或“<”)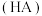 ,判断理由是
,判断理由是___________ 。
(2)已知HA的电离度 ,溶液Ⅱ中
,溶液Ⅱ中
___________ 。
(3)若做如图所示的实验,其中 、
、 与
与 等离子不能穿过隔膜,只有未电离的HA可自由穿过该隔膜。
等离子不能穿过隔膜,只有未电离的HA可自由穿过该隔膜。

当达到平衡时,溶液Ⅰ和Ⅱ中的pH分别___________ 、___________ (填“增大”“减小”或“不变”),说明理由:___________ 。
 。有两种
。有两种 [溶液中
[溶液中 ]相同,pH分别为7和4的溶液Ⅰ和Ⅱ。回答下列问题:
]相同,pH分别为7和4的溶液Ⅰ和Ⅱ。回答下列问题:(1)溶液Ⅰ中

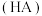 ,判断理由是
,判断理由是(2)已知HA的电离度
 ,溶液Ⅱ中
,溶液Ⅱ中
(3)若做如图所示的实验,其中
 、
、 与
与 等离子不能穿过隔膜,只有未电离的HA可自由穿过该隔膜。
等离子不能穿过隔膜,只有未电离的HA可自由穿过该隔膜。
当达到平衡时,溶液Ⅰ和Ⅱ中的pH分别
您最近一年使用:0次
名校
5 . 乙二酸( 或HOOCCOOH)俗称草酸,是一种二元弱酸,在工业上可作漂白剂、鞣革剂,在实验研究和化学工业中应用广泛。
或HOOCCOOH)俗称草酸,是一种二元弱酸,在工业上可作漂白剂、鞣革剂,在实验研究和化学工业中应用广泛。
(1)草酸第一步电离的电离方程式为___________________________ 。
(2)草酸可用来测定未知浓度的 溶液(用草酸滴定
溶液(用草酸滴定 溶液)。
溶液)。
①实验过程中,草酸应用___________ (填“酸式”或“碱式”)滴定管盛装。
②判断达到滴定终点时的现象为_______________________________________________________ 。
③若滴定完成后仰视读数,则测得的 溶液浓度
溶液浓度___________ (“偏高”、“偏低”或“无影响”)。
(3)常温下,草酸溶液中微粒的物质的量分数随溶液pH的变化如图所示:
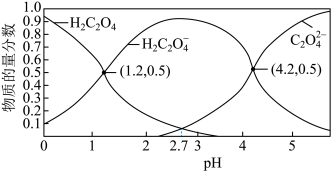
已知:常温下, 的电离平衡常数
的电离平衡常数 ,
, 。
。
①常温下,草酸的电离平衡常数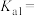
___________ 。
②相同条件下,物质的量浓度均为0.1 的
的 溶液的pH比
溶液的pH比 溶液的pH
溶液的pH__________ (填“大”或“小”)。
③常温下,向10mL 0.1
 溶液中逐滴加入0.1
溶液中逐滴加入0.1 KOH溶液,随着KOH溶液体积的增加,当溶液中
KOH溶液,随着KOH溶液体积的增加,当溶液中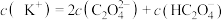 时,加入的V(KOH溶液)
时,加入的V(KOH溶液)___________ (填“>”、“=”或“<”)10mL,若加入KOH溶液体积为10mL溶液中 、
、 、
、 的浓度由大到小的顺序为
的浓度由大到小的顺序为________________________ 。
 或HOOCCOOH)俗称草酸,是一种二元弱酸,在工业上可作漂白剂、鞣革剂,在实验研究和化学工业中应用广泛。
或HOOCCOOH)俗称草酸,是一种二元弱酸,在工业上可作漂白剂、鞣革剂,在实验研究和化学工业中应用广泛。(1)草酸第一步电离的电离方程式为
(2)草酸可用来测定未知浓度的
 溶液(用草酸滴定
溶液(用草酸滴定 溶液)。
溶液)。①实验过程中,草酸应用
②判断达到滴定终点时的现象为
③若滴定完成后仰视读数,则测得的
 溶液浓度
溶液浓度(3)常温下,草酸溶液中微粒的物质的量分数随溶液pH的变化如图所示:

已知:常温下,
 的电离平衡常数
的电离平衡常数 ,
, 。
。①常温下,草酸的电离平衡常数
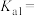
②相同条件下,物质的量浓度均为0.1
 的
的 溶液的pH比
溶液的pH比 溶液的pH
溶液的pH③常温下,向10mL 0.1

 溶液中逐滴加入0.1
溶液中逐滴加入0.1 KOH溶液,随着KOH溶液体积的增加,当溶液中
KOH溶液,随着KOH溶液体积的增加,当溶液中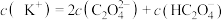 时,加入的V(KOH溶液)
时,加入的V(KOH溶液) 、
、 、
、 的浓度由大到小的顺序为
的浓度由大到小的顺序为
您最近一年使用:0次
2023-02-11更新
|
188次组卷
|
2卷引用:河南省名校2022-2023学年高二下学期开学考试化学试题
6 . 已知25℃时:H2CO3:Ka1=4.5×10-7、Ka2=4.7×10-11;HClO:Ka=4.0×10-8、lg2=0.3;Ksp(BaSO4)=1.0×10-10、Ksp(BaCO3)=2.6×10-9。
(1)0.4 mol/LHClO溶液的pH=_______ 。
(2)0.4 mol/LNaClO溶液的pH=_______ 。向该溶液中通入少量CO2,发生反应的离子方程式为_______ 。
(3)1.0 L水中投入0.1 mol BaSO4,得到BaSO4的悬浊液,向该悬浊液中投入Na2CO3固体使BaSO4全部转化为BaCO3,理论上需Na2CO3_______ mol(忽略过程中溶液体积的变化)。
(1)0.4 mol/LHClO溶液的pH=
(2)0.4 mol/LNaClO溶液的pH=
(3)1.0 L水中投入0.1 mol BaSO4,得到BaSO4的悬浊液,向该悬浊液中投入Na2CO3固体使BaSO4全部转化为BaCO3,理论上需Na2CO3
您最近一年使用:0次
7 . 水溶液中的离子平衡是以化学平衡理论为基础的进一步探究。
(1)常温下,等体积的0.10mol/L氨水与0.10mol/L烧碱溶液相比,c(OH-)的大小关系为前者_____ 后者(填“大于”“等于”或“小于”,下同);常温下,pH均为5的氯化铵溶液与盐酸相比,溶液中水的电离程度前者_____ 后者,两者均稀释10倍,pH的大小关系为前者_____ 后者。
(2)醋酸钠溶液呈碱性,其原因是_____ (用离子方程式表示)。
(3)常温下,Ksp(FeS)=6.3×10-18、Ksp(CuS)=1.3×10-36,则FeS的溶解度_____ CuS的溶解度(填“大于”“等于”或“小于”);在处理含有Cu2+的污水时,可向其中加入FeS固体作为沉淀剂,FeS逐渐溶解,Cu2+转化为CuS沉淀,用沉淀溶解平衡原理解释其原因为_____ 。
(1)常温下,等体积的0.10mol/L氨水与0.10mol/L烧碱溶液相比,c(OH-)的大小关系为前者
(2)醋酸钠溶液呈碱性,其原因是
(3)常温下,Ksp(FeS)=6.3×10-18、Ksp(CuS)=1.3×10-36,则FeS的溶解度
您最近一年使用:0次
2023-01-07更新
|
123次组卷
|
2卷引用:2021年河南省普通高中学生学业水平考试化学试题
名校
8 . 回答下列问题:
(1) 时,
时, 的
的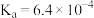 ,则此温度下
,则此温度下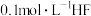 溶液的
溶液的 为
为_______  。
。
(2) 时,
时,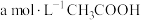 溶液的
溶液的 ,用含a和b的代数式表示
,用含a和b的代数式表示 的电离平衡常数
的电离平衡常数
_______ 。
(3)硒酸( )在水溶液中的电离如下:
)在水溶液中的电离如下: 。向
。向 溶液中滴加少量氨水,该反应的离子方程式为
溶液中滴加少量氨水,该反应的离子方程式为_______ 。
(4)已知 时,
时,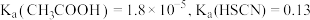 。现在该温度下将
。现在该温度下将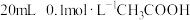 溶液和
溶液和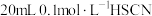 溶液分别与
溶液分别与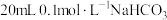 溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示,反应初始阶段,两种溶液产生
溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示,反应初始阶段,两种溶液产生 气体的速率存在明显差异的原因是
气体的速率存在明显差异的原因是_______ 。

(5)已知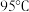 时的
时的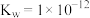 ,将
,将 的
的 溶液与
溶液与 的
的 溶液混合,若所得
溶液混合,若所得 ,则
,则 溶液与
溶液与 溶液的体积比为
溶液的体积比为_______ 。
(6)常温下,由水电离出的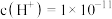 ,则该溶液的
,则该溶液的 为
为_______ 。
(1)
 时,
时, 的
的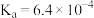 ,则此温度下
,则此温度下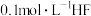 溶液的
溶液的 为
为 。
。(2)
 时,
时,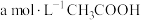 溶液的
溶液的 ,用含a和b的代数式表示
,用含a和b的代数式表示 的电离平衡常数
的电离平衡常数
(3)硒酸(
 )在水溶液中的电离如下:
)在水溶液中的电离如下: 。向
。向 溶液中滴加少量氨水,该反应的离子方程式为
溶液中滴加少量氨水,该反应的离子方程式为(4)已知
 时,
时,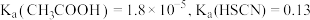 。现在该温度下将
。现在该温度下将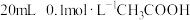 溶液和
溶液和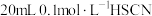 溶液分别与
溶液分别与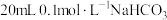 溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示,反应初始阶段,两种溶液产生
溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如图所示,反应初始阶段,两种溶液产生 气体的速率存在明显差异的原因是
气体的速率存在明显差异的原因是
(5)已知
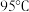 时的
时的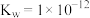 ,将
,将 的
的 溶液与
溶液与 的
的 溶液混合,若所得
溶液混合,若所得 ,则
,则 溶液与
溶液与 溶液的体积比为
溶液的体积比为(6)常温下,由水电离出的
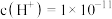 ,则该溶液的
,则该溶液的 为
为
您最近一年使用:0次
名校
9 . 在实验中通常用滴定法测量物质的浓度或进行定量实验。
(1)用氧化还原滴定法测定某样品中草酸的含量。称量草酸H2C2O4样品1.0000g并溶于水,用0.200mol·L-1的酸性KMnO4溶液进行滴定,终点时消耗KMnO4标准溶液20.00mL(假设样品中杂质不与酸性KMnO4溶液反应)。
①滴定过程中发生反应的离子方程式为_______ 。
②滴定时_______ (填“需要”或“不需要”)使用指示剂。
③高锰酸钾溶液用_______ (填“酸式”或“碱式”)滴定管盛放。
④样品中草酸的质量分数是_______ 。
(2)某小组同学为了测定某中性溶液中Cl-的含量,用AgNO3溶液进行滴定。
下列物质能用作指示剂的是_______ (填物质名称)。
①K2CrO4②Na2S ③KI ④KBr
达到滴定终点的实验现象为_______ 。
(3)25° C时,向NaHA溶液中滴入盐酸,混合溶液的pH与粒子浓度变化的关系如图所示,则HA- +H2O H2A+OH-的水解平衡常数为
H2A+OH-的水解平衡常数为_______ 。

(1)用氧化还原滴定法测定某样品中草酸的含量。称量草酸H2C2O4样品1.0000g并溶于水,用0.200mol·L-1的酸性KMnO4溶液进行滴定,终点时消耗KMnO4标准溶液20.00mL(假设样品中杂质不与酸性KMnO4溶液反应)。
①滴定过程中发生反应的离子方程式为
②滴定时
③高锰酸钾溶液用
④样品中草酸的质量分数是
(2)某小组同学为了测定某中性溶液中Cl-的含量,用AgNO3溶液进行滴定。
| 物质 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| Ksp | 2×10-10 | 5.4×10-13 | 8.3×10-17 | 6.3×10-50 | 1.12×10-12 |
| 颜色 | 白色 | 淡黄色 | 黄色 | 黑色 | 砖红色 |
①K2CrO4②Na2S ③KI ④KBr
达到滴定终点的实验现象为
(3)25° C时,向NaHA溶液中滴入盐酸,混合溶液的pH与粒子浓度变化的关系如图所示,则HA- +H2O
 H2A+OH-的水解平衡常数为
H2A+OH-的水解平衡常数为
您最近一年使用:0次
2022-05-04更新
|
201次组卷
|
2卷引用:河南省名校联盟2021-2022学年高二下学期期中考试化学试题
解题方法
10 . 常温下,体积为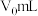 、pH为3的硫氰酸(HSCN)、氢氰酸(HCN)溶液加水稀释后溶液体积为VmL,溶液pH与
、pH为3的硫氰酸(HSCN)、氢氰酸(HCN)溶液加水稀释后溶液体积为VmL,溶液pH与 的关系如图所示。
的关系如图所示。

请回答下列问题:
(1)在水溶液中氢氰酸的电离方程式为_______ 。
(2)根据图象信息,起始浓度:c(HSCN)_______ c(HCN) (填“>”“<”或“=”,下同)。常温下,电离常数:K(HSCN)_______ K(HCN)。
(3)水的电离程度:a点溶液_______ b点溶液(填“>”“<”或“=”,下同),a点溶液中c(SCN-)_______ c点溶液中c(CN-)。
(4)对b点溶液适当加热,下列选项减小的是_______ (填字母)。
A. B.
B. C.
C.
(5)等体积、等pH的上述两种酸的溶液,分别与等物质的量浓度的NaOH溶液恰好完全反应,消耗NaOH溶液较多的酸是_______ (填化学式)。
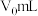 、pH为3的硫氰酸(HSCN)、氢氰酸(HCN)溶液加水稀释后溶液体积为VmL,溶液pH与
、pH为3的硫氰酸(HSCN)、氢氰酸(HCN)溶液加水稀释后溶液体积为VmL,溶液pH与 的关系如图所示。
的关系如图所示。
请回答下列问题:
(1)在水溶液中氢氰酸的电离方程式为
(2)根据图象信息,起始浓度:c(HSCN)
(3)水的电离程度:a点溶液
(4)对b点溶液适当加热,下列选项减小的是
A.
 B.
B. C.
C.
(5)等体积、等pH的上述两种酸的溶液,分别与等物质的量浓度的NaOH溶液恰好完全反应,消耗NaOH溶液较多的酸是
您最近一年使用:0次



