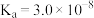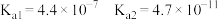1 . 硼及其化合物在制造、化工等领域都有广泛应用,回答下列问题:
(1)基态硼原子的价电子排布图为__________ ,其占据最高能级电子的电子云轮廓图形状为__________ ,基态硼原子比基态氮原子的第一电离能 小,其原因为
小,其原因为__________ 。
(2) 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得:
反应制得:
① 由
由 和
和 构成,
构成, 的空间结构为
的空间结构为__________ 。
② 中B原子的杂化轨道类型为
中B原子的杂化轨道类型为__________ 。
③ 的键角为
的键角为__________ 。
(3)写出B与 溶液反应的离子方程式:
溶液反应的离子方程式:__________ 。
(4) 为一元弱酸[常温下,
为一元弱酸[常温下,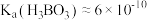 ]:
]:
① 与
与 溶液反应的离子方程式为
溶液反应的离子方程式为__________ 。
②常温下, 的硼酸的pH约为
的硼酸的pH约为__________ (已知: ,
, )。
)。
(1)基态硼原子的价电子排布图为
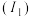 小,其原因为
小,其原因为(2)
 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得:
反应制得:①
 由
由 和
和 构成,
构成, 的空间结构为
的空间结构为②
 中B原子的杂化轨道类型为
中B原子的杂化轨道类型为③
 的键角为
的键角为(3)写出B与
 溶液反应的离子方程式:
溶液反应的离子方程式:(4)
 为一元弱酸[常温下,
为一元弱酸[常温下,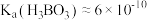 ]:
]:①
 与
与 溶液反应的离子方程式为
溶液反应的离子方程式为②常温下,
 的硼酸的pH约为
的硼酸的pH约为 ,
, )。
)。
您最近一年使用:0次
2024-03-07更新
|
128次组卷
|
2卷引用:河北省邢台市四校联盟2023-2024学年高二上学期11月月考化学试题
解题方法
2 . 下表是常温下几种物质的平衡常数,据此回答问题。
(1)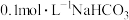 溶液的
溶液的
_______ (填“>”“<”或“=”)7,判断的理由为_______ 。
(2)常温下,用一定体积的 的盐酸和
的盐酸和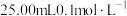 的氨水混合,充分反应后溶液中
的氨水混合,充分反应后溶液中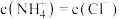 ,此时溶液为
,此时溶液为_______ (填“酸性”“碱性”或“中性”),所加盐酸的体积V_______ (填“>”“<”或“=”) 。
。
(3)常温下,用 溶液与同浓度的
溶液与同浓度的 溶液等体积混合,充分反应后溶液中的元素守恒(物料守恒)关系式为
溶液等体积混合,充分反应后溶液中的元素守恒(物料守恒)关系式为_______ 。
(4)以下反应的离子方程式书写正确的是_______ (填正确选项相应的字母)。
A. 次氯酸钠溶液吸收少量二氧化硫: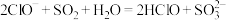
B. 醋酸除水垢: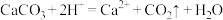
C. 溶液吸收少量
溶液吸收少量
(5)常温下将 通入氨水中,当溶液中的
通入氨水中,当溶液中的 时,溶液的
时,溶液的 为
为_______ 。
(6)调节 除去
除去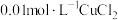 溶液中的少量
溶液中的少量 ,应该调节溶液的
,应该调节溶液的 范围是
范围是_______ (已知离子浓度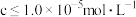 时,可认为已除尽)。
时,可认为已除尽)。
化学式 | 平衡常数 |
|
|
|
|
|
|
|
|
|
|
|
|
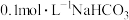 溶液的
溶液的
(2)常温下,用一定体积的
 的盐酸和
的盐酸和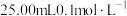 的氨水混合,充分反应后溶液中
的氨水混合,充分反应后溶液中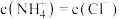 ,此时溶液为
,此时溶液为 。
。(3)常温下,用
 溶液与同浓度的
溶液与同浓度的 溶液等体积混合,充分反应后溶液中的元素守恒(物料守恒)关系式为
溶液等体积混合,充分反应后溶液中的元素守恒(物料守恒)关系式为(4)以下反应的离子方程式书写正确的是
A. 次氯酸钠溶液吸收少量二氧化硫:
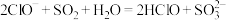
B. 醋酸除水垢:
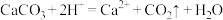
C.
 溶液吸收少量
溶液吸收少量
(5)常温下将
 通入氨水中,当溶液中的
通入氨水中,当溶液中的 时,溶液的
时,溶液的 为
为(6)调节
 除去
除去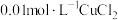 溶液中的少量
溶液中的少量 ,应该调节溶液的
,应该调节溶液的 范围是
范围是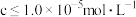 时,可认为已除尽)。
时,可认为已除尽)。
您最近一年使用:0次
名校
3 . 在电解冶炼铝的过程中加入冰晶石( ),可起到降低
),可起到降低 熔点的作用。冰晶石的生产原理为
熔点的作用。冰晶石的生产原理为 。回答下列问题:
。回答下列问题:
(1) 的电子式为
的电子式为_______ , 的结构式为
的结构式为_______ 。
(2)稳定性:
_______ (填“>”或“<”)HF。
(3)H、Li、Na均处于元素周期表的第ⅠA族:
①NaH中氢元素化合价为_______ 。
②碱性:LiOH_______ (填“>”或“<”)NaOH。
③LiH与水发生反应的化学方程式为_______ 。
(4)常温下, 可溶于水,下列说法正确的是
可溶于水,下列说法正确的是_______ (填标号)。
A. 常温下, 可溶于水
可溶于水
B. 为含有共价键的离子化合物
为含有共价键的离子化合物
C. 离子半径:
(5)同族元素的性质有一定的相似性(如硼和铝):
已知:常温下, ,
, 。
。
①硼与氢氧化钠溶液发生反应的化学方程式为_______ 。
②硼酸( )属于一元弱酸,常温下,
)属于一元弱酸,常温下,
 溶液的pH约为
溶液的pH约为_______ 。
 ),可起到降低
),可起到降低 熔点的作用。冰晶石的生产原理为
熔点的作用。冰晶石的生产原理为 。回答下列问题:
。回答下列问题:(1)
 的电子式为
的电子式为 的结构式为
的结构式为(2)稳定性:

(3)H、Li、Na均处于元素周期表的第ⅠA族:
①NaH中氢元素化合价为
②碱性:LiOH
③LiH与水发生反应的化学方程式为
(4)常温下,
 可溶于水,下列说法正确的是
可溶于水,下列说法正确的是A. 常温下,
 可溶于水
可溶于水B.
 为含有共价键的离子化合物
为含有共价键的离子化合物C. 离子半径:

(5)同族元素的性质有一定的相似性(如硼和铝):
已知:常温下,
 ,
, 。
。①硼与氢氧化钠溶液发生反应的化学方程式为
②硼酸(
 )属于一元弱酸,常温下,
)属于一元弱酸,常温下,
 溶液的pH约为
溶液的pH约为
您最近一年使用:0次
4 . 水溶液中存在着多种平衡,按要求回答下列问题。
(1)常温下,0.1 mol/L的一元弱酸HA,加水稀释过程中,溶液的pH将_______ (填“增大”、“减小”或“不变”,下同),HA的电离度_______ ,HA的电离平衡常数(K)将_______ 。
(2)常温下,向10 mL 0.2 mol/L的草酸(H2C2O4,二元弱酸)溶液中加入0.1 mol/L的NaOH溶液30 mL,则2c(OH-)+c( )- 2c(H+)=
)- 2c(H+)=_______ (用微粒的物质的量浓度符号表示)。若此时溶液的pH=4.5,则溶液中水的电离程度_______ (填“>”、“<”、“=”或“无法判断”)纯水的电离程度。
(3)已知常温下Fe(OH)3的Ksp=2.7×10-39,lg3=0.48。试计算0.1 mol/L的FeCl3溶液中,Fe3+开始生成沉淀时的pH=_______ 。
(1)常温下,0.1 mol/L的一元弱酸HA,加水稀释过程中,溶液的pH将
(2)常温下,向10 mL 0.2 mol/L的草酸(H2C2O4,二元弱酸)溶液中加入0.1 mol/L的NaOH溶液30 mL,则2c(OH-)+c(
 )- 2c(H+)=
)- 2c(H+)=(3)已知常温下Fe(OH)3的Ksp=2.7×10-39,lg3=0.48。试计算0.1 mol/L的FeCl3溶液中,Fe3+开始生成沉淀时的pH=
您最近一年使用:0次
2023-02-14更新
|
154次组卷
|
3卷引用:河北省唐山市2022-2023学年高二上学期期末考试化学试题
名校
5 . 下表中的物质为化学实验室常用药品:
回答下列问题:
(1)NH4Cl溶液呈弱酸性的原因(用离子方程式表示):_______ ;常温时,0.1mol·L-1的溶液呈碱性的是_______ (填序号)。
(2)标准状况下,5.6LHCl气体完全溶于蒸馏水中,形成2500mL溶液,则该溶液的pH=_______ ;常温时,pH=3的H2SO4溶液中,由水电离出的c水(H+)=_______ mol‧L-1;pH=10的Na2CO3溶液中由水电离出的c水(OH-)=_______ mol‧L-1。
(3)常温时,向CH3COOH溶液中加入少量NH4Cl固体,电离平衡常数Ka_______ (填“增大”“减小”或“不变”。
(4)写出NaHCO3在生活中的一种用途:_______ 。
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 物质 | H2SO4 | CH3COOH | NaHCO3 | Na2CO3 | NH4Cl | NH3·H2O | HCl | NaCl |
(1)NH4Cl溶液呈弱酸性的原因(用离子方程式表示):
(2)标准状况下,5.6LHCl气体完全溶于蒸馏水中,形成2500mL溶液,则该溶液的pH=
(3)常温时,向CH3COOH溶液中加入少量NH4Cl固体,电离平衡常数Ka
(4)写出NaHCO3在生活中的一种用途:
您最近一年使用:0次
2023-02-12更新
|
195次组卷
|
2卷引用:河北省石家庄市第一中学2022-2023学年高一下学期7月期末化学试题
名校
解题方法
6 . 常温下,有四种溶液:
①0.1 mol·L-1 CH3COOH溶液 ②0.1 mol·L-1 CH3COONa溶液 ③0.1 mol·L-1 NaHSO3溶液④0.1 mol·L-1 NaHCO3溶液
(1)溶液①的pH____ (填“>”“<”或“=”)7,溶液中离子的电荷守恒关系式是___ 。
(2)溶液②呈______ (填“酸”“碱”或“中”)性。其原因是___ (用离子方程式说明)。
(3)下列有关①和②两种溶液的说法正确的是____ (填字母)。
a. 两种溶液中c(CH3COO-) 都小于0.1 mol·L-1
b. 两种溶液中c(CH3COO-) 都等于0.1 mol·L-1
c. CH3COOH溶液中c(CH3COO-) 小于CH3COONa溶液中c(CH3COO-)
(4)NaHCO3溶液的pH>7,NaHSO3溶液的pH<7,则,NaHCO3溶液中c(H2CO3)______ (填“>”“<”或“=”,下同)c( ),NaHSO3溶液中c(H2SO3)
),NaHSO3溶液中c(H2SO3)____ c( )
)
①0.1 mol·L-1 CH3COOH溶液 ②0.1 mol·L-1 CH3COONa溶液 ③0.1 mol·L-1 NaHSO3溶液④0.1 mol·L-1 NaHCO3溶液
(1)溶液①的pH
(2)溶液②呈
(3)下列有关①和②两种溶液的说法正确的是
a. 两种溶液中c(CH3COO-) 都小于0.1 mol·L-1
b. 两种溶液中c(CH3COO-) 都等于0.1 mol·L-1
c. CH3COOH溶液中c(CH3COO-) 小于CH3COONa溶液中c(CH3COO-)
(4)NaHCO3溶液的pH>7,NaHSO3溶液的pH<7,则,NaHCO3溶液中c(H2CO3)
 ),NaHSO3溶液中c(H2SO3)
),NaHSO3溶液中c(H2SO3) )
)
您最近一年使用:0次
2022-12-05更新
|
579次组卷
|
9卷引用:【石家庄新东方】2021-2022石家庄23中高二10月月考化学试题
【石家庄新东方】2021-2022石家庄23中高二10月月考化学试题江苏省海安市2020-2021学年高二上学期期中考试化学试题(已下线)第03章 水溶液中的离子反应与平衡(A卷基础强化篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)云南省通海县一中2020-2021学年高二下学期期中考试化学试题(已下线)第3章 水溶液中的离子反应与平衡(基础过关卷)-【高效检测】2021-2022学年高二化学章末测试卷(人教版2019选择性必修1)辽宁省朝阳市建平县高级中学2021-2022学年高二上学期第二次月考化学试题广东省广州市第八十六中学2022-2023学年高二上学期期中考试化学试题(已下线)专题突破卷09 水溶液中的离子反应与平衡 ?-2024年高考化学一轮复习考点通关卷(新教材新高考)黑龙江省哈尔滨市宾县第二中学2022-2023学年高二上学期期中考试化学试题
名校
7 . “84”消毒液,它是一种以次氯酸钠(NaClO)为有效成分的高效消毒剂。已知:Ka(HClO)=4.7×10-8Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11。回答下列问题:
(1)“84”消毒液溶液呈_______ 性,其原因是_______ 。
(2)浓度均为0.1mo/LNaClO、Na2CO3、NaHCO3的pH由大到小的是_______ 。
(3)测定“84"消毒液中NaCIO的物质的量浓度。
量取10.00mL“84"消毒液于锥形瓶中,加入过量的KI溶液,用足量的乙酸酸化,加入几滴指示剂,用0.5000mol/LNa2S2O3溶液滴定,滴定终点时耗Na2S2O3溶液25.00mL(三次平均值)。
①滴定时所用指示剂是_______ ,终点时的现象_______ 。
②该“84”清毒液中NaClO的物质的量浓度_______ mol/L。
(1)“84”消毒液溶液呈
(2)浓度均为0.1mo/LNaClO、Na2CO3、NaHCO3的pH由大到小的是
(3)测定“84"消毒液中NaCIO的物质的量浓度。
量取10.00mL“84"消毒液于锥形瓶中,加入过量的KI溶液,用足量的乙酸酸化,加入几滴指示剂,用0.5000mol/LNa2S2O3溶液滴定,滴定终点时耗Na2S2O3溶液25.00mL(三次平均值)。
①滴定时所用指示剂是
②该“84”清毒液中NaClO的物质的量浓度
您最近一年使用:0次
8 . 磷能形成次磷酸(H3PO2)、亚磷酸(H3PO3)等多种含氧酸。
(1)次磷酸(H3PO2)属于元酸,是一种精细化工产品。设计一种实验方案,证明H3PO2是弱酸:____ 。(可选择的试剂为:0.1mol·L-1NaH2PO2溶液、0.1mol·L-1的H3PO2溶液、0.1ml·L-1的盐酸)
(2)亚磷酸(H3PO3)是二元弱酸,常温下向1L0.5mol·LH3PO3溶液中滴加等浓度的NaOH溶液,混合溶液中含磷粒子的物质的量分数(δ)与溶液pH的关系如图所示:
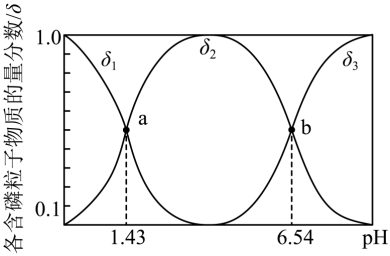
①当溶液pH从6.54变为7时发生反应的离子方程式为____ 。
②Na2HPO3溶液显碱性,原因是(用离子方程式表示)____ 。
③室温下,H3PO3的电离平衡常数为Ka1和Ka2,则pKa2=____ (pKa2=lgKa2)。
④0.1mol·L-1NaH2PO3溶液中各离子浓度由大到小顺序为____ 。
(1)次磷酸(H3PO2)属于元酸,是一种精细化工产品。设计一种实验方案,证明H3PO2是弱酸:
(2)亚磷酸(H3PO3)是二元弱酸,常温下向1L0.5mol·LH3PO3溶液中滴加等浓度的NaOH溶液,混合溶液中含磷粒子的物质的量分数(δ)与溶液pH的关系如图所示:

①当溶液pH从6.54变为7时发生反应的离子方程式为
②Na2HPO3溶液显碱性,原因是(用离子方程式表示)
③室温下,H3PO3的电离平衡常数为Ka1和Ka2,则pKa2=
④0.1mol·L-1NaH2PO3溶液中各离子浓度由大到小顺序为
您最近一年使用:0次
名校
9 . 电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
(1)HF、H2CO3、HClO酸性由强到弱的顺序为_______ 。物质的量浓度均为0.1mol/L的下列溶液:a.Na2CO3 b.NaClO c.NaHCO3 d.NaF,pH值由大到小的顺序是_______ (填编号)
(2)将浓度为0.1mol/LHF溶液加水稀释一倍(假设温度不变),下列各量增大的是_______。
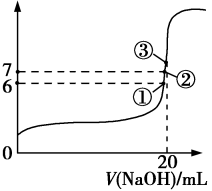
(3)25℃时,在20mL0.1mol/L氢氟酸中加入VmL0.1mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_______。
| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数(Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
(2)将浓度为0.1mol/LHF溶液加水稀释一倍(假设温度不变),下列各量增大的是_______。
| A.c(H+) | B.c(H+)·c(OH-) | C.c(H+)/c(HF) | D.c(OH-)/c(H+) |

| A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等 |
| B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9.9×10-7mol/L |
| C.②点时,溶液中的c(F-)=c(Na+) |
| D.③点时V=20mL,此时溶液中c(F-)<c(Na+)=0.1mol/L |
您最近一年使用:0次
2022-04-15更新
|
192次组卷
|
3卷引用:河北省衡水市武强中学2021-2022学年高二下学期期中考试化学试题
解题方法
10 . 生活中常用到酸和碱,根据所学知识回答下列问题:(以下所有溶液均处于常温下)
(1)现有0.01 mol·L-1的CH3COOH和0.01 mol·L-1的NH3·H2O两种溶液。[已知Ka(CH3COOH)=1.6×10-5,Kb(NH3·H2O)=1.6×10-5,lg2=0.3]
①NH3·H2O的电离方程式为___________ 。
②0.01 mol·L-1的NH3·H2O的pH=___________ 。
③若上述酸和碱等体积充分混合,混合后所得溶液的pH___________ (填“>”、“<”或“=”)7,此时溶液中各离子浓度由大到小的顺序为___________ 。
(2)甲酸钠(HCOONa)属于_______ (填“强”或“弱”)电解质,HCOONa溶液呈碱性的原因是_________ (用离子方程式表示)。0.01 mol·L-1的HCOONa溶液中c(HCOO-)+c(OH-)-c(H+)=_______ mol·L-1。
(1)现有0.01 mol·L-1的CH3COOH和0.01 mol·L-1的NH3·H2O两种溶液。[已知Ka(CH3COOH)=1.6×10-5,Kb(NH3·H2O)=1.6×10-5,lg2=0.3]
①NH3·H2O的电离方程式为
②0.01 mol·L-1的NH3·H2O的pH=
③若上述酸和碱等体积充分混合,混合后所得溶液的pH
(2)甲酸钠(HCOONa)属于
您最近一年使用:0次
2022-01-10更新
|
492次组卷
|
7卷引用:河北金太阳2021-2022学年高二上学期期中联考化学试题
河北金太阳2021-2022学年高二上学期期中联考化学试题湖南省百所名校大联考2021-2022学年高二上学期期中考试化学试题辽宁省葫芦岛市协作校2021-2022学年高三上学期第二次联考化学试题重庆市九校联盟2021-2022学年高二上学期12月联考化学试题陕西省榆林市2021-2022学年高二上学期期末考试化学试题(已下线)解密10 水溶液中的离子平衡(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)黑龙江省齐齐哈尔市三立高级中学2021-2022学年高二下学期开学考试化学试题