名校
1 . 电解质水溶液中存在电离平衡,水解平衡、沉淀溶解平衡。请回答下列问题:
(1)常温下,部分弱酸的电离平衡常数如表:
①等浓度 、
、 、
、 和
和 溶液中,碱性最强的是
溶液中,碱性最强的是___________ (写化学式)。
②等浓度的 与
与 混合溶液中离子浓度由大到小的顺序为
混合溶液中离子浓度由大到小的顺序为___________ 。
(2)室温下,用 盐酸溶液滴定
盐酸溶液滴定 氨水溶液,滴定曲线如图所示。
氨水溶液,滴定曲线如图所示。___________ (填“甲基橙”或“酚酞”)作指示剂。
②室温下, 氨水溶液中
氨水溶液中 的电离平衡常数约为
的电离平衡常数约为___________ 
③b点所示的溶液中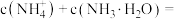
___________ (用溶液的其它离子浓度表示)。
(3)工业上向锅炉里注入所得到的 溶液浸泡,将水垢中的
溶液浸泡,将水垢中的 转化为
转化为 ,写出该反应的离子方程式:
,写出该反应的离子方程式:___________ 。当把水垢中 完全转化时,混合溶液中的
完全转化时,混合溶液中的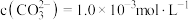 ,则
,则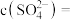
___________  (保留小数点后一位)。
(保留小数点后一位)。
已知: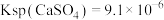 ,
,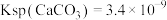
(1)常温下,部分弱酸的电离平衡常数如表:
| 弱酸 |  |  |  |
| 电离平衡常数 | 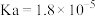 | 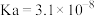 | 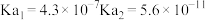 |
 、
、 、
、 和
和 溶液中,碱性最强的是
溶液中,碱性最强的是②等浓度的
 与
与 混合溶液中离子浓度由大到小的顺序为
混合溶液中离子浓度由大到小的顺序为(2)室温下,用
 盐酸溶液滴定
盐酸溶液滴定 氨水溶液,滴定曲线如图所示。
氨水溶液,滴定曲线如图所示。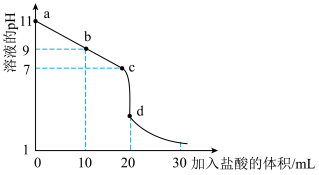
②室温下,
 氨水溶液中
氨水溶液中 的电离平衡常数约为
的电离平衡常数约为
③b点所示的溶液中
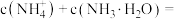
(3)工业上向锅炉里注入所得到的
 溶液浸泡,将水垢中的
溶液浸泡,将水垢中的 转化为
转化为 ,写出该反应的离子方程式:
,写出该反应的离子方程式: 完全转化时,混合溶液中的
完全转化时,混合溶液中的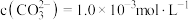 ,则
,则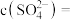
 (保留小数点后一位)。
(保留小数点后一位)。已知:
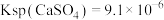 ,
,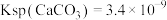
您最近一年使用:0次
2024-02-22更新
|
65次组卷
|
2卷引用:广东省麻涌、塘厦、七中、济川四校2023-2024学年高二下学期5月期中联考化学试题
名校
2 . 工业排放的某些烟气中含有二氧化硫等大气污染物,对其进行脱硫治理不仅可以防止有害物质排放,还可以生产其他有用的产品。
(1) 分子的空间结构和分子的极性分别为___________。
分子的空间结构和分子的极性分别为___________。
(2)第一电离能: ,结合核外电子排布相关知识,说明其原因
,结合核外电子排布相关知识,说明其原因___________ 。
沿海地区的某煤电厂开发出海水脱硫的新工艺,流程如下图所示: ,
, 的电离常数如下表所示:
的电离常数如下表所示:
(3)在吸收塔内,烟气应从吸收塔的___________ 通入,与塔顶喷淋的海水充分接触。
A.上部 B.中部 C.下部
(4)吸收塔内温度不宜过高,原因可能是___________ 。(列举1条)吸收塔内 和海水中
和海水中 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(5)若煤电厂排放烟气量为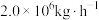 ,其中含
,其中含 为0.15%,该烟气经海水脱硫处理后
为0.15%,该烟气经海水脱硫处理后 为
为 ,则脱硫率
,则脱硫率
___________ 。( )
)
(6)离子液体(ILs)也可以用来处理工业烟气。ILs的负离子吸收 后生成
后生成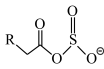 。欲确定
。欲确定 中虚线框内基团的结构,可采用的分析方法有___________。
中虚线框内基团的结构,可采用的分析方法有___________。
工业上还可用 溶液吸收烟气中的二氧化硫,随着反应的进行,其吸收能力会逐渐降低。
溶液吸收烟气中的二氧化硫,随着反应的进行,其吸收能力会逐渐降低。
(7)为使 再生,最适宜向吸收能力降低的溶液中加入或通入一定量的___________。
再生,最适宜向吸收能力降低的溶液中加入或通入一定量的___________。
(8)使用 溶液脱硫时,溶液的pH通常需控制在
溶液脱硫时,溶液的pH通常需控制在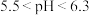 。结合
。结合 的性质和下图,分析pH不宜过小和过大的原因
的性质和下图,分析pH不宜过小和过大的原因___________ 。
(1)
 分子的空间结构和分子的极性分别为___________。
分子的空间结构和分子的极性分别为___________。| A.直线形,非极性 | B.直线形,极性 | C.角形,非极性 | D.角形,极性 |
(2)第一电离能:
 ,结合核外电子排布相关知识,说明其原因
,结合核外电子排布相关知识,说明其原因沿海地区的某煤电厂开发出海水脱硫的新工艺,流程如下图所示:
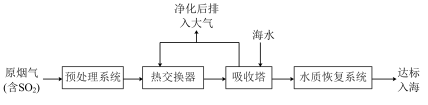
 ,
, 的电离常数如下表所示:
的电离常数如下表所示:| 弱酸 |  |  |
 | 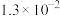 | 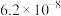 |
 | 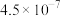 | 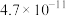 |
(3)在吸收塔内,烟气应从吸收塔的
A.上部 B.中部 C.下部
(4)吸收塔内温度不宜过高,原因可能是
 和海水中
和海水中 发生反应的离子方程式为
发生反应的离子方程式为(5)若煤电厂排放烟气量为
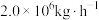 ,其中含
,其中含 为0.15%,该烟气经海水脱硫处理后
为0.15%,该烟气经海水脱硫处理后 为
为 ,则脱硫率
,则脱硫率
 )
)(6)离子液体(ILs)也可以用来处理工业烟气。ILs的负离子吸收
 后生成
后生成 。欲确定
。欲确定 中虚线框内基团的结构,可采用的分析方法有___________。
中虚线框内基团的结构,可采用的分析方法有___________。| A.原子发射光谱 | B.红外光谱 | C.核磁共振氢谱 | D.晶体X射线衍射 |
工业上还可用
 溶液吸收烟气中的二氧化硫,随着反应的进行,其吸收能力会逐渐降低。
溶液吸收烟气中的二氧化硫,随着反应的进行,其吸收能力会逐渐降低。(7)为使
 再生,最适宜向吸收能力降低的溶液中加入或通入一定量的___________。
再生,最适宜向吸收能力降低的溶液中加入或通入一定量的___________。A. | B.CaO | C. | D.NaOH |
(8)使用
 溶液脱硫时,溶液的pH通常需控制在
溶液脱硫时,溶液的pH通常需控制在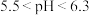 。结合
。结合 的性质和下图,分析pH不宜过小和过大的原因
的性质和下图,分析pH不宜过小和过大的原因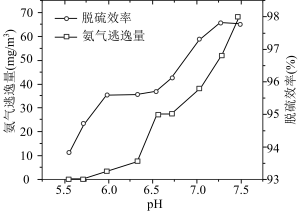
您最近一年使用:0次
2024-01-13更新
|
293次组卷
|
3卷引用:2023-2024学年广东省汕头市汕头金南实验学校三模化学试题
3 . 已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如下表:
(1)写出碳酸的第一步电离方程式_______ 。
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2CO3溶液、③CH3COONa 溶液,pH由大到小的顺序为_______ (填序号)。
(3)25℃时,H2SO3⇌HSO +H+的电离常数Ka=1×10-2mol/L,则该温度下pH=3、c(HSO
+H+的电离常数Ka=1×10-2mol/L,则该温度下pH=3、c(HSO )=0.1mol/L的NaHSO3溶液中c(H2SO3)=
)=0.1mol/L的NaHSO3溶液中c(H2SO3)=_______ 。
(4)下列方法中,可以使0.10mol/LCH3COOH溶液中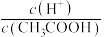 值增大的措施是
值增大的措施是_______ (填序号)。
a.加水稀释 b.加入少量CH3COONa固体 c.加入少量冰醋酸 d.通入少量HCl气体 e.加少量烧碱溶液 f.升高温度
(5)向20 mL硫酸和盐酸的混合溶液中,逐滴加入0.05 mol·L-1Ba(OH)2溶液时,生成沉淀的质量变化及由此而引起的溶液的pH的变化如图所示。计算:
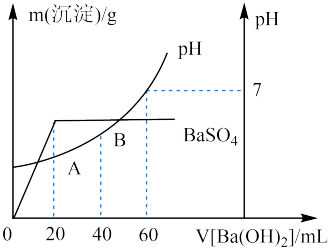
①原混合溶液中c(H+)=_______ ;c(Cl-)=_______ 。
②A点的pH=_______ 。
③将0.15mol·L-1稀硫酸V1mL与0.1mol·L-1NaOH溶液V2mL混合,所得溶液pH为1,则V1∶V2=_______ (溶液体积变化忽略不计)。
| 醋酸 | 碳酸 | 氢氰酸 |
Ka=1.7×10 | Ka1=4.2×10 Ka2=5.6×10  | Ka=6.2×10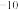 |
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2CO3溶液、③CH3COONa 溶液,pH由大到小的顺序为
(3)25℃时,H2SO3⇌HSO
 +H+的电离常数Ka=1×10-2mol/L,则该温度下pH=3、c(HSO
+H+的电离常数Ka=1×10-2mol/L,则该温度下pH=3、c(HSO )=0.1mol/L的NaHSO3溶液中c(H2SO3)=
)=0.1mol/L的NaHSO3溶液中c(H2SO3)=(4)下列方法中,可以使0.10mol/LCH3COOH溶液中
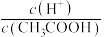 值增大的措施是
值增大的措施是a.加水稀释 b.加入少量CH3COONa固体 c.加入少量冰醋酸 d.通入少量HCl气体 e.加少量烧碱溶液 f.升高温度
(5)向20 mL硫酸和盐酸的混合溶液中,逐滴加入0.05 mol·L-1Ba(OH)2溶液时,生成沉淀的质量变化及由此而引起的溶液的pH的变化如图所示。计算:

①原混合溶液中c(H+)=
②A点的pH=
③将0.15mol·L-1稀硫酸V1mL与0.1mol·L-1NaOH溶液V2mL混合,所得溶液pH为1,则V1∶V2=
您最近一年使用:0次
名校
4 . 已知:可逆反应2SO2(g) + O2(g)⇌2SO3(g) △H<0,在一密闭容器中,该反应已达到平衡状态,按要求完成下列内容:
(1)2mol SO2(g) 和 1mol O2(g)的总能量_______ 2mol SO3(g)的总能量(填写“>”、“<”或“=”)
(2)保持容器体积不变,升高温度,平衡_______ 移动(填写“正向”、“逆向”或“不”)
(3)保持温度不变,压缩体积,平衡_______ 移动(填写“正向”、“逆向”或“不”),平衡常数_______ (填写“增大”、“减小”或“不变”)
(4)常温下, 溶液中,
溶液中,
_______ (填“>”“<”或“=”) ;
;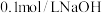 溶液的
溶液的
_______ 。
(5) 溶液呈
溶液呈_______ (填“酸”“碱”或“中”)性,其原因是_______ (用离子方程式表示)。
(1)2mol SO2(g) 和 1mol O2(g)的总能量
(2)保持容器体积不变,升高温度,平衡
(3)保持温度不变,压缩体积,平衡
(4)常温下,
 溶液中,
溶液中,
 ;
;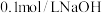 溶液的
溶液的
(5)
 溶液呈
溶液呈
您最近一年使用:0次
5 .  时,三种酸的电离平衡常数如下:
时,三种酸的电离平衡常数如下:
回答下列问题:
(1)一般情况下,当温度升高时,
_____ (填“增大”“减小”或“不变”)。
(2)用蒸馏水稀释 的次氯酸,下列各式表示的数值随水量的增加而增大的是_____。(填字母序号,下同)
的次氯酸,下列各式表示的数值随水量的增加而增大的是_____。(填字母序号,下同)
(3)下列能使醋酸溶液中 的电离程度增大,而电离平衡常数不变的是_____。
的电离程度增大,而电离平衡常数不变的是_____。
(4)依上表数据写出向NaClO溶液中通少量 的离子方程式:
的离子方程式:_____ 。
 时,三种酸的电离平衡常数如下:
时,三种酸的电离平衡常数如下:| 化学式 | HClO |  |  |
| 电离平衡常数 |  |  | 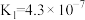 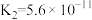 |
(1)一般情况下,当温度升高时,

(2)用蒸馏水稀释
 的次氯酸,下列各式表示的数值随水量的增加而增大的是_____。(填字母序号,下同)
的次氯酸,下列各式表示的数值随水量的增加而增大的是_____。(填字母序号,下同)A. | B. | C.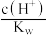 | D. |
 的电离程度增大,而电离平衡常数不变的是_____。
的电离程度增大,而电离平衡常数不变的是_____。| A.升高温度 | B.加水稀释 |
C.加少量的 固体 固体 | D.加少量氢氧化钠浓溶液 |
 的离子方程式:
的离子方程式:
您最近一年使用:0次
2023-06-24更新
|
212次组卷
|
2卷引用:广东省惠州市龙门县高级中学2021-2022学年高二下学期开学测试化学试题
6 . 分布系数的概念在分析化学中非常重要。在酸碱平衡中,分布系数指酸碱以各种形式存在的平衡浓度与其分析浓度的比值。
(1)请以H3A为例,推导出分布系数公式

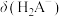
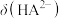
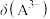
 、
、 、
、 、
、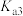 的式子表示,写出表达式即可]。
的式子表示,写出表达式即可]。(2)请用分布系数公式与电荷守恒公式,分别计算出
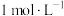 和
和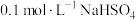 中
中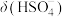 的精确值
的精确值 能否拆为H+和
能否拆为H+和
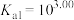 、
、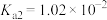 。写出计算过程)
。写出计算过程)
您最近一年使用:0次
7 . 草酸(H2C2O4)是常见的二元弱酸,常温下电离平衡常数Ka1=6×10-2、Ka2=2×10-4。
(1)草酸的第一步电离方程式为___________ 。
(2)下列叙述能说明草酸具有弱酸性的是___________(填标号)。
(3)0.1 mol·L-1 NaHC2O4溶液中离子浓度由大到小的顺序为___________ 。
(4)某温度下,Ksp(CaC2O4)=4×10-8,Ksp(CaCO3)=3.6×10-9。在含CaCO3和CaC2O4的悬浊液中,则溶液中
___________ 。
(5)常温下,反应NH3•H2O(aq)+HC2O (aq)
(aq) C2O
C2O (aq)+NH
(aq)+NH (aq)+H2O(l)的平衡常数K=3×105,则NH3·H2O的电离平衡常数Kb=
(aq)+H2O(l)的平衡常数K=3×105,则NH3·H2O的电离平衡常数Kb=___________ 。
(6)某实验小组利用氧化还原滴定测定草酸晶体(H2C2O4·xH2O)中x的值。实验步骤如下:准确称取m g样品于锥形瓶中,加入适量的蒸馏水溶解,再加入少量稀硫酸,然后用c mol·L-1酸性KMnO4标准溶液进行滴定至终点,共消耗标准溶液V mL。判断达到滴定终点的现象是___________ ,以下操作会造成所测x值偏高的是___________ (填标号)。
A.酸式滴定管未用标准溶液润洗
B.滴定终点读取滴定管刻度时,仰视标准液液面
C.配制标准溶液时,定容时俯视刻度线
D.在滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
(1)草酸的第一步电离方程式为
(2)下列叙述能说明草酸具有弱酸性的是___________(填标号)。
| A.分别向等体积等浓度的草酸溶液和盐酸中投入大小、纯度均相同的锌粒,后者反应更剧烈 |
| B.中和等体积等浓度的草酸溶液和稀硫酸,稀硫酸消耗碱的量更多 |
| C.pH=2的草酸溶液和稀硫酸,分别稀释100倍后,前者pH更小 |
| D.将草酸晶体加入Na2CO3溶液中,有CO2放出 |
(4)某温度下,Ksp(CaC2O4)=4×10-8,Ksp(CaCO3)=3.6×10-9。在含CaCO3和CaC2O4的悬浊液中,则溶液中

(5)常温下,反应NH3•H2O(aq)+HC2O
 (aq)
(aq) C2O
C2O (aq)+NH
(aq)+NH (aq)+H2O(l)的平衡常数K=3×105,则NH3·H2O的电离平衡常数Kb=
(aq)+H2O(l)的平衡常数K=3×105,则NH3·H2O的电离平衡常数Kb=(6)某实验小组利用氧化还原滴定测定草酸晶体(H2C2O4·xH2O)中x的值。实验步骤如下:准确称取m g样品于锥形瓶中,加入适量的蒸馏水溶解,再加入少量稀硫酸,然后用c mol·L-1酸性KMnO4标准溶液进行滴定至终点,共消耗标准溶液V mL。判断达到滴定终点的现象是
A.酸式滴定管未用标准溶液润洗
B.滴定终点读取滴定管刻度时,仰视标准液液面
C.配制标准溶液时,定容时俯视刻度线
D.在滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
您最近一年使用:0次
名校
8 . 醋酸是一种常见的弱酸,回答下列问题:
(1)下列哪些措施能够使醋酸溶液中 增大___________。
增大___________。
(2)向100mL0.1mol·L-1的醋酸中加入VmL0.1mol·L-1的NaOH溶液完全反应后,溶液呈中性,则V___________ 100mL(填“>”,“<”或“=”)。
(3)在CH3COOH与CH3COONa的混合溶液中,测得某一时刻混合溶液中: =18,则此时溶液的pH=
=18,则此时溶液的pH=___________ 。(已知:CH3COOH的电离常数Ka=1.9×10-5)
(4)常温下,将amol·L-1的醋酸与bmol·L-1Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=___________ (用含a和b的代数式表示)。
(5)某化学实验小组从市场上买来一瓶某品牌食用白醋(主要是醋酸的水溶液),用实验室的标准NaOH溶液对其进行滴定实验以测定它的准确浓度,完全反应时所得溶液的pH大约为9。
①该实验应选用___________ 作指示剂。
②为减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为cmol/L,三次实验结果记录如下:
从表可以看出,第一次实验中记录消耗NaOH溶液的体积明显少于后两次,其原因可能是___________ 。
A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积。
B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液。
C.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定。
D.锥形瓶用蒸馏水洗过后未干燥。
E.盛装氢氧化钠溶液的滴定管用蒸馏水洗过,未用氢氧化钠溶液润洗。
③根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):c(CH3COOH)=___________ mol/L。
(1)下列哪些措施能够使醋酸溶液中
 增大___________。
增大___________。| A.升温 | B.通入HCl气体 | C.加入NaHSO4固体 | D.加入NaOH固体 |
(3)在CH3COOH与CH3COONa的混合溶液中,测得某一时刻混合溶液中:
 =18,则此时溶液的pH=
=18,则此时溶液的pH=(4)常温下,将amol·L-1的醋酸与bmol·L-1Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=
(5)某化学实验小组从市场上买来一瓶某品牌食用白醋(主要是醋酸的水溶液),用实验室的标准NaOH溶液对其进行滴定实验以测定它的准确浓度,完全反应时所得溶液的pH大约为9。
①该实验应选用
②为减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为cmol/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 24.72 | 25.35 | 25.30 |
A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积。
B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液。
C.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定。
D.锥形瓶用蒸馏水洗过后未干燥。
E.盛装氢氧化钠溶液的滴定管用蒸馏水洗过,未用氢氧化钠溶液润洗。
③根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):c(CH3COOH)=
您最近一年使用:0次
名校
9 . 下表中的物质为化学实验室常用药品:
回答下列问题:
(1)NH4Cl溶液呈弱酸性的原因(用离子方程式表示):_______ ;常温时,0.1mol·L-1的溶液呈碱性的是_______ (填序号)。
(2)标准状况下,5.6LHCl气体完全溶于蒸馏水中,形成2500mL溶液,则该溶液的pH=_______ ;常温时,pH=3的H2SO4溶液中,由水电离出的c水(H+)=_______ mol‧L-1;pH=10的Na2CO3溶液中由水电离出的c水(OH-)=_______ mol‧L-1。
(3)常温时,向CH3COOH溶液中加入少量NH4Cl固体,电离平衡常数Ka_______ (填“增大”“减小”或“不变”。
(4)写出NaHCO3在生活中的一种用途:_______ 。
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 物质 | H2SO4 | CH3COOH | NaHCO3 | Na2CO3 | NH4Cl | NH3·H2O | HCl | NaCl |
(1)NH4Cl溶液呈弱酸性的原因(用离子方程式表示):
(2)标准状况下,5.6LHCl气体完全溶于蒸馏水中,形成2500mL溶液,则该溶液的pH=
(3)常温时,向CH3COOH溶液中加入少量NH4Cl固体,电离平衡常数Ka
(4)写出NaHCO3在生活中的一种用途:
您最近一年使用:0次
2023-02-12更新
|
206次组卷
|
2卷引用:广东省汕头市潮阳区教师发展中心教学研究室 2022-2023学年高二上学期期末质量检测化学试题
10 . 现有下列物质 ①熔化的NaCl ②盐酸 ③氯气 ④冰醋酸 ⑤铜 ⑥酒精 ⑦硫酸氢钠 ⑧液氨 ⑨SO2,请按要求回答下列问题。
(1)属于强电解质的是_______ (填序号)
(2)在上述状态下能导电的是_______ (填序号)
(3)属于弱电解质的是_______ (填序号)
(4)属于非电解质,但溶于水后的水溶液能导电的是_______ (填序号)
(5)可以证明④是弱酸的事实是_______(填序号)
(6)有下列物质的溶液:a.CH3COOH、b.HCl、c.H2SO4、d.NaHSO4,若四种溶液的物质的量浓度相同,其由水电离c(H+)由大到小顺序为_______ (用字母序号表示,下同)。若四种溶液的c(H+)相同,其物质的量浓度由大到小顺序为_______ 。
(7)常温下,有 相同、体积相同的醋酸和盐酸两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是
相同、体积相同的醋酸和盐酸两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是_______ (填字母)。(①表示盐酸,②表示醋酸)
a.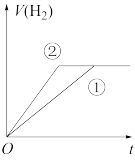 b.
b. 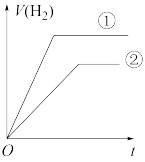 c.
c. 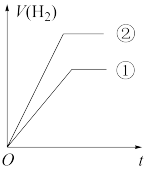 d.
d. 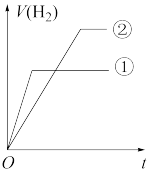
(1)属于强电解质的是
(2)在上述状态下能导电的是
(3)属于弱电解质的是
(4)属于非电解质,但溶于水后的水溶液能导电的是
(5)可以证明④是弱酸的事实是_______(填序号)
| A.乙酸和水能以任意比例混溶 |
| B.在乙酸水溶液中含有未电离的乙酸分子 |
| C.乙酸与Na2CO3溶液反应放出CO2气体 |
| D.1 mol·L-1的乙酸水溶液能使紫色石蕊溶液变红色 |
(7)常温下,有
 相同、体积相同的醋酸和盐酸两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是
相同、体积相同的醋酸和盐酸两种溶液,分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是a.
 b.
b.  c.
c.  d.
d. 
您最近一年使用:0次
2022-12-06更新
|
532次组卷
|
7卷引用:广东省清远市四校联盟2022-2023学年高二上学期期中考试化学试题
广东省清远市四校联盟2022-2023学年高二上学期期中考试化学试题广东省广州市第三中学2022-2023学年高二上学期期末测试化学试题宁夏银川市第二中学2021-2022学年高二下学期第一次月考化学试题(已下线)1.2.1 电解质及其电离(好题帮)-备战2023年高考化学一轮复习考点帮(新教材新高考)(已下线)3.1.1 电离平衡-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)湖北省武汉市武钢三中2022-2023学年高二上学期第一次月考化学试题四川省成都市第八中学校2022-2023学年高二上学期11月期中考试化学试题



