解题方法
1 . 电解质的水溶液中存在电离平衡。
(1)NH3·H2O是常见的弱碱。
①NH3·H2O在水溶液中的电离方程式为_______ 。
②下列方法中,可以使氨水中NH3·H2O电离程度减小的是(填字母序号)________ 。
a.微热溶液 b.滴加浓盐酸 c.加水稀释 d.加入氯化铵晶体
(2)常温条件下,用0.1000mol/L NaOH溶液分别滴定体积均为 、浓度均为0.1000mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
、浓度均为0.1000mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。_______ 。
②滴定醋酸的曲线是_______ (填“I”或“Ⅱ”),则V1______ V2(填“>”、 “<”“或“=”)。
(3)如图为盛放盐酸的滴定管中液面的位置。盐酸的体积读数:滴定后读数为_____ mL。 未知浓度的醋酸放入锥形瓶中,用0.1000mol/L NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
未知浓度的醋酸放入锥形瓶中,用0.1000mol/L NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
①该滴定过程应选择______ (填“甲基橙”或“酚酞”)为指示剂,根据上述数据,可计算出该醋酸的浓度约为_____  。
。
②在上述实验中,下列操作会造成测定结果偏大的有______ 。(填字母序号)。
A.滴定前仰视读数,滴定后俯视读数
B.碱式滴定管使用前,水洗后未用标准氢氧化钠溶液润洗
C.滴定过程中,溶液刚出现变色,立即停止滴定
D.锥形瓶水洗后未干燥
E.碱式滴定管尖嘴部分有气泡,滴定后消失
(1)NH3·H2O是常见的弱碱。
①NH3·H2O在水溶液中的电离方程式为
②下列方法中,可以使氨水中NH3·H2O电离程度减小的是(填字母序号)
a.微热溶液 b.滴加浓盐酸 c.加水稀释 d.加入氯化铵晶体
(2)常温条件下,用0.1000mol/L NaOH溶液分别滴定体积均为
 、浓度均为0.1000mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
、浓度均为0.1000mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。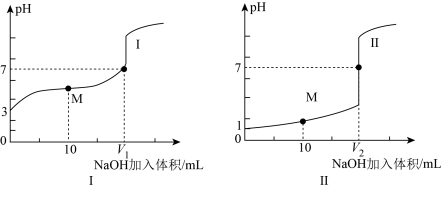
②滴定醋酸的曲线是
(3)如图为盛放盐酸的滴定管中液面的位置。盐酸的体积读数:滴定后读数为

 未知浓度的醋酸放入锥形瓶中,用0.1000mol/L NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
未知浓度的醋酸放入锥形瓶中,用0.1000mol/L NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。| 实验编号 | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测醋酸的体积(mL) |
| 1 | 0.1000 | 22.48 | 20.00 |
| 2 | 0.1000 | 25.72 | 20.00 |
| 3 | 0.1000 | 22.52 | 20.00 |
 。
。②在上述实验中,下列操作会造成测定结果偏大的有
A.滴定前仰视读数,滴定后俯视读数
B.碱式滴定管使用前,水洗后未用标准氢氧化钠溶液润洗
C.滴定过程中,溶液刚出现变色,立即停止滴定
D.锥形瓶水洗后未干燥
E.碱式滴定管尖嘴部分有气泡,滴定后消失
您最近一年使用:0次
名校
2 . 碳族元素的物质是化学世界中最庞大的家族,“天问一号”轨道飞行器近距离拍摄了火星北极,看到大量白色冰冻区域, 主要是二氧化碳低温凝结形成的干冰,虽然看起来和地球两极很像,但实际温度却比地球两极冷多了!
(1)已知 25℃时,H2CO3的Ka1=4.2×10-7、Ka2=4.8×10- 11,HCN的Ka=4.0×10-10,若向NaCN 溶液中通入少量 CO2,发生反应的离子方程式为___________ 。
(2)下列关于二氧化碳的说法正确的是___________。
(3)干冰和冰的晶体模型如下图存在差别的本质原因___________ 。___________ 。
(5)金刚石晶体中,每个C被___________ 个六元环共用。
(6)晶体硅和碳化硅熔点较高的是___________ (填化学式)。
(7)已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为___________ 。
(1)已知 25℃时,H2CO3的Ka1=4.2×10-7、Ka2=4.8×10- 11,HCN的Ka=4.0×10-10,若向NaCN 溶液中通入少量 CO2,发生反应的离子方程式为
(2)下列关于二氧化碳的说法正确的是___________。
A.电子式为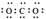 | B.空间填充模型为  |
| C.CO2 是极性分子, 能溶于水 | D.CO2 的水溶液能够导电,但 CO2是非电解质 |
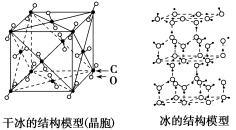
(5)金刚石晶体中,每个C被
(6)晶体硅和碳化硅熔点较高的是
(7)已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为
您最近一年使用:0次
名校
3 . 研究电解质在水溶液中的离子反应与平衡有重要的意义。
(1)25℃时,在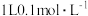 的HA溶液中,有
的HA溶液中,有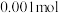 的HA电离成离子,则该温度下的电离平衡常数约为
的HA电离成离子,则该温度下的电离平衡常数约为___________ 。
(2)在25℃时,将pH=11的 溶液
溶液 与pH=2的HCl溶液
与pH=2的HCl溶液 混合,若所得溶液为中性,则
混合,若所得溶液为中性,则 。
。
(3)常温下将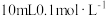 的NaOH溶液与
的NaOH溶液与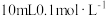 的醋酸溶液混合,则混合后溶液中各离子浓度的大小顺序为
的醋酸溶液混合,则混合后溶液中各离子浓度的大小顺序为___________ 。
(4)常温下,几种弱酸的电离平衡常数如下表所示,回答下列问题:
①上述四种酸酸性由强到弱的顺序为___________ ;
②将少量的 通入
通入 溶液中,反应的离子方程式:
溶液中,反应的离子方程式:___________ 。
(5)已知在25℃时,将浓度相等的HF与NaF溶液等体积混合,溶液呈酸性。解释溶液呈酸性的原因___________ 。
(1)25℃时,在
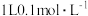 的HA溶液中,有
的HA溶液中,有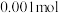 的HA电离成离子,则该温度下的电离平衡常数约为
的HA电离成离子,则该温度下的电离平衡常数约为(2)在25℃时,将pH=11的
 溶液
溶液 与pH=2的HCl溶液
与pH=2的HCl溶液 混合,若所得溶液为中性,则
混合,若所得溶液为中性,则 。
。(3)常温下将
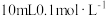 的NaOH溶液与
的NaOH溶液与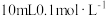 的醋酸溶液混合,则混合后溶液中各离子浓度的大小顺序为
的醋酸溶液混合,则混合后溶液中各离子浓度的大小顺序为(4)常温下,几种弱酸的电离平衡常数如下表所示,回答下列问题:
| 化学式 |  |  |  |  |
| 电离平衡常数 | 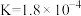 | 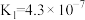 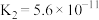 |  | 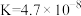 |
②将少量的
 通入
通入 溶液中,反应的离子方程式:
溶液中,反应的离子方程式:(5)已知在25℃时,将浓度相等的HF与NaF溶液等体积混合,溶液呈酸性。解释溶液呈酸性的原因
您最近一年使用:0次
名校
4 . 酸、碱、盐是中学化学学习的重要化合物,请依据其性质回答下列问题。
(1)将0.5mol•L-1的NaClO溶液加热蒸干灼烧最后所得的固体是_______ 。
(2)铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3•6H2O和NH4Cl固体混合物的方法来制备,其中NH4Cl的作用是________ 。
(3)为了除去氨氮废水中的NH3,得到低浓度的氨氮废水,采取以下措施:加入NaOH溶液,调节pH至9后,升温至30℃,通空气将氨赶出并回收,用化学平衡原理解释通空气的目的:_________ 。
(4)甲、乙两瓶氨水的浓度分别为1mol•L-1和0.1mol•L-1,则甲、乙两瓶氨水中c(OH-)之比_______ (填“大于”、“等于”或“小于”)。
(5)25℃时,将amolNH4NO3溶于水,溶液显酸性,向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将________ (填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为_______ mol•L-1。(NH3•H2O的电离平衡常数:Kb=2×10-5)
(6)已知NH2OH•H2O与NH3•H2O相似,水溶液具有弱碱性,其电离方程式为:NH2OH•H2O NH3OH++OH-。常温下,现用盐酸滴定NH2OH•H2O溶液,溶液中由水电离出的c(H+)的负对数[-lg水c(H+)]与所加盐酸体积的关系如图所示(已知:Kb(NH2OH•H2O)=10-9)
NH3OH++OH-。常温下,现用盐酸滴定NH2OH•H2O溶液,溶液中由水电离出的c(H+)的负对数[-lg水c(H+)]与所加盐酸体积的关系如图所示(已知:Kb(NH2OH•H2O)=10-9)
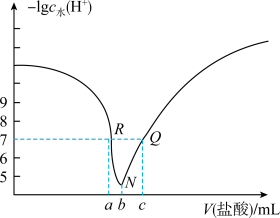
①R、Q两点溶液pH关系是:R________ Q(填“>”、“=”或“<”)。
②滴定过程中,若c(NH3OH+)=c(NH2OH•H2O),则此时溶液中pH=________ 。
③N点离子浓度由大到小的顺序为________ 。
(1)将0.5mol•L-1的NaClO溶液加热蒸干灼烧最后所得的固体是
(2)铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3•6H2O和NH4Cl固体混合物的方法来制备,其中NH4Cl的作用是
(3)为了除去氨氮废水中的NH3,得到低浓度的氨氮废水,采取以下措施:加入NaOH溶液,调节pH至9后,升温至30℃,通空气将氨赶出并回收,用化学平衡原理解释通空气的目的:
(4)甲、乙两瓶氨水的浓度分别为1mol•L-1和0.1mol•L-1,则甲、乙两瓶氨水中c(OH-)之比
(5)25℃时,将amolNH4NO3溶于水,溶液显酸性,向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将
(6)已知NH2OH•H2O与NH3•H2O相似,水溶液具有弱碱性,其电离方程式为:NH2OH•H2O
 NH3OH++OH-。常温下,现用盐酸滴定NH2OH•H2O溶液,溶液中由水电离出的c(H+)的负对数[-lg水c(H+)]与所加盐酸体积的关系如图所示(已知:Kb(NH2OH•H2O)=10-9)
NH3OH++OH-。常温下,现用盐酸滴定NH2OH•H2O溶液,溶液中由水电离出的c(H+)的负对数[-lg水c(H+)]与所加盐酸体积的关系如图所示(已知:Kb(NH2OH•H2O)=10-9)
①R、Q两点溶液pH关系是:R
②滴定过程中,若c(NH3OH+)=c(NH2OH•H2O),则此时溶液中pH=
③N点离子浓度由大到小的顺序为
您最近一年使用:0次
5 . 为研究某企业冲洗电路板后的废水( ,主要含
,主要含 、
、 等)中处理铜元素的最佳pH,取5份等量的废水,分别加入
等)中处理铜元素的最佳pH,取5份等量的废水,分别加入 的
的 溶液,调至不同的pH,静置后,分析上层清液中铜元素的含量,实验结果如图所示:
溶液,调至不同的pH,静置后,分析上层清液中铜元素的含量,实验结果如图所示:

关于 信息:
信息:
Ⅰ. 完全沉淀的
完全沉淀的
Ⅱ.废水中存在以下平衡:
①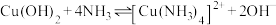 ;
;
②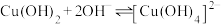
请回答下列问题
(1)结合图像可知,处理含铜废水的最佳
_____ 。
(2)该废水中含有污染环境的主要微粒除了 外,还有
外,还有_____ 。
(3)加入 溶液,使
溶液,使 转化为沉淀的离子方程式是
转化为沉淀的离子方程式是_____ 。
(4)从平衡原理分析, 段铜元素含量下降的原因是
段铜元素含量下降的原因是_____ 。
(5)分析 段,铜元素含量变化的可能原因是
段,铜元素含量变化的可能原因是_____ 。
(6)实际在加入 溶液调节pH除去铜元素过程中,从环境友好角度考虑,还需要进行的操作是
溶液调节pH除去铜元素过程中,从环境友好角度考虑,还需要进行的操作是_____ 。
 ,主要含
,主要含 、
、 等)中处理铜元素的最佳pH,取5份等量的废水,分别加入
等)中处理铜元素的最佳pH,取5份等量的废水,分别加入 的
的 溶液,调至不同的pH,静置后,分析上层清液中铜元素的含量,实验结果如图所示:
溶液,调至不同的pH,静置后,分析上层清液中铜元素的含量,实验结果如图所示:
关于
 信息:
信息:Ⅰ.
 完全沉淀的
完全沉淀的
Ⅱ.废水中存在以下平衡:
①
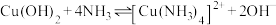 ;
;②
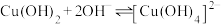
请回答下列问题
(1)结合图像可知,处理含铜废水的最佳

(2)该废水中含有污染环境的主要微粒除了
 外,还有
外,还有(3)加入
 溶液,使
溶液,使 转化为沉淀的离子方程式是
转化为沉淀的离子方程式是(4)从平衡原理分析,
 段铜元素含量下降的原因是
段铜元素含量下降的原因是(5)分析
 段,铜元素含量变化的可能原因是
段,铜元素含量变化的可能原因是(6)实际在加入
 溶液调节pH除去铜元素过程中,从环境友好角度考虑,还需要进行的操作是
溶液调节pH除去铜元素过程中,从环境友好角度考虑,还需要进行的操作是
您最近一年使用:0次
6 . 利用下列价类二维图分析硫酸型酸雨的形成及防治。

(1)图中X是___________ (填化学式),从硫的化合价角度分类,X常作为___________ (填“氧化剂”或“还原剂”)。
(2)SO2是一种大气污染物,主要来源于___________ ;在降雨过程中,SO2发生转化导致雨水中含有 ,其总化学反应方程式为
,其总化学反应方程式为___________ 。
(3)从物质类别的角度判断,SO2属于___________ (填“酸性氧化物”或“碱性氧化物”);某小组用Na2CO3溶液吸收SO2,若产生CO2,则产物中硫元素的主要存在形态为___________ (写化学式)。已知该条件下亚硫酸和碳酸的电离常数为:H2SO3 K1=1.5×10-2,K2=6.0×10-8;H2CO3 K1=4.3×10-7,K2=5.6×10-11。

(1)图中X是
(2)SO2是一种大气污染物,主要来源于
 ,其总化学反应方程式为
,其总化学反应方程式为(3)从物质类别的角度判断,SO2属于
您最近一年使用:0次
解题方法
7 . 2022年3月神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。其中太空“冰雪实验”演示了过饱和醋酸钠溶液的结晶现象。回答下列问题:
(1)醋酸钠溶液显___________ 性(填“酸”或“碱”),原因是___________ (用离子方程式解释)。
(2)已知某温度下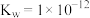 ,则该温度下
,则该温度下 的
的 溶液中,由水电离出的
溶液中,由水电离出的 为
为___________ 。
(3)常温下,某醋酸和醋酸钠的混合溶液中 ,溶液中
,溶液中 随
随 变化如图所示。
变化如图所示。

①醋酸的电离常数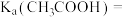
___________ , 的水解常数
的水解常数
___________ 。
②该温度下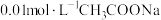 溶液的
溶液的 约为
约为___________ 。(已知 。)
。)
(1)醋酸钠溶液显
(2)已知某温度下
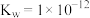 ,则该温度下
,则该温度下 的
的 溶液中,由水电离出的
溶液中,由水电离出的 为
为(3)常温下,某醋酸和醋酸钠的混合溶液中
 ,溶液中
,溶液中 随
随 变化如图所示。
变化如图所示。
①醋酸的电离常数
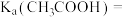
 的水解常数
的水解常数
②该温度下
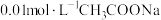 溶液的
溶液的 约为
约为 。)
。)
您最近一年使用:0次
8 . Ⅰ.以下是生产、生活中常见的物质。按要求回答下列问题。
①冰醋酸;② ;③NaOH;④盐酸;⑤
;③NaOH;④盐酸;⑤ ;⑥熔融
;⑥熔融 ;⑦石墨;⑧酒精;⑨
;⑦石墨;⑧酒精;⑨ ;⑩
;⑩ 。
。
(1)属于强电解质的有_______ ,属于非电解质的有_______ 。(用序号填空)
(2)写出⑤溶液的电离方程式:_______ 。
(3)常温下, 的①溶液和
的①溶液和 的④溶液,加水稀释100倍,pH较大的是
的④溶液,加水稀释100倍,pH较大的是_______ 。(用序号填空)
(4)等体积的0.1 mol/L①溶液与0.1 mol/L④溶液分别与等浓度的氢氧化钠反应至中性,消耗的NaOH溶液的体积依次为 和
和 ,则
,则
_______  (填“>”、“<”或者“=”)。
(填“>”、“<”或者“=”)。
Ⅱ.已知,常温下几种酸的电离平衡常数如表:
(5)常温下,0.1 mol/L的HCN溶液中, 约为
约为_______ 。
(6)根据电离平衡常数判断,以下反应不能自发进行的是_______。
①冰醋酸;②
 ;③NaOH;④盐酸;⑤
;③NaOH;④盐酸;⑤ ;⑥熔融
;⑥熔融 ;⑦石墨;⑧酒精;⑨
;⑦石墨;⑧酒精;⑨ ;⑩
;⑩ 。
。(1)属于强电解质的有
(2)写出⑤溶液的电离方程式:
(3)常温下,
 的①溶液和
的①溶液和 的④溶液,加水稀释100倍,pH较大的是
的④溶液,加水稀释100倍,pH较大的是(4)等体积的0.1 mol/L①溶液与0.1 mol/L④溶液分别与等浓度的氢氧化钠反应至中性,消耗的NaOH溶液的体积依次为
 和
和 ,则
,则
 (填“>”、“<”或者“=”)。
(填“>”、“<”或者“=”)。Ⅱ.已知,常温下几种酸的电离平衡常数如表:
| 化学式 | HCOOH | HCN |  |
| 电离平衡常数 | 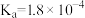 | 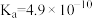 |   |
 约为
约为(6)根据电离平衡常数判断,以下反应不能自发进行的是_______。
A. |
B.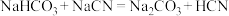 |
C.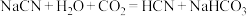 |
D. |
您最近一年使用:0次
9 .  时,三种酸的电离平衡常数如下:
时,三种酸的电离平衡常数如下:
回答下列问题:
(1)一般情况下,当温度升高时,
_____ (填“增大”“减小”或“不变”)。
(2)用蒸馏水稀释 的次氯酸,下列各式表示的数值随水量的增加而增大的是_____。(填字母序号,下同)
的次氯酸,下列各式表示的数值随水量的增加而增大的是_____。(填字母序号,下同)
(3)下列能使醋酸溶液中 的电离程度增大,而电离平衡常数不变的是_____。
的电离程度增大,而电离平衡常数不变的是_____。
(4)依上表数据写出向NaClO溶液中通少量 的离子方程式:
的离子方程式:_____ 。
 时,三种酸的电离平衡常数如下:
时,三种酸的电离平衡常数如下:| 化学式 | HClO |  |  |
| 电离平衡常数 |  |  | 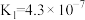 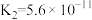 |
(1)一般情况下,当温度升高时,

(2)用蒸馏水稀释
 的次氯酸,下列各式表示的数值随水量的增加而增大的是_____。(填字母序号,下同)
的次氯酸,下列各式表示的数值随水量的增加而增大的是_____。(填字母序号,下同)A. | B. | C.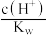 | D. |
 的电离程度增大,而电离平衡常数不变的是_____。
的电离程度增大,而电离平衡常数不变的是_____。| A.升高温度 | B.加水稀释 |
C.加少量的 固体 固体 | D.加少量氢氧化钠浓溶液 |
 的离子方程式:
的离子方程式:
您最近一年使用:0次
2023-06-24更新
|
212次组卷
|
2卷引用:四川省泸州市合江县马街中学校2023-2024学年高二上学期11月期中化学试题
名校
解题方法
10 . 化学定量计算有助于提升理解辨析能力,是科学研究过程中不可或缺的一个环节。
Ⅰ.已知常温下部分弱电解质的电离平衡常数如下表:
(1)向NaClO溶液中通入少量的 ,所发生的离子方程式为
,所发生的离子方程式为_______ 。
(2)常温下,0.1mol/L的HClO溶液和0.1molL的NaClO溶液等体积混合,判断混合溶液的酸碱性_______ (填“酸性”“碱性”“中性”)。
(3)把 溶液蒸干,灼烧,最后得到的主要固体产物是
溶液蒸干,灼烧,最后得到的主要固体产物是_______ 。
(4)常温下,在25.00mL 溶液中滴加
溶液中滴加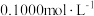 盐酸,溶液的pH变化曲线如图所示。
盐酸,溶液的pH变化曲线如图所示。

①a点溶液中
_______ ;
②b点溶液中溶质为_______ (写化学式) 。
Ⅰ.已知常温下部分弱电解质的电离平衡常数如下表:
| 化学式 |  |  |  |  |
| 电离常数 | 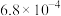 | 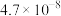 | 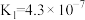 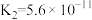 | 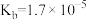 |
 ,所发生的离子方程式为
,所发生的离子方程式为(2)常温下,0.1mol/L的HClO溶液和0.1molL的NaClO溶液等体积混合,判断混合溶液的酸碱性
(3)把
 溶液蒸干,灼烧,最后得到的主要固体产物是
溶液蒸干,灼烧,最后得到的主要固体产物是(4)常温下,在25.00mL
 溶液中滴加
溶液中滴加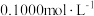 盐酸,溶液的pH变化曲线如图所示。
盐酸,溶液的pH变化曲线如图所示。
①a点溶液中

②b点溶液中溶质为
您最近一年使用:0次



