2024·天津·模拟预测
1 . 黄铁矿[主要成分为二硫化亚铁(FeS2)]、焦炭和适量空气混合加热发生如下反应:
i.3FeS2+2C+3O2=3S2+Fe3O4+2CO
(1)反应i生成1molS2时,转移电子的物质的量为___________ mol。
(2)反应i所得气体经冷凝回收S2后,尾气中还含有CO和SO2。将尾气通过催化剂进行处理,发生反应ii,同时发生副反应iii。
ii.2SO2(g)+4CO(g) S2(g)+4CO2(g) ΔH<0
S2(g)+4CO2(g) ΔH<0
iii.SO2(g)+3CO(g) COS(g)+2CO2(g) ΔH<0
COS(g)+2CO2(g) ΔH<0
理论分析及实验结果表明,600~1000K范围内,SO2平衡转化率接近100%。其他条件相同,不同温度下,S2、COS平衡产率和10min时S2实际产率如图。___________ 。
②随温度升高,S2平衡产率上升,推测其原因是___________ 。
③900K,在10min后继续反应足够长时间,推测S2实际产率的变化趋势可能为___________ 。
(3)处理后的尾气仍含少量SO2,经Na2CO3溶液洗脱处理后,所得洗脱液主要成分为Na2CO3、NaHCO3和Na2SO3.利用生物电池技术,可将洗脱液中的Na2SO3转化为单质硫(以S表示)回收。___________ 。
②一段时间后,若洗脱液中 的物质的量减小了1mol,则理论上
的物质的量减小了1mol,则理论上 减小了
减小了___________ mol。
(4)常温向 溶液中加入适量的NaOH,溶液中
溶液中加入适量的NaOH,溶液中 、
、 、
、 的分布系数
的分布系数 随pOH的变化如图。
随pOH的变化如图。___________ 。
A.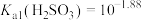
B.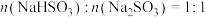 时,溶液显酸性
时,溶液显酸性
C.N点对应的溶液,对水的电离起到抑制作用
i.3FeS2+2C+3O2=3S2+Fe3O4+2CO
(1)反应i生成1molS2时,转移电子的物质的量为
(2)反应i所得气体经冷凝回收S2后,尾气中还含有CO和SO2。将尾气通过催化剂进行处理,发生反应ii,同时发生副反应iii。
ii.2SO2(g)+4CO(g)
 S2(g)+4CO2(g) ΔH<0
S2(g)+4CO2(g) ΔH<0iii.SO2(g)+3CO(g)
 COS(g)+2CO2(g) ΔH<0
COS(g)+2CO2(g) ΔH<0理论分析及实验结果表明,600~1000K范围内,SO2平衡转化率接近100%。其他条件相同,不同温度下,S2、COS平衡产率和10min时S2实际产率如图。

②随温度升高,S2平衡产率上升,推测其原因是
③900K,在10min后继续反应足够长时间,推测S2实际产率的变化趋势可能为
(3)处理后的尾气仍含少量SO2,经Na2CO3溶液洗脱处理后,所得洗脱液主要成分为Na2CO3、NaHCO3和Na2SO3.利用生物电池技术,可将洗脱液中的Na2SO3转化为单质硫(以S表示)回收。

②一段时间后,若洗脱液中
 的物质的量减小了1mol,则理论上
的物质的量减小了1mol,则理论上 减小了
减小了(4)常温向
 溶液中加入适量的NaOH,溶液中
溶液中加入适量的NaOH,溶液中 、
、 、
、 的分布系数
的分布系数 随pOH的变化如图。
随pOH的变化如图。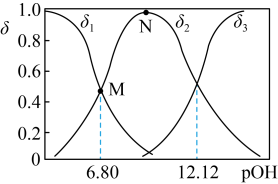
A.
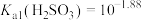
B.
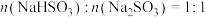 时,溶液显酸性
时,溶液显酸性C.N点对应的溶液,对水的电离起到抑制作用
您最近一年使用:0次
2 . 甲酸是一种有机化工原料,广泛用于农药、皮革、医药和橡胶等工业。请回答:
(1)活性Fe3O4-x催化反应 ,进而可制得甲酸。该反应的
,进而可制得甲酸。该反应的
_______ 0(填“>”或“<”),理由是_______ 。
(2)某温度下,HCOOH电离平衡常数为 ,当HCOOH平衡浓度为xmol/L时,HCOOH已电离的弱电解质分子数的电离度
,当HCOOH平衡浓度为xmol/L时,HCOOH已电离的弱电解质分子数的电离度
_______ (电离度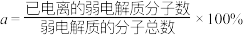 ,用含
,用含 和x的代数式表示,可不化简)。
和x的代数式表示,可不化简)。
(3)某研究小组发现HCOOH水溶液在密封石英管中的分解反应如下:
Ⅰ.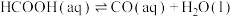
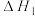
Ⅱ.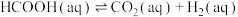
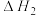
研究发现,在反应Ⅰ、Ⅱ中,H+仅对反应Ⅰ有催化加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。T℃下,在密封石英管内完全充满1.0mol/LHCOOH水溶液,分解产物均完全溶于水中。CO2、CO浓度与反应时间的变化关系如图所示。_______ 。
A.反应Ⅰ活化能小于反应Ⅱ
B.反应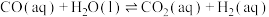
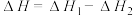
C.混合体系达平衡后: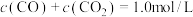
D.若在起始溶液中加入盐酸,则CO达浓度峰值时,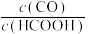 的值与未加盐酸时相同
的值与未加盐酸时相同
②保持其它条件不变,若反应起始时溶液中同时还含有0.10mol/L盐酸,请在上图中画出CO的浓度与反应时间的变化关系图_______ 。
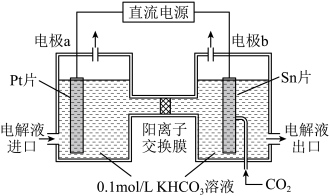
(4)一种由CO2电化学法合成甲酸盐的工作原理如图所示。电极b为_______ 极。电解一段时间后,若两侧电解液中K+的物质的量相差0.08mol,则阳极产生的气体在标准状况下的总体积为_______ L(假设产生的气体全部逸出)。
(1)活性Fe3O4-x催化反应
 ,进而可制得甲酸。该反应的
,进而可制得甲酸。该反应的
(2)某温度下,HCOOH电离平衡常数为
 ,当HCOOH平衡浓度为xmol/L时,HCOOH已电离的弱电解质分子数的电离度
,当HCOOH平衡浓度为xmol/L时,HCOOH已电离的弱电解质分子数的电离度
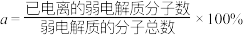 ,用含
,用含 和x的代数式表示,可不化简)。
和x的代数式表示,可不化简)。(3)某研究小组发现HCOOH水溶液在密封石英管中的分解反应如下:
Ⅰ.
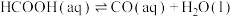
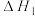
Ⅱ.
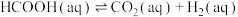
研究发现,在反应Ⅰ、Ⅱ中,H+仅对反应Ⅰ有催化加速作用;反应Ⅰ速率远大于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。T℃下,在密封石英管内完全充满1.0mol/LHCOOH水溶液,分解产物均完全溶于水中。CO2、CO浓度与反应时间的变化关系如图所示。
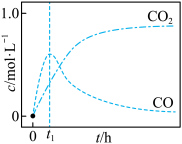
A.反应Ⅰ活化能小于反应Ⅱ
B.反应
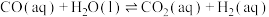
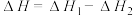
C.混合体系达平衡后:
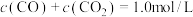
D.若在起始溶液中加入盐酸,则CO达浓度峰值时,
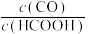 的值与未加盐酸时相同
的值与未加盐酸时相同②保持其它条件不变,若反应起始时溶液中同时还含有0.10mol/L盐酸,请在上图中画出CO的浓度与反应时间的变化关系图
(4)一种由CO2电化学法合成甲酸盐的工作原理如图所示。电极b为
您最近一年使用:0次
名校
解题方法
3 . 资源化利用CO2,不仅可以减少温室气体的排放,还可以获得燃料或重要的化工产品。
(1)CO2的捕集:
①CO2属于___________ 分子(填“极性”或“非极性”),其晶体(干冰)属于__________ 晶体。
②用饱和 溶液做吸收剂可“捕集”CO2。若所得溶液
溶液做吸收剂可“捕集”CO2。若所得溶液 ,溶液中c(HCO
,溶液中c(HCO ):c(CO
):c(CO )=
)=_______ ;(室温下, 的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式
的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式_____ 。
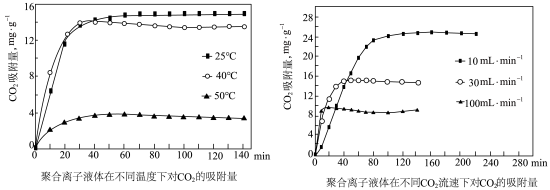
③聚合离子液体是目前广泛研究的CO2吸附剂。结合下图 分析聚合离子液体吸附CO2的有利条件是____________ 。
(2)生产尿素:工业上以CO2、 为原料生产尿素[CO(NH2)2],该反应分为二步进行:
为原料生产尿素[CO(NH2)2],该反应分为二步进行:
第一步: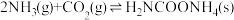
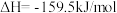
第二步:
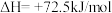
写出上述合成尿素的热化学方程式_______ 。
(3)合成乙酸:中国科学家首次以 、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
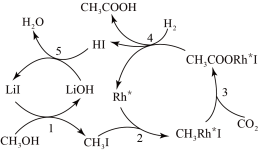
①原料中的 可通过电解法由
可通过电解法由 制取,用稀硫酸作电解质溶液,写出生成
制取,用稀硫酸作电解质溶液,写出生成 的电极反应式:
的电极反应式:____________ 。
②根据图示 ,写出总反应的化学方程式:_______ 。
(1)CO2的捕集:
①CO2属于
②用饱和
 溶液做吸收剂可“捕集”CO2。若所得溶液
溶液做吸收剂可“捕集”CO2。若所得溶液 ,溶液中c(HCO
,溶液中c(HCO ):c(CO
):c(CO )=
)= 的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式
的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式③聚合离子液体是目前广泛研究的CO2吸附剂。

(2)生产尿素:工业上以CO2、
 为原料生产尿素[CO(NH2)2],该反应分为二步进行:
为原料生产尿素[CO(NH2)2],该反应分为二步进行:第一步:
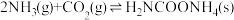
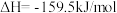
第二步:

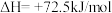
写出上述合成尿素的热化学方程式
(3)合成乙酸:中国科学家首次以
 、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
①原料中的
 可通过电解法由
可通过电解法由 制取,用稀硫酸作电解质溶液,写出生成
制取,用稀硫酸作电解质溶液,写出生成 的电极反应式:
的电极反应式:②
您最近一年使用:0次
2024-04-04更新
|
359次组卷
|
3卷引用:天津市南开中学2020届高三一模化学试卷
解题方法
4 . 燃煤烟气中含有 、CO、
、CO、 等气体,综合利用它们是科研的热点。
等气体,综合利用它们是科研的热点。
(1)已知:




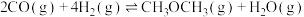

用 、
、 表示
表示 ,
,
___________ 。
(2)气体转化: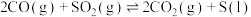
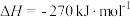 。
。
①相同条件下,分别选取 、NiO、
、NiO、 作上述反应的催化剂时,
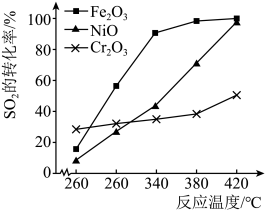
作上述反应的催化剂时, 的转化率随温度的变化如图所示,研究得出应该选择
的转化率随温度的变化如图所示,研究得出应该选择 作催化剂,主要原因可能是
作催化剂,主要原因可能是___________ 。
②若在2L恒容密闭容器中,将3mol CO、1mol 混合,在一定条件下引发反应,当
混合,在一定条件下引发反应,当 的平衡转化率为40%时,此时,K=
的平衡转化率为40%时,此时,K=___________ 。
③向反应容器中再分别通入下列气体,可以使 转化率增大的是
转化率增大的是___________ (填字母)。
a.CO b. c.
c. d.
d.
(3) 利用:密闭容器发生
利用:密闭容器发生 ,其中
,其中 与
与 的浓度均为0.1
的浓度均为0.1 ,在一定条件下反应,测得
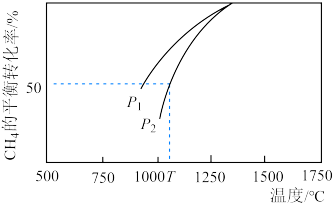
,在一定条件下反应,测得 的平衡转化率与温度及压强的关系如图所示,则压强
的平衡转化率与温度及压强的关系如图所示,则压强
___________  (填“>”或“<”=)。若
(填“>”或“<”=)。若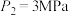 ,则T℃时该反应的平衡常数
,则T℃时该反应的平衡常数
___________  (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4) 捕捉:用100mL 0.1
捕捉:用100mL 0.1
 溶液完全捕捉0.22g
溶液完全捕捉0.22g  气体(溶液体积不变),所得溶液中
气体(溶液体积不变),所得溶液中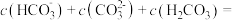
___________  ,此时溶液pH=a,
,此时溶液pH=a,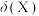 [分布系数(即含碳粒子组分的平衡浓度占含碳粒子总浓度的分数)],则
[分布系数(即含碳粒子组分的平衡浓度占含碳粒子总浓度的分数)],则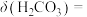
___________ (用含a、b、c的式子表示)。(已知 的两步电离常数
的两步电离常数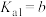 ,
,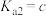 )
)
 、CO、
、CO、 等气体,综合利用它们是科研的热点。
等气体,综合利用它们是科研的热点。(1)已知:




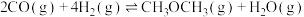

用
 、
、 表示
表示 ,
,
(2)气体转化:
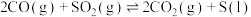
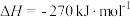 。
。①相同条件下,分别选取
 、NiO、
、NiO、 作上述反应的催化剂时,
作上述反应的催化剂时, 的转化率随温度的变化如图所示,研究得出应该选择
的转化率随温度的变化如图所示,研究得出应该选择 作催化剂,主要原因可能是
作催化剂,主要原因可能是
②若在2L恒容密闭容器中,将3mol CO、1mol
 混合,在一定条件下引发反应,当
混合,在一定条件下引发反应,当 的平衡转化率为40%时,此时,K=
的平衡转化率为40%时,此时,K=③向反应容器中再分别通入下列气体,可以使
 转化率增大的是
转化率增大的是a.CO b.
 c.
c. d.
d.
(3)
 利用:密闭容器发生
利用:密闭容器发生 ,其中
,其中 与
与 的浓度均为0.1
的浓度均为0.1 ,在一定条件下反应,测得
,在一定条件下反应,测得 的平衡转化率与温度及压强的关系如图所示,则压强
的平衡转化率与温度及压强的关系如图所示,则压强
 (填“>”或“<”=)。若
(填“>”或“<”=)。若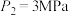 ,则T℃时该反应的平衡常数
,则T℃时该反应的平衡常数
 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)
 捕捉:用100mL 0.1
捕捉:用100mL 0.1
 溶液完全捕捉0.22g
溶液完全捕捉0.22g  气体(溶液体积不变),所得溶液中
气体(溶液体积不变),所得溶液中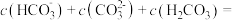
 ,此时溶液pH=a,
,此时溶液pH=a,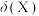 [分布系数(即含碳粒子组分的平衡浓度占含碳粒子总浓度的分数)],则
[分布系数(即含碳粒子组分的平衡浓度占含碳粒子总浓度的分数)],则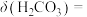
 的两步电离常数
的两步电离常数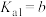 ,
,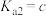 )
)
您最近一年使用:0次
5 . 天津地处环渤海湾,海水资源丰富。科研人员把铁的配合物 (L为配体)溶于弱碱性的海水中,制成吸收液,将气体
(L为配体)溶于弱碱性的海水中,制成吸收液,将气体 转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:①
转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:① 的吸收氧化;②
的吸收氧化;② 的再生。反应原理如下:
的再生。反应原理如下:
①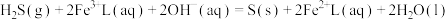
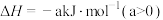
②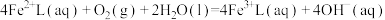
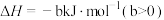
回答下列问题:
(1)该工艺的总反应方程式为___________ 。1mol 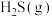 发生该反应的热量变化为
发生该反应的热量变化为___________ , 在总反应中的作用是
在总反应中的作用是___________ 。
(2)研究不同配体与 所形成的配合物(A、B、C)对
所形成的配合物(A、B、C)对 吸收转化率的影响。将配合物A、B、C分别溶于海水中,配成相同物质的量浓度的吸收液,在相同反应条件下,分别向三份吸收液持续通入
吸收转化率的影响。将配合物A、B、C分别溶于海水中,配成相同物质的量浓度的吸收液,在相同反应条件下,分别向三份吸收液持续通入 ,测得单位体积吸收液中
,测得单位体积吸收液中 吸收转化率
吸收转化率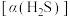 随时间变化的曲线如图1所示。以
随时间变化的曲线如图1所示。以 由100%降至80%所持续的时间来评价铁配合物的脱硫效率,结果最好的是
由100%降至80%所持续的时间来评价铁配合物的脱硫效率,结果最好的是___________ (填“A”、“B”或“C”)。 的电离方程式为
的电离方程式为___________ 。25℃时, 溶液中
溶液中 、
、 、
、 在含硫粒子总浓度中所占分数
在含硫粒子总浓度中所占分数 随溶液pH的变化关系如图2,由图2计算,
随溶液pH的变化关系如图2,由图2计算, 的
的
___________ ,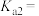
___________ 。再生反应在常温下进行,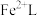 解离出的
解离出的 易与溶液中的
易与溶液中的 形成沉淀。若溶液中的
形成沉淀。若溶液中的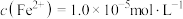 ,
,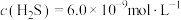 ,为避免有FeS沉淀生成,应控制溶液pH不大于
,为避免有FeS沉淀生成,应控制溶液pH不大于___________ (已知25℃时,FeS的 为
为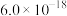 )。
)。
 (L为配体)溶于弱碱性的海水中,制成吸收液,将气体
(L为配体)溶于弱碱性的海水中,制成吸收液,将气体 转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:①
转化为单质硫,改进了湿法脱硫工艺。该工艺包含两个阶段:① 的吸收氧化;②
的吸收氧化;② 的再生。反应原理如下:
的再生。反应原理如下:①
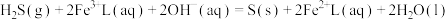
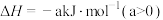
②
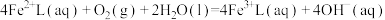
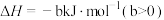
回答下列问题:
(1)该工艺的总反应方程式为
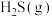 发生该反应的热量变化为
发生该反应的热量变化为 在总反应中的作用是
在总反应中的作用是(2)研究不同配体与
 所形成的配合物(A、B、C)对
所形成的配合物(A、B、C)对 吸收转化率的影响。将配合物A、B、C分别溶于海水中,配成相同物质的量浓度的吸收液,在相同反应条件下,分别向三份吸收液持续通入
吸收转化率的影响。将配合物A、B、C分别溶于海水中,配成相同物质的量浓度的吸收液,在相同反应条件下,分别向三份吸收液持续通入 ,测得单位体积吸收液中
,测得单位体积吸收液中 吸收转化率
吸收转化率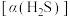 随时间变化的曲线如图1所示。以
随时间变化的曲线如图1所示。以 由100%降至80%所持续的时间来评价铁配合物的脱硫效率,结果最好的是
由100%降至80%所持续的时间来评价铁配合物的脱硫效率,结果最好的是
 的电离方程式为
的电离方程式为 溶液中
溶液中 、
、 、
、 在含硫粒子总浓度中所占分数
在含硫粒子总浓度中所占分数 随溶液pH的变化关系如图2,由图2计算,
随溶液pH的变化关系如图2,由图2计算, 的
的
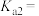
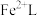 解离出的
解离出的 易与溶液中的
易与溶液中的 形成沉淀。若溶液中的
形成沉淀。若溶液中的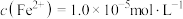 ,
,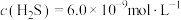 ,为避免有FeS沉淀生成,应控制溶液pH不大于
,为避免有FeS沉淀生成,应控制溶液pH不大于 为
为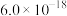 )。
)。
您最近一年使用:0次
2023-03-16更新
|
5679次组卷
|
11卷引用:2022年天津市普通高中学业水平等级性考试化学试题
2022年天津市普通高中学业水平等级性考试化学试题2022年天津高考化学真题(已下线)2022年天津市普通高中学业水平等级性考试化学试题变式题(原理综合题)天津市耀华中学2023-2024学年高三上学期第一次月考化学试题(已下线)专题17 原理综合题(已下线)专题17 原理综合题(已下线)第20练 化学反应原理综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)【知识图鉴】单元讲练测选择性必修1第3单元03巩固练(已下线)2023年广东卷高考真题变式题(原理综合题)(已下线)T19-原理综合题(已下线)提升练09 化学反应原理综合-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
名校
6 . 氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。
(1) 为淡棕黄色气体,可由新制的HgO和
为淡棕黄色气体,可由新制的HgO和 反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。
反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。
① 电子式
电子式___________ , 分子属于
分子属于___________ (填“极性”或“非极性”)分子,该分子中心原子杂化轨道类型___________ 。
②写出制备 的化学方程式
的化学方程式___________ 。
(2) 气体可处理污水中的
气体可处理污水中的 。
。 与
与 反应产生2种无毒气体,反应中氧化剂和还原剂物质的量之比为
反应产生2种无毒气体,反应中氧化剂和还原剂物质的量之比为___________ 。
(3)一定条件下,在水溶液中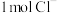 、
、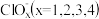 的能量(kJ)相对大小如图1所示。
的能量(kJ)相对大小如图1所示。
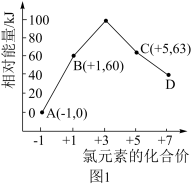
①D是___________ (填离子符号)。
②用离子符号表示B→A+C的热化学方程式___________ 。
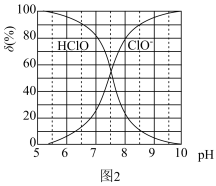
(4)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数 ,X为HClO或
,X为HClO或 与pH的关系如图2所示。HClO的电离常数
与pH的关系如图2所示。HClO的电离常数 值为
值为___________ 。
(5)以下是 的两种制备方法:方法一:
的两种制备方法:方法一: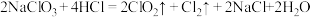
方法二: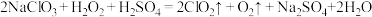
方法二制备的 更适合用于饮用水的消毒,其主要原因是
更适合用于饮用水的消毒,其主要原因是___________ 。
(1)
 为淡棕黄色气体,可由新制的HgO和
为淡棕黄色气体,可由新制的HgO和 反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。
反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。①
 电子式
电子式 分子属于
分子属于②写出制备
 的化学方程式
的化学方程式(2)
 气体可处理污水中的
气体可处理污水中的 。
。 与
与 反应产生2种无毒气体,反应中氧化剂和还原剂物质的量之比为
反应产生2种无毒气体,反应中氧化剂和还原剂物质的量之比为(3)一定条件下,在水溶液中
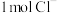 、
、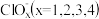 的能量(kJ)相对大小如图1所示。
的能量(kJ)相对大小如图1所示。
①D是
②用离子符号表示B→A+C的热化学方程式
(4)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数
 ,X为HClO或
,X为HClO或 与pH的关系如图2所示。HClO的电离常数
与pH的关系如图2所示。HClO的电离常数 值为
值为
(5)以下是
 的两种制备方法:方法一:
的两种制备方法:方法一: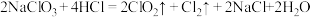
方法二:
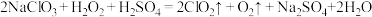
方法二制备的
 更适合用于饮用水的消毒,其主要原因是
更适合用于饮用水的消毒,其主要原因是
您最近一年使用:0次
2022-04-25更新
|
585次组卷
|
3卷引用:天津市部分区2022届高三质量调查(一)化学试题
解答题-原理综合题
|
适中(0.65)
|
名校
解题方法
7 . 碳排放是2020年世界重点议题,回答下列问题:
(1)已知CO分子中化学键为C ≡O。相关的化学键键能数据如下:
则CO(g) +H2O(g) CO2(g) +H2(g) △H=
CO2(g) +H2(g) △H=_______ kJ·mol-1。
(2)CO2(g) +H2(g) CO(g) +H2O(g)正反应的平衡常数K正和逆反应的平衡常数K逆随温度变化曲线如图
CO(g) +H2O(g)正反应的平衡常数K正和逆反应的平衡常数K逆随温度变化曲线如图

①表示K正曲线的为_______ (填“I”或“II”)。
②T1时,向体积为10L的固定容积的容器中充入2 mol CO2、2 mol H2,CO2的平衡转化率为_______ 。
③T2时,A点 正
正_______  逆 (填“>”“=”或“<”)。
逆 (填“>”“=”或“<”)。
(3)二氧化碳催化加氢合成低碳烯烃是目前研究的热门课题,起始时以0. 1MPa,n(H2):n(CO2)=3:1的投料比充入反应器中,发生反应:2CO2(g) + 6H2(g) C2H4(g) +4H2O(g) △H ,不同温度下平衡时的四种气态物质的物质的量如图所示:
C2H4(g) +4H2O(g) △H ,不同温度下平衡时的四种气态物质的物质的量如图所示:

①曲线b表示的物质为_______ (写化学式)。
②该反应的ΔH_______ 0。(填“>”或“<”)
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是_______ (列举1项)。
(4)乙二酸(H2C2O4)是一种含碳有机二元酸,25℃时,其Ka1=5.6 ×10-2,Ka2=5.4×10-5,向0.1mol·L-1乙二酸溶液中滴加NaOH至c(HC2O )=c(C2O
)=c(C2O ),此时溶液c(H+)=
),此时溶液c(H+)=_______ 。
(1)已知CO分子中化学键为C ≡O。相关的化学键键能数据如下:
| 化学键 | H-O | C≡O | C=O | H-H |
| E/(kJ·mol-1) | 463 | 1075 | 803 | 436 |
则CO(g) +H2O(g)
 CO2(g) +H2(g) △H=
CO2(g) +H2(g) △H=(2)CO2(g) +H2(g)
 CO(g) +H2O(g)正反应的平衡常数K正和逆反应的平衡常数K逆随温度变化曲线如图
CO(g) +H2O(g)正反应的平衡常数K正和逆反应的平衡常数K逆随温度变化曲线如图 
①表示K正曲线的为
②T1时,向体积为10L的固定容积的容器中充入2 mol CO2、2 mol H2,CO2的平衡转化率为
③T2时,A点
 正
正 逆 (填“>”“=”或“<”)。
逆 (填“>”“=”或“<”)。(3)二氧化碳催化加氢合成低碳烯烃是目前研究的热门课题,起始时以0. 1MPa,n(H2):n(CO2)=3:1的投料比充入反应器中,发生反应:2CO2(g) + 6H2(g)
 C2H4(g) +4H2O(g) △H ,不同温度下平衡时的四种气态物质的物质的量如图所示:
C2H4(g) +4H2O(g) △H ,不同温度下平衡时的四种气态物质的物质的量如图所示:
①曲线b表示的物质为
②该反应的ΔH
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是
(4)乙二酸(H2C2O4)是一种含碳有机二元酸,25℃时,其Ka1=5.6 ×10-2,Ka2=5.4×10-5,向0.1mol·L-1乙二酸溶液中滴加NaOH至c(HC2O
 )=c(C2O
)=c(C2O ),此时溶液c(H+)=
),此时溶液c(H+)=
您最近一年使用:0次
2022-04-16更新
|
336次组卷
|
2卷引用:天津市宁河区芦台第一中学2022届高三下学期线上模拟(一)化学试题
8 . 弱电解质的电离平衡、盐类的水解平衡均属于化学平衡。根据要求回答问题:
(1)铝盐的水解原理在生活中应用广泛,如明矾常作净水剂,其净水的原理是___________ (用离子方程式表示);如硫酸铝常作泡沫灭火器原料之一,其原理是___________ (用离子方程式表示)
(2)在氯化铜晶体(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其溶于水后加少量盐酸配制成水溶液,然后按下图所示的操作步骤进行提纯。
已知:在pH=4~5时,Cu2+、Fe2+不水解,而Fe3+几乎完全水解而沉淀
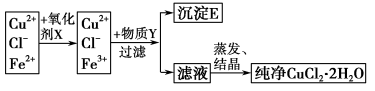
回答下列问题:
①下列物质都可以作为氧化剂,其中适合本实验的X是___________ (填字母)
A.H2O2 B.KMnO4 C.氯水 D.K2Cr2O7
②加入Y调节溶液的pH至4~5,物质Y可能是___________ (填字母)
A.氨水 B.Cu C.Cu(OH)2 D.CuO
③欲将CuCl2·2H2O加热制得无水CuCl2,可在HCl气氛下蒸发,否则得不到纯净CuCl2固体,试用简要的文字和相应化学方程式解释这样操作的原因:___
(3)常温下,浓度均为0.1mol·L-1的六种溶液的pH如下表:
①上述盐溶液中的阴离子,结合质子能力最强的是______
②根据表中数据,浓度均为0.01mol·L-1的下列五种物质的溶液中,酸性最强的是___________ (填字母);将各溶液分别稀释100倍,pH变化最小的是___________ (填字母)
A.HCN B.HClO C.H2SO4 D.CH3COOH E.H2CO3
③向NaClO溶液中通入少量二氧化碳气体,写出发生反应的离子方程式___________
(1)铝盐的水解原理在生活中应用广泛,如明矾常作净水剂,其净水的原理是
(2)在氯化铜晶体(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其溶于水后加少量盐酸配制成水溶液,然后按下图所示的操作步骤进行提纯。
已知:在pH=4~5时,Cu2+、Fe2+不水解,而Fe3+几乎完全水解而沉淀

回答下列问题:
①下列物质都可以作为氧化剂,其中适合本实验的X是
A.H2O2 B.KMnO4 C.氯水 D.K2Cr2O7
②加入Y调节溶液的pH至4~5,物质Y可能是
A.氨水 B.Cu C.Cu(OH)2 D.CuO
③欲将CuCl2·2H2O加热制得无水CuCl2,可在HCl气氛下蒸发,否则得不到纯净CuCl2固体,试用简要的文字和相应化学方程式解释这样操作的原因:
(3)常温下,浓度均为0.1mol·L-1的六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | Na2SO4 |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 7.0 |
①上述盐溶液中的阴离子,结合质子能力最强的是
②根据表中数据,浓度均为0.01mol·L-1的下列五种物质的溶液中,酸性最强的是
A.HCN B.HClO C.H2SO4 D.CH3COOH E.H2CO3
③向NaClO溶液中通入少量二氧化碳气体,写出发生反应的离子方程式
您最近一年使用:0次
名校
解题方法
9 . 氮、磷、砷及其化合物在工农业生产等方面有着重要应用。请按要求回答下列问题。
(1)基态砷原子价电子排布图不能写为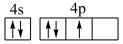 ,是因为该排布方式违背了
,是因为该排布方式违背了___________ 这一原理。
(2)元素第一电离能N___________ P(填“ ”或“
”或“ ”或“
”或“ ”,下同),电负性P
”,下同),电负性P___________ As。
(3)腓( )可用作火箭燃料等,它的沸点远高于乙烯的原因是
)可用作火箭燃料等,它的沸点远高于乙烯的原因是___________ 。
(4)尿素(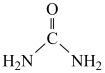 )和
)和 在酸性环境下生成
在酸性环境下生成 、
、 和
和 ,该反应的离子方程式为
,该反应的离子方程式为___________ ; 离子的立体构型(即空间构型)为
离子的立体构型(即空间构型)为___________ 。
(5)GaAs的熔点为1238℃可作半导体材料;而 的熔点为77.9℃。
的熔点为77.9℃。
①预测 的晶体类型为
的晶体类型为___________ 。
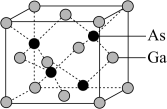
②GaAs晶胞结构如图所示,晶胞边长为a pm。则晶胞中每个Ga原子周围有____ 个紧邻等距的As原子;该晶体的密度为___________  (列出计算式)。
(列出计算式)。
(6)亚砷酸( )可以用于治疗白血病。其在溶液中存在多种微粒形态,将KOH溶液滴入亚砷酸溶液,各种微粒物质的量分数与溶液的pH关系如图所示。
)可以用于治疗白血病。其在溶液中存在多种微粒形态,将KOH溶液滴入亚砷酸溶液,各种微粒物质的量分数与溶液的pH关系如图所示。
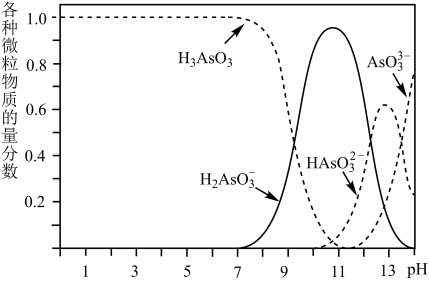
①人体血液的pH在7.35-7.45之间,患者用药后人体中含As元素的主要微粒是___________ 。
② 的第一电离常数
的第一电离常数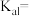
___________ 。
(1)基态砷原子价电子排布图不能写为
 ,是因为该排布方式违背了
,是因为该排布方式违背了(2)元素第一电离能N
 ”或“
”或“ ”或“
”或“ ”,下同),电负性P
”,下同),电负性P(3)腓(
 )可用作火箭燃料等,它的沸点远高于乙烯的原因是
)可用作火箭燃料等,它的沸点远高于乙烯的原因是(4)尿素(
 )和
)和 在酸性环境下生成
在酸性环境下生成 、
、 和
和 ,该反应的离子方程式为
,该反应的离子方程式为 离子的立体构型(即空间构型)为
离子的立体构型(即空间构型)为(5)GaAs的熔点为1238℃可作半导体材料;而
 的熔点为77.9℃。
的熔点为77.9℃。①预测
 的晶体类型为
的晶体类型为②GaAs晶胞结构如图所示,晶胞边长为a pm。则晶胞中每个Ga原子周围有
 (列出计算式)。
(列出计算式)。
(6)亚砷酸(
 )可以用于治疗白血病。其在溶液中存在多种微粒形态,将KOH溶液滴入亚砷酸溶液,各种微粒物质的量分数与溶液的pH关系如图所示。
)可以用于治疗白血病。其在溶液中存在多种微粒形态,将KOH溶液滴入亚砷酸溶液,各种微粒物质的量分数与溶液的pH关系如图所示。
①人体血液的pH在7.35-7.45之间,患者用药后人体中含As元素的主要微粒是
②
 的第一电离常数
的第一电离常数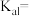
您最近一年使用:0次
2021-04-29更新
|
419次组卷
|
3卷引用:天津市河西区2021届高三下学期总复习质量调查(二)化学试题
名校
解题方法
10 . 已知部分弱酸的电离平衡常数如下表,根据表中数据回答下列问题。
(1)已知某浓度的NaCN 水溶液 pH=8,原因是___________ (用离子方程式表示),pH=8 的NaCN 溶液中,由水电离出的 OH-浓度为___________ 。
(2)同浓度 HCOONa、NaCN、NaHCO3、Na2CO3 这 4 种溶液中碱性由强到弱的顺序是___________ ; NaHCO3 溶液中各离子浓度由大到小的顺序是___________ 。
(3)体积相同、c(H+)相同的三种酸溶液 a.HCOOH;b.HCN;c.HCl 分别与同浓度的 NaOH 溶液完全中和,消耗 NaOH 溶液的体积由大到小的排列顺序是(填字母)___________ 。
(4)电解法转化 CO2 可实现 CO2 资源化利用。电解 CO2 制甲酸(HCOOH)的原理示意图如下:(已知 HCOOH 中 C 的化合价为+2 价)

请回答:
①a 端连电源的___________ 极。
②甲池中放出的气体是___________ ;电解过程中,产生 HCOO-电极反应式为:___________ ; 电路中转移 0.1mol 电子,理论上需消耗 CO2___________ L(标准状况)。
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常(25℃) | Ka=1.77104 | Ka=5.01010 | Ka1= 4.3107 Ka2= 5.61011 |
(2)同浓度 HCOONa、NaCN、NaHCO3、Na2CO3 这 4 种溶液中碱性由强到弱的顺序是
(3)体积相同、c(H+)相同的三种酸溶液 a.HCOOH;b.HCN;c.HCl 分别与同浓度的 NaOH 溶液完全中和,消耗 NaOH 溶液的体积由大到小的排列顺序是(填字母)
(4)电解法转化 CO2 可实现 CO2 资源化利用。电解 CO2 制甲酸(HCOOH)的原理示意图如下:(已知 HCOOH 中 C 的化合价为+2 价)

请回答:
①a 端连电源的
②甲池中放出的气体是
您最近一年使用:0次
2021-03-05更新
|
188次组卷
|
3卷引用:天津市第三中学2022-2023学年高三上学期12月月考化学试题
天津市第三中学2022-2023学年高三上学期12月月考化学试题江西省上饶市横峰中学2020-2021学年高二下学期入学考试(统招班)化学试题(已下线)2021年高考化学押题预测卷(新课标Ⅲ卷)(03)(含考试版、答题卡、参考答案、全解全析)



