名校
解题方法
1 . 资源化利用CO2,不仅可以减少温室气体的排放,还可以获得燃料或重要的化工产品。
(1)CO2的捕集:
①CO2属于___________ 分子(填“极性”或“非极性”),其晶体(干冰)属于__________ 晶体。
②用饱和 溶液做吸收剂可“捕集”CO2。若所得溶液
溶液做吸收剂可“捕集”CO2。若所得溶液 ,溶液中c(HCO
,溶液中c(HCO ):c(CO
):c(CO )=
)=_______ ;(室温下, 的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式
的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式_____ 。
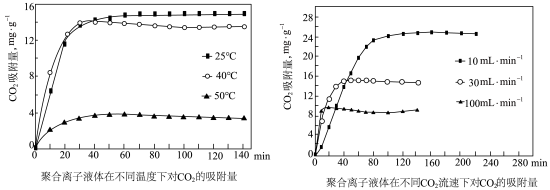
③聚合离子液体是目前广泛研究的CO2吸附剂。结合下图 分析聚合离子液体吸附CO2的有利条件是____________ 。
(2)生产尿素:工业上以CO2、 为原料生产尿素[CO(NH2)2],该反应分为二步进行:
为原料生产尿素[CO(NH2)2],该反应分为二步进行:
第一步: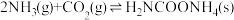
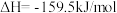
第二步:
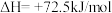
写出上述合成尿素的热化学方程式_______ 。
(3)合成乙酸:中国科学家首次以 、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
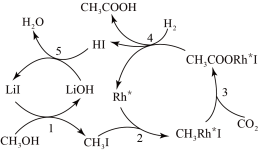
①原料中的 可通过电解法由
可通过电解法由 制取,用稀硫酸作电解质溶液,写出生成
制取,用稀硫酸作电解质溶液,写出生成 的电极反应式:
的电极反应式:____________ 。
②根据图示 ,写出总反应的化学方程式:_______ 。
(1)CO2的捕集:
①CO2属于
②用饱和
 溶液做吸收剂可“捕集”CO2。若所得溶液
溶液做吸收剂可“捕集”CO2。若所得溶液 ,溶液中c(HCO
,溶液中c(HCO ):c(CO
):c(CO )=
)= 的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式
的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式③聚合离子液体是目前广泛研究的CO2吸附剂。

(2)生产尿素:工业上以CO2、
 为原料生产尿素[CO(NH2)2],该反应分为二步进行:
为原料生产尿素[CO(NH2)2],该反应分为二步进行:第一步:
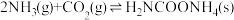
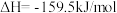
第二步:

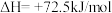
写出上述合成尿素的热化学方程式
(3)合成乙酸:中国科学家首次以
 、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
①原料中的
 可通过电解法由
可通过电解法由 制取,用稀硫酸作电解质溶液,写出生成
制取,用稀硫酸作电解质溶液,写出生成 的电极反应式:
的电极反应式:②
您最近一年使用:0次
2024-04-04更新
|
359次组卷
|
3卷引用:辽宁省实验中学2024届高三高考适应性测试(二)化学试题
名校
解题方法
2 . 盐湖卤水(主要含Na+、Mg2+、Li+、Cl-、 和硼酸根等)是锂盐的重要来源。一种以高镁卤水为原料经两段除镁制备
和硼酸根等)是锂盐的重要来源。一种以高镁卤水为原料经两段除镁制备 的工艺流程如图:
的工艺流程如图:
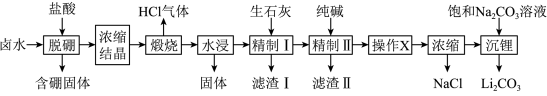
已知:常温下, 。相关化合物的溶解度与温度的关系如图所示。
。相关化合物的溶解度与温度的关系如图所示。

回答下列问题:
(1)含硼固体中的B(OH)3在水中存在平衡: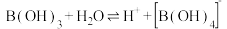 (常温下,
(常温下, );B(OH)3与
);B(OH)3与 溶液反应可制备硼砂
溶液反应可制备硼砂 。常温下,在
。常温下,在 硼砂溶液中,
硼砂溶液中,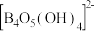 水解生成等物质的量浓度的B(OH)3和
水解生成等物质的量浓度的B(OH)3和 ,该水解反应的离子方程式为
,该水解反应的离子方程式为___________ ,该溶液pH=___________ 。
(2)滤渣Ⅰ的主要成分是___________ (填化学式);精制Ⅰ后溶液中Li+浓度为 ,则常温下精制Ⅱ过程中
,则常温下精制Ⅱ过程中 浓度应控制在
浓度应控制在___________  以下。若脱硼后直接进行精制Ⅰ,除无法回收HCl外,还将增加
以下。若脱硼后直接进行精制Ⅰ,除无法回收HCl外,还将增加___________ 的用量(填化学式)。
(3)精制Ⅱ的目的是___________ ;进行操作X时应选择的试剂是___________ 。
 和硼酸根等)是锂盐的重要来源。一种以高镁卤水为原料经两段除镁制备
和硼酸根等)是锂盐的重要来源。一种以高镁卤水为原料经两段除镁制备 的工艺流程如图:
的工艺流程如图:
已知:常温下,
 。相关化合物的溶解度与温度的关系如图所示。
。相关化合物的溶解度与温度的关系如图所示。 
回答下列问题:
(1)含硼固体中的B(OH)3在水中存在平衡:
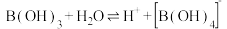 (常温下,
(常温下, );B(OH)3与
);B(OH)3与 溶液反应可制备硼砂
溶液反应可制备硼砂 。常温下,在
。常温下,在 硼砂溶液中,
硼砂溶液中,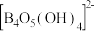 水解生成等物质的量浓度的B(OH)3和
水解生成等物质的量浓度的B(OH)3和 ,该水解反应的离子方程式为
,该水解反应的离子方程式为(2)滤渣Ⅰ的主要成分是
 ,则常温下精制Ⅱ过程中
,则常温下精制Ⅱ过程中 浓度应控制在
浓度应控制在 以下。若脱硼后直接进行精制Ⅰ,除无法回收HCl外,还将增加
以下。若脱硼后直接进行精制Ⅰ,除无法回收HCl外,还将增加(3)精制Ⅱ的目的是
您最近一年使用:0次
2024-03-14更新
|
593次组卷
|
2卷引用:辽宁省沈阳市东北育才学校2023-2024学年高三下学期第六次模拟考试化学试卷
名校
3 . 二氧化碳的捕获、利用是实现碳中和的一个重要战略方向。回答下列问题:
(1)已知:常温下,反应CaO(s)+CO2(g) CaCO3(s)能自发进行。则该反应为
CaCO3(s)能自发进行。则该反应为____ (填“吸热”或“放热”)反应;上述反应达到平衡后,若其他条件不变,增大CaO的用量,CO2的转化率将____ (填“增大”“减小”或“不变”)。
(2)工业上以CO2和H2为原料合成CH3OH涉及的主要反应如下:
反应I.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49kJ·mol-1
反应II.CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41kJ·mol-1
CO(g)+H2O(g) △H2=+41kJ·mol-1
①将反应物混合气按进料比n(CO2):n(H2)=1:3通入反应装置,选择合适的催化剂发生反应。
不同温度和压强下,CH3OH平衡产率如图所示。则图中的压强p1____ (填“>”“=”或“<”)p2,推断的依据是____ 。
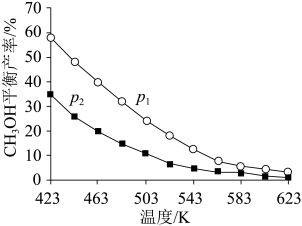
②T℃时,在体积为V的密闭容器中,反应I、II均达到化学平衡,CO2转化率为25%,且生成等物质的量的CH3OH和CO,则该温度下反应II的平衡常数的值为_____ (用分数表示)。
(3)调节溶液pH可实现工业废气中CO2的捕获和释放。已知20℃时碳酸的电离常数为Ka1、Ka2,当溶液pH=11时,c(H2CO3):c(HCO ):c(CO
):c(CO )=1:
)=1:____ :____ 。(用Ka1、Ka2表示)
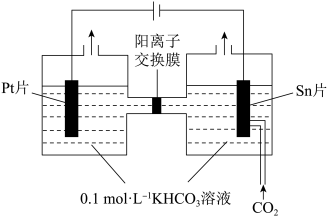
(4)电解CO2制HCOOH的原理如图所示,写出在Sn片上发生的电极反应式:____ 。
(1)已知:常温下,反应CaO(s)+CO2(g)
 CaCO3(s)能自发进行。则该反应为
CaCO3(s)能自发进行。则该反应为(2)工业上以CO2和H2为原料合成CH3OH涉及的主要反应如下:
反应I.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-49kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49kJ·mol-1反应II.CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41kJ·mol-1
CO(g)+H2O(g) △H2=+41kJ·mol-1①将反应物混合气按进料比n(CO2):n(H2)=1:3通入反应装置,选择合适的催化剂发生反应。
不同温度和压强下,CH3OH平衡产率如图所示。则图中的压强p1

②T℃时,在体积为V的密闭容器中,反应I、II均达到化学平衡,CO2转化率为25%,且生成等物质的量的CH3OH和CO,则该温度下反应II的平衡常数的值为
(3)调节溶液pH可实现工业废气中CO2的捕获和释放。已知20℃时碳酸的电离常数为Ka1、Ka2,当溶液pH=11时,c(H2CO3):c(HCO
 ):c(CO
):c(CO )=1:
)=1:(4)电解CO2制HCOOH的原理如图所示,写出在Sn片上发生的电极反应式:

您最近一年使用:0次
2022-07-14更新
|
109次组卷
|
3卷引用:辽宁省朝阳市建平县2021-2022学年高二下学期期末考试化学试题
4 . 碳酸锶(SrCO3)难溶于水,主要用于电磁材料和金属冶炼。一种由工业碳酸锶(含少量Ba2+、Ca2+、Mg2+、 Pb2+等)制备高纯碳酸锶的工艺流程如下:
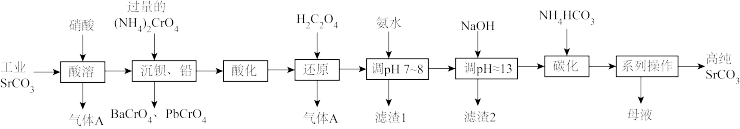
已知:I. Cr(OH)3为两性氢氧化物;
II.常温下,各物质的溶度积常数如下表所示。
回答下列问题:
(1)气体A的电子式为_______ 。
(2)“除钡、铅”时,pH过低会导致(NH4)2CrO4的利用率降低,原因为_______ (用离子方程式解释);“还原”时发生反应的离子方程式为_______ 。
(3)“滤渣1”的主要成分为_______ (填化学式)。
(4)用氨水和NaOH分步调节pH,而不是直接调节溶液的pH≈13的原因为_______ 。
(5)“调pH ≈13”后需对溶液进行煮沸并趁热过滤出滤渣2,煮沸并趁热过滤的原因为_______ 。
(6)已知:碳酸的电离常数Ka1=4.4×10-7、Ka2=4.7×10-11,则“碳化”时,反应Sr2+(aq)+2HCO (aq)
(aq) SrCO3(s)+H2CO3(aq)的平衡常数K=
SrCO3(s)+H2CO3(aq)的平衡常数K=_______ (保留两位有效数字)。
(7)“系列操作”中包含“200°C烘干”操作,烘干过程中除蒸发水分外,还能够除去SrCO3中的微量可溶性杂质,该杂质除NH4HCO3外还可能为_______ (填化学式)。

已知:I. Cr(OH)3为两性氢氧化物;
II.常温下,各物质的溶度积常数如下表所示。
| 化合物 | Cr(OH)3 | Ca(OH)2 | Mg(OH)2 | SrCO3 |
| Ksp近似值 | 1×10-31 | 5.5×10-6 | 1.8×10-11 | 5.6×10-10 |
(1)气体A的电子式为
(2)“除钡、铅”时,pH过低会导致(NH4)2CrO4的利用率降低,原因为
(3)“滤渣1”的主要成分为
(4)用氨水和NaOH分步调节pH,而不是直接调节溶液的pH≈13的原因为
(5)“调pH ≈13”后需对溶液进行煮沸并趁热过滤出滤渣2,煮沸并趁热过滤的原因为
(6)已知:碳酸的电离常数Ka1=4.4×10-7、Ka2=4.7×10-11,则“碳化”时,反应Sr2+(aq)+2HCO
 (aq)
(aq) SrCO3(s)+H2CO3(aq)的平衡常数K=
SrCO3(s)+H2CO3(aq)的平衡常数K=(7)“系列操作”中包含“200°C烘干”操作,烘干过程中除蒸发水分外,还能够除去SrCO3中的微量可溶性杂质,该杂质除NH4HCO3外还可能为
您最近一年使用:0次
2022-04-09更新
|
1200次组卷
|
13卷引用:辽宁省抚顺市第二中学2021-2022学年高三上学期10月月考化学试题
辽宁省抚顺市第二中学2021-2022学年高三上学期10月月考化学试题河北省石家庄市2022届高三毕业班教学质量检测二(一模)化学试题(已下线)秘籍17 工艺流程的条件控制与计算-备战2022年高考化学抢分秘籍(全国通用)(已下线)专项15 工艺流程综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)(已下线)化学-2022年高考押题预测卷01(山东卷)(已下线)化学-2022年高考考前押题密卷(湖南卷)(已下线)化学-2022年高考考前押题密卷(重庆卷)湖北省宜昌市夷陵中学2022届高三5月第二次限时训练(四模)化学试题山东省鄄城县第一中学2022-2023学年高二上学期期末考试化学试题湖北省宜昌英杰学校2021-2022学年高三上学期9月月考化学试题湖南省株洲市九方中学2022-2023学年高三上学期第一次月考化学试题(已下线)河北省石家庄市2022届高三毕业班教学质量检测二(一模)(工业流程题)湖南省邵阳市第一中学2023届高三第五次月考化学试题
5 .  是一种廉价的碳资源,其综合利用可以减少碳排放,对保护环境有重要意义。
是一种廉价的碳资源,其综合利用可以减少碳排放,对保护环境有重要意义。
(1)碱液吸收。室温下用NaOH溶液捕获 ,若所得溶液中
,若所得溶液中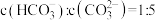 ,则溶液pH=
,则溶液pH=_______ (室温下, 的电离常数:
的电离常数: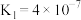
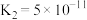 )
)
(2)催化转化。以 、
、 为原料在催化剂作用下合成
为原料在催化剂作用下合成 涉及的主要反应如下。
涉及的主要反应如下。
Ⅰ.
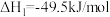
Ⅱ.
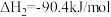
Ⅲ.

回答下列问题:
①
_______ kJ/mol;Ⅰ、Ⅲ两个反应在热力学上趋势较大的是_______ (填Ⅰ或Ⅲ)。
②反应Ⅱ的反应历程如下图,其中吸附在催化剂表面上的物种用*标注。
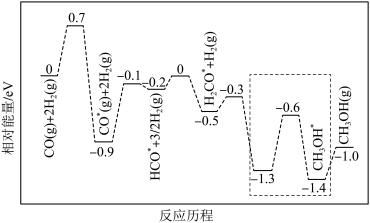
该反应历程中决速步的能垒为_______ eV,虚线框内发生的反应达到平衡后,升高温度,正反应速率_______ (填“大于”“小于”或“等于”)逆反应速率。
③不同压强下,按照 投料,实验测定
投料,实验测定 的平衡转化率(X)随温度(T)的变化关系如图所示。
的平衡转化率(X)随温度(T)的变化关系如图所示。
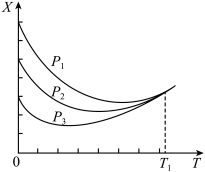
压强 、
、 、
、 由大到小的顺序为
由大到小的顺序为_______ ;温度高于 时,X几乎相等的原因是
时,X几乎相等的原因是_______ 。
(3)250℃,一定压强和催化剂条件下,1.32mol 和3.96mol
和3.96mol 充分反应,平衡时CO为0.03mol,
充分反应,平衡时CO为0.03mol, 为0.41mol,试求反应Ⅲ的平衡常数
为0.41mol,试求反应Ⅲ的平衡常数_______ (结果保留两位有效数字)。
 是一种廉价的碳资源,其综合利用可以减少碳排放,对保护环境有重要意义。
是一种廉价的碳资源,其综合利用可以减少碳排放,对保护环境有重要意义。(1)碱液吸收。室温下用NaOH溶液捕获
 ,若所得溶液中
,若所得溶液中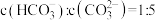 ,则溶液pH=
,则溶液pH= 的电离常数:
的电离常数: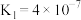
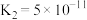 )
)(2)催化转化。以
 、
、 为原料在催化剂作用下合成
为原料在催化剂作用下合成 涉及的主要反应如下。
涉及的主要反应如下。Ⅰ.

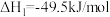
Ⅱ.

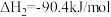
Ⅲ.


回答下列问题:
①

②反应Ⅱ的反应历程如下图,其中吸附在催化剂表面上的物种用*标注。

该反应历程中决速步的能垒为
③不同压强下,按照
 投料,实验测定
投料,实验测定 的平衡转化率(X)随温度(T)的变化关系如图所示。
的平衡转化率(X)随温度(T)的变化关系如图所示。
压强
 、
、 、
、 由大到小的顺序为
由大到小的顺序为 时,X几乎相等的原因是
时,X几乎相等的原因是(3)250℃,一定压强和催化剂条件下,1.32mol
 和3.96mol
和3.96mol 充分反应,平衡时CO为0.03mol,
充分反应,平衡时CO为0.03mol, 为0.41mol,试求反应Ⅲ的平衡常数
为0.41mol,试求反应Ⅲ的平衡常数
您最近一年使用:0次
名校
解题方法
6 . 已知常温下部分弱电解质的电离平衡常数如表:
(1)常温下,物质的量溶度相同的三种溶液①NaF溶液②NaClO溶液③Na2CO3溶液,其pH由大到小的顺序是____ (填序号)。
(2)25℃时,pH=4的NH4Cl溶液中各离子浓度的大小关系为___ 。
(3)NaClO溶液中的电荷守恒关系为___ 。
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为___ 。
(5)常温下,将cmol/L的氨水与0.01mol/L的盐酸等体积混合。若混合后溶液中存在c(NH )=c(Cl-),则c
)=c(Cl-),则c___ 0.01(填“大于”、“小于”、“等于”或“无法确定”),溶液显___ 性。(填“酸”、“碱”、“中”或“无法确定”)。
| 化学式 | HF | HClO | H2CO3 | NH3·H2O |
| 电离常数 | 6.8×10-4 | 4.7×10-8 | K1=4.3×10-7 K2=5.6×10-11 | Kb=1.7×10-5 |
(2)25℃时,pH=4的NH4Cl溶液中各离子浓度的大小关系为
(3)NaClO溶液中的电荷守恒关系为
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为
(5)常温下,将cmol/L的氨水与0.01mol/L的盐酸等体积混合。若混合后溶液中存在c(NH
 )=c(Cl-),则c
)=c(Cl-),则c
您最近一年使用:0次
2021-09-08更新
|
355次组卷
|
6卷引用:辽宁省昌图县第一高级中学2022-2023学年高二10月月考化学试题
辽宁省昌图县第一高级中学2022-2023学年高二10月月考化学试题辽宁省昌图县第一高级中学2023-2024学年高二上学期10月月考化学试题四川省江油中学2020-2021学年高二下学期3月月考化学试题(已下线)专题3.3.1 盐类的水解(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)黑龙江省佳木斯市汤原县高级中学2021-2022学年高二上学期期末考试化学试题广东省汕尾市2022-2023学年高二上学期期末考试化学试题
名校
7 . 电解质水溶液中存在电离平衡、水解平衡,已知部分弱电解质的电离常数如表:
回答下列问题:
(1)0.1mol·L‒1的NaClO溶液和0.1mol·L‒1的Na2CO3溶液中,c(ClO‒)___ (填“>”“<”或“=”)c(CO )。
)。
(2)HCOO‒、ClO‒、CO 、HCO
、HCO 中,结合质子能力最强的是
中,结合质子能力最强的是___ ,将少量CO2通入NaClO溶液,反应的离子方程式是___ 。
(3)将体积相同,pH=5的HCOOH和pH=5的H2SO4加水稀释到pH=6,需水的体积:HCOOH___ (填“大于”“小于”或者“等于”,下同)H2SO4;分别与足量的锌粉反应,反应过程中的平均反应速率:HCOOH___ H2SO4。
(4)25℃时,0.01mol·L‒1的HCOOH和0.01mol·L‒1的氨水等体积混合后溶液呈___ (填“酸”或“碱”)性;若amol·L‒1的HCOOH与0.01mol·L‒1的NaOH溶液等体积混合,所得溶液中c(HCOO‒)=c(Na+),则该温度下HCOOH的电离常数Ka=___ (用含a的代数式表示)。
(5)室温下,用0.100mol·L‒1的盐酸滴定20.00mL0.100mol·L‒1氨水,滴定曲线如图所示。
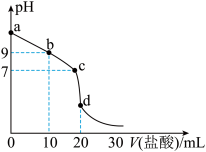
①d点所示的溶液中离子浓度由大到小的顺序为___ 。
②b点所示的溶液中c(NH )-c(NH3·H2O)=
)-c(NH3·H2O)=___ mol·L‒1(写出精确结果,不做近似计算)。
| 弱酸 | HCOOH | HClO | H2CO3 | NH3•H2O |
| 电离常数(25℃) | Ka=1.77×10‒4 | Ka=4.3×10‒10 | Ka1=5.0×10‒7 Ka2=5.6×10‒11 | Kb=1.75×10‒5 |
(1)0.1mol·L‒1的NaClO溶液和0.1mol·L‒1的Na2CO3溶液中,c(ClO‒)
 )。
)。(2)HCOO‒、ClO‒、CO
 、HCO
、HCO 中,结合质子能力最强的是
中,结合质子能力最强的是(3)将体积相同,pH=5的HCOOH和pH=5的H2SO4加水稀释到pH=6,需水的体积:HCOOH
(4)25℃时,0.01mol·L‒1的HCOOH和0.01mol·L‒1的氨水等体积混合后溶液呈
(5)室温下,用0.100mol·L‒1的盐酸滴定20.00mL0.100mol·L‒1氨水,滴定曲线如图所示。

①d点所示的溶液中离子浓度由大到小的顺序为
②b点所示的溶液中c(NH
 )-c(NH3·H2O)=
)-c(NH3·H2O)=
您最近一年使用:0次
2021-01-31更新
|
211次组卷
|
5卷引用:辽宁省朝阳市建平县实验中学2021-2022学年高二上学期期末考试化学试题
8 . 用系统命法写出下列物质名称或结构简式
(1)C4H10的一氯代物有_____________ 种。
(2)某有机物含C、H、O三种元素,分子模型如图所示(图中球与球之间的连线代表化学键.如单键、双键等)。该有机物的结构简式为_____________________ ,所含官能团的名称为 __________

(3)常温下,已知0.1 mol·L-1一元酸HA溶液中c(OH-)/c(H+)=1×10-8。常温下,0. 1 mol·L-1 HA溶液的pH=________ ;
(4)常温下,将0.1mol/L HCl溶液与0.1 mol/L MOH溶液等体积混合,测得混合后溶液的pH=5,则MOH在水中的电离方程式为_________________ 。
(5)已知常温时CH3COOH⇌CH3COO – + H+,Ka=2×10–5,则反应CH3COO – + H2O⇌CH3COOH + OH–的平衡常数Kh=________________ 。
(6)常温下,若在0.10 mol·L–1 CuSO4溶液中加入NaOH稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=________ mol·L–1 {Ksp[Cu(OH)2]=2.2×10–20}。
(7)1mol/L Na2C2O4溶液中离子浓度由大到小顺序_________________________ ,列出质子守恒关系式_____________________
(1)C4H10的一氯代物有
(2)某有机物含C、H、O三种元素,分子模型如图所示(图中球与球之间的连线代表化学键.如单键、双键等)。该有机物的结构简式为

(3)常温下,已知0.1 mol·L-1一元酸HA溶液中c(OH-)/c(H+)=1×10-8。常温下,0. 1 mol·L-1 HA溶液的pH=
(4)常温下,将0.1mol/L HCl溶液与0.1 mol/L MOH溶液等体积混合,测得混合后溶液的pH=5,则MOH在水中的电离方程式为
(5)已知常温时CH3COOH⇌CH3COO – + H+,Ka=2×10–5,则反应CH3COO – + H2O⇌CH3COOH + OH–的平衡常数Kh=
(6)常温下,若在0.10 mol·L–1 CuSO4溶液中加入NaOH稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=
(7)1mol/L Na2C2O4溶液中离子浓度由大到小顺序
您最近一年使用:0次
2020-04-24更新
|
293次组卷
|
2卷引用:辽宁省凌源市第二高级中学2019-2020学年高二下学期第二次网测化学试题
9 . 燃煤会产生CO2、CO、SO2等大气污染物。燃煤脱硫的相关反应的热化学方程式如下:
CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g) ΔH1 =+281.4kJ/mol (反应Ⅰ)
CaO(s)+SO2(g)+CO2(g) ΔH1 =+281.4kJ/mol (反应Ⅰ)
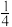 CaSO4(s)+CO(g)
CaSO4(s)+CO(g)
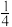 CaS(s)+CO2(g) ΔH2 = -43.6kJ/mol (反应Ⅱ)
CaS(s)+CO2(g) ΔH2 = -43.6kJ/mol (反应Ⅱ)
(1)计算反应CaO(s)+3CO(g )+SO2(g) CaS(s)+3CO2(g) ΔH=
CaS(s)+3CO2(g) ΔH=____________ 。
(2)一定温度下,向某恒容密闭容器中加入CaSO4(s)和1molCO,若只发生反应I,下列能说明该反应已达到平衡状态的是_____________ (填序号)
a.容器内的压强不发生变化 b.υ正(CO)=υ正(CO2)
c.容器内气体的密度不发生变化 d.n(CO)+n(CO2)=1mol
(3)一定温度下,体积为1L容器中加入CaSO4(s)和1molCO,若只发生反应II,测得CO2的物质的量随时间变化如下图中曲线A所示。
①在0~2min内的平均反应速率v(CO)=____________ 。
②曲线B表示过程与曲线A相比改变的反应条件可能为____________ (答出一条即可)。

(4)烟道气中的SO2和CO2均是酸性氧化物,也可用氢氧化钠溶液吸收。
已知:25℃时,碳酸和亚硫酸的电离平衡常数分别为:
碳酸 K1=4.3×10-7 K2=5.6×10-11
亚硫酸 K1=1.5×10-2 K2=1.0×10-7
①下列事实中,不能比较碳酸与亚硫酸的酸性强弱的是________ (填标号)。
a.25℃下,饱和碳酸溶液pH大于饱和亚硫酸溶液pH
b.25℃下,等浓度的NaHCO3溶液pH大于NaHSO3溶液
c.将SO2气体通入NaHCO3溶液,逸出气体通入澄清石灰水,澄清石灰水变浑浊
d.将CO2气体通入NaHSO3溶液,逸出气体通入品红溶液,品红溶液不褪色
②25℃时,氢氧化钠溶液吸收烟道气,得到pH=6的吸收液,该溶液中c(SO32-):c(HSO3-)=___________ 。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为___________________ 。
CaSO4(s)+CO(g)
 CaO(s)+SO2(g)+CO2(g) ΔH1 =+281.4kJ/mol (反应Ⅰ)
CaO(s)+SO2(g)+CO2(g) ΔH1 =+281.4kJ/mol (反应Ⅰ) 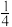 CaSO4(s)+CO(g)
CaSO4(s)+CO(g)
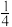 CaS(s)+CO2(g) ΔH2 = -43.6kJ/mol (反应Ⅱ)
CaS(s)+CO2(g) ΔH2 = -43.6kJ/mol (反应Ⅱ)(1)计算反应CaO(s)+3CO(g )+SO2(g)
 CaS(s)+3CO2(g) ΔH=
CaS(s)+3CO2(g) ΔH=(2)一定温度下,向某恒容密闭容器中加入CaSO4(s)和1molCO,若只发生反应I,下列能说明该反应已达到平衡状态的是
a.容器内的压强不发生变化 b.υ正(CO)=υ正(CO2)
c.容器内气体的密度不发生变化 d.n(CO)+n(CO2)=1mol
(3)一定温度下,体积为1L容器中加入CaSO4(s)和1molCO,若只发生反应II,测得CO2的物质的量随时间变化如下图中曲线A所示。
①在0~2min内的平均反应速率v(CO)=
②曲线B表示过程与曲线A相比改变的反应条件可能为

(4)烟道气中的SO2和CO2均是酸性氧化物,也可用氢氧化钠溶液吸收。
已知:25℃时,碳酸和亚硫酸的电离平衡常数分别为:
碳酸 K1=4.3×10-7 K2=5.6×10-11
亚硫酸 K1=1.5×10-2 K2=1.0×10-7
①下列事实中,不能比较碳酸与亚硫酸的酸性强弱的是
a.25℃下,饱和碳酸溶液pH大于饱和亚硫酸溶液pH
b.25℃下,等浓度的NaHCO3溶液pH大于NaHSO3溶液
c.将SO2气体通入NaHCO3溶液,逸出气体通入澄清石灰水,澄清石灰水变浑浊
d.将CO2气体通入NaHSO3溶液,逸出气体通入品红溶液,品红溶液不褪色
②25℃时,氢氧化钠溶液吸收烟道气,得到pH=6的吸收液,该溶液中c(SO32-):c(HSO3-)=
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为
您最近一年使用:0次
10 . 石油产品中含有H2S及COS、CH3SH等多种有机硫化物,石油化工催生出多种脱硫技术。请回答下列问题:
(1)COS的电子式是_________________ 。
(2)已知热化学方程式:
①2H2S(g)+SO2(g)=3S(s)+2H2O(l) △H=-362 kJ·mol-1
②2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H2=-1172 kJ·mol-1
则H2S气体和氧气反应生成固态硫和液态水的热化学方程式为__________________ 。
(3)可以用K2CO3溶液吸收H2S,其原理为K2CO3+H2S==KHS+KHCO3,该反应的平衡常数为___________ 。 (已知H2CO3的Ka1=4.2×10-7,Ka2=5.6×10-11;H2S的Ka1=5.6×10-8,Ka2=1.2×10-15)
(4)在强酸溶液中用H2O2可将COS氧化为硫酸,这一原理可用于COS的脱硫。该反应的化学方程式为____________________________________ 。
(5)COS的水解反应为COS(g)+H2O(g) CO2(g)+H2S(g);△H<0。某温度时,用活性α-Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。其它条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图2所示
CO2(g)+H2S(g);△H<0。某温度时,用活性α-Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。其它条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图2所示
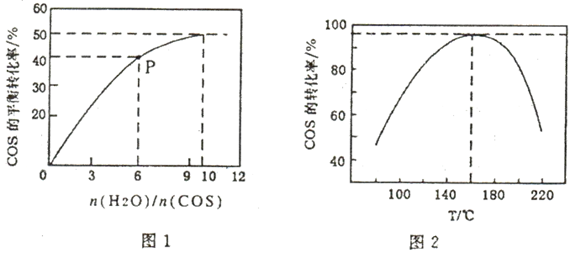
①该反应的最佳条件为:投料比[n(H2O)/n(COS)]为____________ ,温度为____________ 。
②P点对应的平衡常数为________________________ 。(保留小数点后2位)
③当温度升高到一定值后,发现一定时间内COS(g)的水解转化率降低;猜测可能的原因是________________________________________________ 。
(1)COS的电子式是
(2)已知热化学方程式:
①2H2S(g)+SO2(g)=3S(s)+2H2O(l) △H=-362 kJ·mol-1
②2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H2=-1172 kJ·mol-1
则H2S气体和氧气反应生成固态硫和液态水的热化学方程式为
(3)可以用K2CO3溶液吸收H2S,其原理为K2CO3+H2S==KHS+KHCO3,该反应的平衡常数为
(4)在强酸溶液中用H2O2可将COS氧化为硫酸,这一原理可用于COS的脱硫。该反应的化学方程式为
(5)COS的水解反应为COS(g)+H2O(g)
 CO2(g)+H2S(g);△H<0。某温度时,用活性α-Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。其它条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图2所示
CO2(g)+H2S(g);△H<0。某温度时,用活性α-Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。其它条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图2所示
①该反应的最佳条件为:投料比[n(H2O)/n(COS)]为
②P点对应的平衡常数为
③当温度升高到一定值后,发现一定时间内COS(g)的水解转化率降低;猜测可能的原因是
您最近一年使用:0次
2018-05-16更新
|
978次组卷
|
4卷引用:辽宁省六校协作体2021届高三第一次联考化学试题



