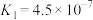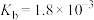解题方法
1 . 某温度下,向 溶液中滴入
溶液中滴入 的
的 溶液,溶液中
溶液,溶液中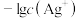 随加入
随加入 溶液体积[
溶液体积[ ]的关系如图所示。下列说法正确的是
]的关系如图所示。下列说法正确的是

已知:该温度下,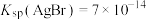 。
。
 溶液中滴入
溶液中滴入 的
的 溶液,溶液中
溶液,溶液中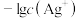 随加入
随加入 溶液体积[
溶液体积[ ]的关系如图所示。下列说法正确的是
]的关系如图所示。下列说法正确的是
已知:该温度下,
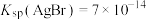 。
。A.该温度下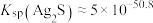 |
B.向b点溶液中加入 的KBr溶液,沉淀转化为AgBr 的KBr溶液,沉淀转化为AgBr |
C.c点溶液中存在: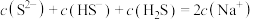 |
D.相同条件下, 在水中和在 在水中和在 溶液中的溶解度相同 溶液中的溶解度相同 |
您最近一年使用:0次
名校
解题方法
2 . 燃料燃烧产生的二氧化碳有多种捕捉方式,在自然界中存在着二氧化碳气体与其他物质的反应过程,而实验室中一般使用碱溶液来吸收二氧化碳气体。
(1)向1L 1 的NaOH溶液中通入0.5mol二氧化碳气体,最终所得溶液中各离子浓度关系正确的选项有(假设溶液体积不发生变化):___________。
的NaOH溶液中通入0.5mol二氧化碳气体,最终所得溶液中各离子浓度关系正确的选项有(假设溶液体积不发生变化):___________。
(2)已知:25℃时,① 的电离平衡常数
的电离平衡常数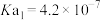 ,
,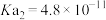 。
。
②盐类水解常数 可以表示盐溶液水解平衡的限度,书写方式与电离平衡常数一致。
可以表示盐溶液水解平衡的限度,书写方式与电离平衡常数一致。
写出 溶液中
溶液中 水解的平衡常数的表达式,并根据上述数据计算出
水解的平衡常数的表达式,并根据上述数据计算出 的数值:
的数值:
___________ (表达式)=___________ (数值)。
(3)根据 的
的 数值和
数值和 电离平衡常数的数值,判断至下
电离平衡常数的数值,判断至下 溶液的酸碱性,并结合适当的化学语言说明理由:
溶液的酸碱性,并结合适当的化学语言说明理由:___________ 。
(1)向1L 1
 的NaOH溶液中通入0.5mol二氧化碳气体,最终所得溶液中各离子浓度关系正确的选项有(假设溶液体积不发生变化):___________。
的NaOH溶液中通入0.5mol二氧化碳气体,最终所得溶液中各离子浓度关系正确的选项有(假设溶液体积不发生变化):___________。A.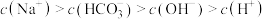 |
B.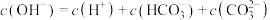 |
C.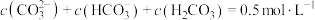 |
D. |
 的电离平衡常数
的电离平衡常数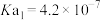 ,
,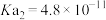 。
。②盐类水解常数
 可以表示盐溶液水解平衡的限度,书写方式与电离平衡常数一致。
可以表示盐溶液水解平衡的限度,书写方式与电离平衡常数一致。写出
 溶液中
溶液中 水解的平衡常数的表达式,并根据上述数据计算出
水解的平衡常数的表达式,并根据上述数据计算出 的数值:
的数值:
(3)根据
 的
的 数值和
数值和 电离平衡常数的数值,判断至下
电离平衡常数的数值,判断至下 溶液的酸碱性,并结合适当的化学语言说明理由:
溶液的酸碱性,并结合适当的化学语言说明理由:
您最近一年使用:0次
名校
解题方法
3 . 常温下,下列各组离子在水溶液中一定能大量共存的是
A.K+、NH 、CH3COO-、NO 、CH3COO-、NO |
B.KAl(SO4)2溶液中:Na+、HCO 、NO 、NO |
C. 的溶液中:Na+、CH3COO-、NO 的溶液中:Na+、CH3COO-、NO |
D.水电离出的c(H+)=1.0×10-12mol·L-1的溶液中:Na+、K+、SO |
您最近一年使用:0次
名校
解题方法
4 . 下列方程式书写正确的是
A.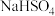 在水溶液中的电离方程式: 在水溶液中的电离方程式: |
B. 的电离方程式: 的电离方程式: |
C. 的水解方程式: 的水解方程式: |
D. 的电离方程式: 的电离方程式: |
您最近一年使用:0次
5 . 现有下列电解质溶液:① ;②
;② ;③
;③ ;④
;④ ;⑤
;⑤ ;⑥
;⑥ ;⑦
;⑦ 。已知:25℃时,部分弱电解质的电离平衡常数数据如下表:
。已知:25℃时,部分弱电解质的电离平衡常数数据如下表:
(1) 溶液呈
溶液呈____________ (填“酸性”“碱性”或“中性”),其原因是________________________ 。
(2)上述七种电解质溶液中,既能与盐酸反应又能与烧碱溶液反应的是____________ (填序号)。
(3)常温下,物质的量浓度均为 的④、⑤、⑥、⑦四种溶液,溶液中
的④、⑤、⑥、⑦四种溶液,溶液中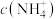 由大到小的顺序为
由大到小的顺序为____________ (填序号)。
(4)向 溶液通入少量的
溶液通入少量的 气体,写出该反应的离子方程式
气体,写出该反应的离子方程式________________________ 。
 ;②
;② ;③
;③ ;④
;④ ;⑤
;⑤ ;⑥
;⑥ ;⑦
;⑦ 。已知:25℃时,部分弱电解质的电离平衡常数数据如下表:
。已知:25℃时,部分弱电解质的电离平衡常数数据如下表:化学式 |
|
|
|
|
电离平衡常数 |
|
|
|
|
(1)
 溶液呈
溶液呈(2)上述七种电解质溶液中,既能与盐酸反应又能与烧碱溶液反应的是
(3)常温下,物质的量浓度均为
 的④、⑤、⑥、⑦四种溶液,溶液中
的④、⑤、⑥、⑦四种溶液,溶液中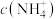 由大到小的顺序为
由大到小的顺序为(4)向
 溶液通入少量的
溶液通入少量的 气体,写出该反应的离子方程式
气体,写出该反应的离子方程式
您最近一年使用:0次
名校
解题方法
6 . 回答下列问题。
I.酸碱滴定具有准确测定、操作方便的特点,在科学研究、医疗卫生等领域有广泛用途。
(1)室温下,向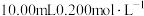 盐酸中滴加
盐酸中滴加 溶液,恰好完全反应时,滴加的
溶液,恰好完全反应时,滴加的 体积
体积
___________  ,继续多加半滴
,继续多加半滴 溶液(
溶液(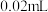 ),溶液
),溶液
___________ (精确到小数点后两位)。已知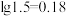
(2) 溶液滴定邻苯二甲酸氢钾(邻苯二甲酸
溶液滴定邻苯二甲酸氢钾(邻苯二甲酸 的
的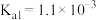 ,
,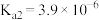 )溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是__________。
)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是__________。

Ⅱ.实验室制备氯化氢并测定反应后混酸中盐酸和硫酸浓度的方法如下:
(3)推压注射器活塞将浓盐酸慢慢注入到浓硫酸中,可制备少量干燥 气体,其原理是__________。
气体,其原理是__________。

(4)为测定制备气体后残留混合酸中盐酸和硫酸的浓度,进行如下实验:
取 混合酸,加水稀释至
混合酸,加水稀释至 ,完成此操作,用到的精确定量仪器有
,完成此操作,用到的精确定量仪器有___________ ;称量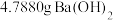 固体,溶于水配成
固体,溶于水配成 标准溶液,装入洗净的细口试剂瓶,并贴上标签。装瓶前用标准溶液对试剂瓶进行润洗的目的是
标准溶液,装入洗净的细口试剂瓶,并贴上标签。装瓶前用标准溶液对试剂瓶进行润洗的目的是___________ ,请你填写标签上的空白___________ 。

(5)用移液管从 稀释液中取出
稀释液中取出 ,滴加酚酞作指示剂,用标准
,滴加酚酞作指示剂,用标准 溶液滴定至溶液由
溶液滴定至溶液由___________ 时停止滴加,记录消耗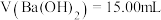 。为完成全部测定,接下来对锥形瓶中混合物进行的操作是
。为完成全部测定,接下来对锥形瓶中混合物进行的操作是___________ 、___________ 、称量并恒重,最终测得硫酸钡质量为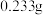 ,计算原混酸中
,计算原混酸中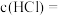
___________ ,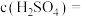
___________ 。
(6)若固体 中混有少量的
中混有少量的 ,会导致混合酸中:
,会导致混合酸中:
①硫酸浓度的测定结果___________ 。
A.偏大 B.偏小 C.无影响
②盐酸浓度的测定结果___________ 。
A.偏大 B.偏小 C.无影响
I.酸碱滴定具有准确测定、操作方便的特点,在科学研究、医疗卫生等领域有广泛用途。
(1)室温下,向
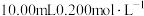 盐酸中滴加
盐酸中滴加 溶液,恰好完全反应时,滴加的
溶液,恰好完全反应时,滴加的 体积
体积
 ,继续多加半滴
,继续多加半滴 溶液(
溶液(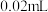 ),溶液
),溶液
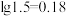
(2)
 溶液滴定邻苯二甲酸氢钾(邻苯二甲酸
溶液滴定邻苯二甲酸氢钾(邻苯二甲酸 的
的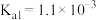 ,
,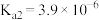 )溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是__________。
)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是__________。
| A.混合溶液的导电能力与离子浓度和种类有关 |
B. 与 与 的导电能力之和大于 的导电能力之和大于 的 的 |
C.b点的混合溶液 |
D.c点的混合溶液中,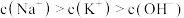 |
Ⅱ.实验室制备氯化氢并测定反应后混酸中盐酸和硫酸浓度的方法如下:
(3)推压注射器活塞将浓盐酸慢慢注入到浓硫酸中,可制备少量干燥
 气体,其原理是__________。
气体,其原理是__________。
| A.浓硫酸吸收了盐酸中水分 | B.混合时放热使 溶解度减小 溶解度减小 |
C.浓盐酸中 以分子形式存在 以分子形式存在 | D.浓盐酸密度小于浓硫酸 |
(4)为测定制备气体后残留混合酸中盐酸和硫酸的浓度,进行如下实验:
取
 混合酸,加水稀释至
混合酸,加水稀释至 ,完成此操作,用到的精确定量仪器有
,完成此操作,用到的精确定量仪器有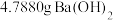 固体,溶于水配成
固体,溶于水配成 标准溶液,装入洗净的细口试剂瓶,并贴上标签。装瓶前用标准溶液对试剂瓶进行润洗的目的是
标准溶液,装入洗净的细口试剂瓶,并贴上标签。装瓶前用标准溶液对试剂瓶进行润洗的目的是
(5)用移液管从
 稀释液中取出
稀释液中取出 ,滴加酚酞作指示剂,用标准
,滴加酚酞作指示剂,用标准 溶液滴定至溶液由
溶液滴定至溶液由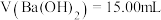 。为完成全部测定,接下来对锥形瓶中混合物进行的操作是
。为完成全部测定,接下来对锥形瓶中混合物进行的操作是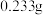 ,计算原混酸中
,计算原混酸中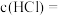
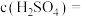
(6)若固体
 中混有少量的
中混有少量的 ,会导致混合酸中:
,会导致混合酸中:①硫酸浓度的测定结果
A.偏大 B.偏小 C.无影响
②盐酸浓度的测定结果
A.偏大 B.偏小 C.无影响
您最近一年使用:0次
2024-02-11更新
|
82次组卷
|
2卷引用:上海市曹杨第二中学2023-2024学年高二上学期第二次月考化学试题
名校
7 . HCOOH、CH3COOH、H2C2O4是典型的有机酸,常温下,其电离常数如下表:
回答下列问题(以常温为研究温度):
(1)H2C2O4对应Ka2的表达式为_______ 。
(2)等物质的量浓度、等体积的HCOOH和CH3COOH,其pH的大小关系为:HCOOH_______ CH3COOH(填“>”“<”或“=”)。
(3)等物质的量浓度、等体积的HCOOH和CH3COOH均用蒸馏水稀释至原体积的10倍,其溶液的导电性强弱关系为:HCOOH_______ CH3COOH(填“>”“<”或“=”)。
(4)等物质的量浓度的HCOONa溶液和CH3COONa溶液中,由水电离的c(OH−)大小关系为:HCOONa_______ CH3COONa(填“>”“<”或“=”)。
(5)KHC2O4的水溶液呈_______ 性。
(6)将pH之和等于14的CH3COOH和NaOH溶液等体积混合,溶液呈_______ 性。
(7)在H2C2O4溶液中加入过量的HCOONa溶液,其反应的离子方程式为_______ 。
(8)将物质的量浓度比为2:1的HCOOH和NaOH溶液等体积混合,混合后溶液中的微粒浓度关系中,c(H+)-c(OH−)=_______ (用HCOOH及HCOO−的浓度符号表示)。
| 有机酸 | HCOOH | CH3COOH | H2C2O4 |
| 电离常数 | Ka=1.8×10−4 | Ka=1.75×10−5 | Ka1=5.6×10−2 Ka2=1.5×10−4 |
(1)H2C2O4对应Ka2的表达式为
(2)等物质的量浓度、等体积的HCOOH和CH3COOH,其pH的大小关系为:HCOOH
(3)等物质的量浓度、等体积的HCOOH和CH3COOH均用蒸馏水稀释至原体积的10倍,其溶液的导电性强弱关系为:HCOOH
(4)等物质的量浓度的HCOONa溶液和CH3COONa溶液中,由水电离的c(OH−)大小关系为:HCOONa
(5)KHC2O4的水溶液呈
(6)将pH之和等于14的CH3COOH和NaOH溶液等体积混合,溶液呈
(7)在H2C2O4溶液中加入过量的HCOONa溶液,其反应的离子方程式为
(8)将物质的量浓度比为2:1的HCOOH和NaOH溶液等体积混合,混合后溶液中的微粒浓度关系中,c(H+)-c(OH−)=
您最近一年使用:0次
2024-02-11更新
|
157次组卷
|
2卷引用:四川省成都市蓉城名校2023-2024学年高二上学期期末联考化学试题
名校
8 . 化学是一门以实验为基础的学科。回答下列问题:
Ⅰ.影响化学平衡的因素
 溶液中存在平衡:
溶液中存在平衡: (蓝色)
(蓝色)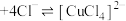 (黄色)
(黄色)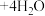
(1)取两支试管,分别加入2 mL 0.5 mol/L 溶液,溶液呈绿色,其原因为
溶液,溶液呈绿色,其原因为____________ 。
(2)将其中一支试管加热,溶液变为黄绿色,则该反应的
______ 0(填“>”或“<”),在另一支试管中加入5滴 溶液,静置,上层清液呈
溶液,静置,上层清液呈______ 色。
Ⅱ.电离平衡常数
(3) 是二元弱酸,其电离平衡常数
是二元弱酸,其电离平衡常数 的表达式为
的表达式为______ 。
(4)向盛有2 mL 1 mol/L醋酸的试管中滴加1 mol/L 溶液,观察到试管中有气泡产生,由此推断的
溶液,观察到试管中有气泡产生,由此推断的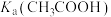
______ 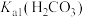 (填“>”或“<”),发生反应的离子方程式为
(填“>”或“<”),发生反应的离子方程式为____________ 。
Ⅲ.盐类水解的应用
(5)向一支试管中加入少量 晶体,然后加入5 mL蒸馏水、振荡,观察到
晶体,然后加入5 mL蒸馏水、振荡,观察到 慢慢溶解,但有少量浑浊,此溶液的pH
慢慢溶解,但有少量浑浊,此溶液的pH______ 7(填“>”“<”或“=”),配制 溶液的正确方法是
溶液的正确方法是____________ 。
(6)向一个烧杯中加入40 mL蒸馏水,加热至水沸腾,然后向沸水中逐滴加入5~6滴饱和 溶液,继续煮沸制得
溶液,继续煮沸制得 胶体。该反应的化学方程式为
胶体。该反应的化学方程式为____________ , 胶体呈
胶体呈______ 色。
Ⅳ.亚铁离子的检验
(7) 与
与______ 色的 溶液反应有特征蓝色沉淀产生,这是检验溶液中
溶液反应有特征蓝色沉淀产生,这是检验溶液中 的常用方法。写出该反应的离子方程式:
的常用方法。写出该反应的离子方程式:____________ 。
Ⅰ.影响化学平衡的因素
 溶液中存在平衡:
溶液中存在平衡: (蓝色)
(蓝色)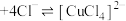 (黄色)
(黄色)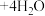
(1)取两支试管,分别加入2 mL 0.5 mol/L
 溶液,溶液呈绿色,其原因为
溶液,溶液呈绿色,其原因为(2)将其中一支试管加热,溶液变为黄绿色,则该反应的

 溶液,静置,上层清液呈
溶液,静置,上层清液呈Ⅱ.电离平衡常数
(3)
 是二元弱酸,其电离平衡常数
是二元弱酸,其电离平衡常数 的表达式为
的表达式为(4)向盛有2 mL 1 mol/L醋酸的试管中滴加1 mol/L
 溶液,观察到试管中有气泡产生,由此推断的
溶液,观察到试管中有气泡产生,由此推断的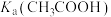
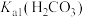 (填“>”或“<”),发生反应的离子方程式为
(填“>”或“<”),发生反应的离子方程式为Ⅲ.盐类水解的应用
(5)向一支试管中加入少量
 晶体,然后加入5 mL蒸馏水、振荡,观察到
晶体,然后加入5 mL蒸馏水、振荡,观察到 慢慢溶解,但有少量浑浊,此溶液的pH
慢慢溶解,但有少量浑浊,此溶液的pH 溶液的正确方法是
溶液的正确方法是(6)向一个烧杯中加入40 mL蒸馏水,加热至水沸腾,然后向沸水中逐滴加入5~6滴饱和
 溶液,继续煮沸制得
溶液,继续煮沸制得 胶体。该反应的化学方程式为
胶体。该反应的化学方程式为 胶体呈
胶体呈Ⅳ.亚铁离子的检验
(7)
 与
与 溶液反应有特征蓝色沉淀产生,这是检验溶液中
溶液反应有特征蓝色沉淀产生,这是检验溶液中 的常用方法。写出该反应的离子方程式:
的常用方法。写出该反应的离子方程式:
您最近一年使用:0次
2024-02-11更新
|
82次组卷
|
2卷引用:天津市南开区2023-2024学年高二上学期期末测试化学试题
名校
9 . 常温下联氨 的水溶液中存在:①
的水溶液中存在:①
 ;②
;②

 。该溶液中微粒的分布分数
。该溶液中微粒的分布分数 [
[
 ,
, 或
或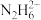 ]随
]随 变化的关系如图所示。下列叙述正确的是
变化的关系如图所示。下列叙述正确的是

 的水溶液中存在:①
的水溶液中存在:①
 ;②
;②

 。该溶液中微粒的分布分数
。该溶液中微粒的分布分数 [
[
 ,
, 或
或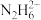 ]随
]随 变化的关系如图所示。下列叙述正确的是
变化的关系如图所示。下列叙述正确的是
A.图中曲线I对应的微粒为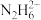 |
B.C点对应溶液中存在: |
C.将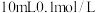 的联氨溶液与 的联氨溶液与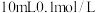 的盐酸混合后,所得溶液 的盐酸混合后,所得溶液 |
D.常温下羟胺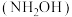 的 的 ,将少量联氨溶液加入足量 ,将少量联氨溶液加入足量 溶液中,发生反应: 溶液中,发生反应: |
您最近一年使用:0次
2024-02-11更新
|
168次组卷
|
3卷引用:湖北省武汉市武钢三中2023-2024学年高二上学期12月月考化学试题
名校
10 . 难溶盐MgF2可溶于盐酸,常温下,用HCl气体调节MgF2浊液的pH,测得体系中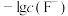 或
或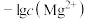 随
随 的变化如图所示。下列说法不正确的是
的变化如图所示。下列说法不正确的是

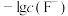 或
或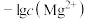 随
随 的变化如图所示。下列说法不正确的是
的变化如图所示。下列说法不正确的是
A.曲线M代表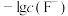 随 随 的变化趋势 的变化趋势 |
B.Y点溶液中存在 |
C.氢氟酸的 |
D.难溶盐 的 的 |
您最近一年使用:0次
2024-02-11更新
|
163次组卷
|
2卷引用:湖北省武昌实验中学2023-2024学年高二上学期12月月考化学试题