1 . 醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠是其常见的盐,已知:25℃,醋酸与氨水的电离平衡常数数值均为1×10-5。请回答:
(1)0.1 mol/L的醋酸溶液的pH等于___________ (由于醋酸电离常数很小,平衡时c(CH3COOH)可近似视为0.1mol/L);
(2)用实验确定醋酸是弱电解质。两同学的方案是:
甲:①取一定量的醋酸配制0.1 mol·L-1的溶液100 mL;
②用pH试纸测出该溶液的PH,即可证明醋酸是弱电解质
乙:①用已知物质的量浓度的醋酸溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;
②分别取这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察,即可证明醋酸是弱电解质。
甲方案中,说明醋酸是弱电解质的理由是测得溶液的pH___________ 1(填“>”、“<”或“=”)。乙方案中,说明醋酸是弱电解质的现象是___________ 。
A.装HCl溶液的试管中放出H2的速率快;
B.装醋酸溶液的试管中放出H2的速率快;
C.两个试管中产生气体速率一样快。
乙方案存在不妥之处:锌粒的表面积可能不同,影响实验结果。方案中还有难以实现之处:___________ 。
(3)根据题干数据分析,0.1 mol/L 的醋酸铵溶液中,醋酸根离子浓度___________ 铵根离子浓度(填“大于”、“小于”或“等于”)。
(4)25 ℃时,向0.1 mol/L醋酸溶液中加入少量醋酸钠晶体,待晶体溶解后发现溶液的pH增大。
对上述现象有两种不同的解释:
甲同学认为醋酸钠水解呈碱性,增大了[OH-],因而使溶液的pH增大;
乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使[H+]减小,因此溶液的pH值增大。为证实乙同学分析的合理性,设计如下实验:向0.1 mol/L的醋酸溶液中加入少量下列物质中的___________ (填写编号),然后测定溶液的pH,其溶液的pH应___________ (填“增大”、“减小”或“不变”)。
A.固体CH3COOK B.固体CH3COONH4
C.气体NH3 D.固体NaHCO3
E.固体NaOH F.气体HCl
(5)25 ℃时,在醋酸钠溶液中离子浓度由大到小的顺序为___________ ;
(6)醋酸钠水解平衡常数表达式为:Kh=___________ ,25 ℃时,0.1 mol/L 的醋酸钠溶液的pH等于___________ (此空计算时可合理近似 );
(7)物质的量浓度均为0.1 mol/L的CH3COONa和CH3COOH溶液等体积混合后溶液的pH<7(注:混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是___________ 。
A.[Na+]=2 [CH3COO-]+2[CH3COOH]
B.[Na+]+[H+]=[CH3COO-]+[OH-]
C.[CH3COO-]+[CH3COOH]=0.1mol/L
D.[Na+]> [CH3COO-]> [H+]> [OH-]
E.[Na+]+[OH-] =[CH3COOH]+[H+]
F.[CH3COOH]+[H+]=[CH3COO-]+[OH-]
(1)0.1 mol/L的醋酸溶液的pH等于
(2)用实验确定醋酸是弱电解质。两同学的方案是:
甲:①取一定量的醋酸配制0.1 mol·L-1的溶液100 mL;
②用pH试纸测出该溶液的PH,即可证明醋酸是弱电解质
乙:①用已知物质的量浓度的醋酸溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;
②分别取这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察,即可证明醋酸是弱电解质。
甲方案中,说明醋酸是弱电解质的理由是测得溶液的pH
A.装HCl溶液的试管中放出H2的速率快;
B.装醋酸溶液的试管中放出H2的速率快;
C.两个试管中产生气体速率一样快。
乙方案存在不妥之处:锌粒的表面积可能不同,影响实验结果。方案中还有难以实现之处:
(3)根据题干数据分析,0.1 mol/L 的醋酸铵溶液中,醋酸根离子浓度
(4)25 ℃时,向0.1 mol/L醋酸溶液中加入少量醋酸钠晶体,待晶体溶解后发现溶液的pH增大。
对上述现象有两种不同的解释:
甲同学认为醋酸钠水解呈碱性,增大了[OH-],因而使溶液的pH增大;
乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使[H+]减小,因此溶液的pH值增大。为证实乙同学分析的合理性,设计如下实验:向0.1 mol/L的醋酸溶液中加入少量下列物质中的
A.固体CH3COOK B.固体CH3COONH4
C.气体NH3 D.固体NaHCO3
E.固体NaOH F.气体HCl
(5)25 ℃时,在醋酸钠溶液中离子浓度由大到小的顺序为
(6)醋酸钠水解平衡常数表达式为:Kh=
(7)物质的量浓度均为0.1 mol/L的CH3COONa和CH3COOH溶液等体积混合后溶液的pH<7(注:混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是
A.[Na+]=2 [CH3COO-]+2[CH3COOH]
B.[Na+]+[H+]=[CH3COO-]+[OH-]
C.[CH3COO-]+[CH3COOH]=0.1mol/L
D.[Na+]> [CH3COO-]> [H+]> [OH-]
E.[Na+]+[OH-] =[CH3COOH]+[H+]
F.[CH3COOH]+[H+]=[CH3COO-]+[OH-]
您最近一年使用:0次
名校
2 . 下面的问题中,与盐类水解有关的是
①为保存FeCl3溶液,要在溶液中加入少量盐酸;
②实验室盛放Na2CO3、Na2SiO3等溶液的试剂瓶应用橡胶塞;
③在NH4Cl或AlCl3溶液中加入镁条会产生气泡;
④长期使用硫酸铵,土壤酸性增强。
①为保存FeCl3溶液,要在溶液中加入少量盐酸;
②实验室盛放Na2CO3、Na2SiO3等溶液的试剂瓶应用橡胶塞;
③在NH4Cl或AlCl3溶液中加入镁条会产生气泡;
④长期使用硫酸铵,土壤酸性增强。
| A.只有①② | B.只有①②③ | C.只有①③④ | D.全部 |
您最近一年使用:0次
2022-06-29更新
|
316次组卷
|
3卷引用:山东省德州市2020-2021学年高二上学期反应原理月考(B)化学试题
山东省德州市2020-2021学年高二上学期反应原理月考(B)化学试题(已下线)3.3.3 盐类水解的应用-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)河北省邯郸市大名县第一中学2022-2023学年高二上学期10月月考化学试题
名校
3 . 下列说法中正确的是
| A.氯气溶于水能导电,所以氯气属于非电解质 |
| B.强电解质溶液的导电能力一定比弱电解质溶液的强 |
| C.酸碱恰好完全反应时,溶液不一定呈中性 |
| D.相同温度时,pH相等盐酸和氯化铵溶液中,水的电离程度相同 |
您最近一年使用:0次
2022-06-29更新
|
98次组卷
|
2卷引用:山东省德州市2020-2021学年高二上学期反应原理月考(B)化学试题
4 . 平衡,可逆反应的宿命,可逆反应永恒的话题。
(1)在一体积为10L的容器中,通入一定量的CO和H2O,在一定温度时发生反应,4s后达到平衡状态。CO+H2O(g)⇌CO2+H2;△H<0
①CO和H2O的浓度变化如下图所示,则在0~4s时正反应的平均反应速率为v(CO2)=_______ mol·L-1·min-1
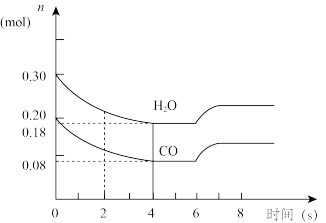
②图中6~7s之间反应向_______ (填左、右或不)移动,原因可能是_______ (填字母代号)
A.只充入水蒸气 B.只降低温度 C.只使用催化剂
D.只充入惰性气体 E.增大压强 F.只充入CO2
(2)在25℃下,将amol·L-1的醋酸与0.01mol·L-1的NaOH等体积混合,反应平衡时溶液中c(Na+)=c(CH3COO-),则溶液显_______ 性(填“酸”“碱”或“中”);用含a的代数式表示CH3COOH的电离常数Ka=_______ 。
(3)氨气的水溶液称为氨水,它的主要存在微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5mol/L
b.CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O
则CH3COONH4溶液呈_______ 性(填“酸”、“碱”或“中”),NH4HCO3溶液呈_______ 性(填“酸”、“碱”或“中”),NH4HCO3溶液中浓度最大的离子是_______ (填离子的名称)
(4)已知常温下Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=1.0×10-38。现有0.1mol·L-1的CuCl2溶液中含有Fe3+,调节pH=3.0使Fe3+沉淀完全[即当c(Fe3+)<10-5mol·L-1时认为沉淀完全]此时Cu2+是否开始沉淀_______ (填“是”或“否”)。
(1)在一体积为10L的容器中,通入一定量的CO和H2O,在一定温度时发生反应,4s后达到平衡状态。CO+H2O(g)⇌CO2+H2;△H<0
①CO和H2O的浓度变化如下图所示,则在0~4s时正反应的平均反应速率为v(CO2)=

②图中6~7s之间反应向
A.只充入水蒸气 B.只降低温度 C.只使用催化剂
D.只充入惰性气体 E.增大压强 F.只充入CO2
(2)在25℃下,将amol·L-1的醋酸与0.01mol·L-1的NaOH等体积混合,反应平衡时溶液中c(Na+)=c(CH3COO-),则溶液显
(3)氨气的水溶液称为氨水,它的主要存在微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5mol/L
b.CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O
则CH3COONH4溶液呈
(4)已知常温下Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=1.0×10-38。现有0.1mol·L-1的CuCl2溶液中含有Fe3+,调节pH=3.0使Fe3+沉淀完全[即当c(Fe3+)<10-5mol·L-1时认为沉淀完全]此时Cu2+是否开始沉淀
您最近一年使用:0次
13-14高三·上海·阶段练习
名校
解题方法
5 . 常温下,向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液。有关微粒的物质的量变化如图,根据图示判断,下列说法正确的是
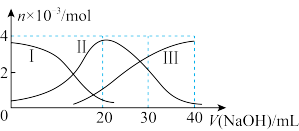

A.H2A在水中的电离方程式是:H2A= H++HA-;HA- H++A2- H++A2- |
| B.当V(NaOH)=20mL时,则有:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| C.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 |
| D.当V(NaOH)=30mL时,则有:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-) |
您最近一年使用:0次
2022-05-06更新
|
541次组卷
|
16卷引用:2014-2015山西省山大附中高二12月月考化学试卷
2014-2015山西省山大附中高二12月月考化学试卷2015-2016学年湖北省新洲一中、黄陂一中高二上期末化学试卷江西省景德镇一中2017-2018学年高二上学期期末考化学试题河北省衡水市第十四中学2019-2020学年高二上学期第三次调研考试化学试题江西省鄱阳县第一中学2019-2020学年高二上学期第二次检测化学试题(已下线)2014届上海市十三校高三测试化学试卷(已下线)2014届浙江省温州中学高三上学期期末理综化学试卷(已下线)2015届江西南昌三中高三11月份月考化学试卷2015届浙江省杭州外国语学校高三上学期期中理综化学试卷2017届辽宁省铁岭市协作体高三上联考四化学试卷2017届湖南省三湘名校教育联盟高三第三次大联考理综化学试卷重庆市缙云教育联盟2020-2021学年高二上学期期末考试化学试题湖南省常德市石门县第一中学2021-2022学年高一下学期期中考试化学试题上海市实验学校2021-2022学年高三下学期4月月考化学试题上海市川沙中学2021-2022学年高三下学期5月月考化学试题(已下线)专题10 水溶液中的离子平衡-三年(2020-2022)高考真题分项汇编
名校
解题方法
6 . 25℃时,向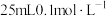 NaOH溶液中逐滴加入
NaOH溶液中逐滴加入 醋酸溶液,滴定曲线如图所示,
醋酸溶液,滴定曲线如图所示,

下列说法正确的是
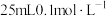 NaOH溶液中逐滴加入
NaOH溶液中逐滴加入 醋酸溶液,滴定曲线如图所示,
醋酸溶液,滴定曲线如图所示,
下列说法正确的是
A.在A、B间任一点的溶液中一定都有: |
B.用含a的代数式表示 的电离常数 的电离常数 |
C.C点对应的溶液中,水电离出的 浓度大于 浓度大于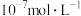 |
D.D点对应的溶液中,存在关系: |
您最近一年使用:0次
2022-04-23更新
|
303次组卷
|
10卷引用:【全国百强校】四川省成都市成都外国语学校2018-2019学年高二上学期12月月考化学试题
【全国百强校】四川省成都市成都外国语学校2018-2019学年高二上学期12月月考化学试题【全国百强校】江苏省南通市海安高级中学2018-2019学年高二12月月考(选修)化学试题【全国百强校】内蒙古自治区赤峰市第二中学2018-2019学年高二下学期4月月考化学试题安徽省合肥市一六八中学2019-2020学年高二上学期期中考试化学试题2017届四川省绵阳南山中学高三12月月考化学试卷夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——酸碱中和滴定的误差和曲线分析江西省新建一中2020-2021学年高二下学期开学考试化学试题江苏省马坝高级中学2021-2022学年高二下学期期中考试化学试题江西省赣州市定南中学2021-2022学年高二下学期5月月考化学试题江苏省海安高级中学2021-2022学年高二上学期阶段测试(二)化学试题
名校
解题方法
7 . 室温下将pH=2的盐酸与pH=12的氨水等体积混合,在所得的混合溶液中,下列关系式正确的是
A.c(Cl-)>c(NH )>c(OH-)>c(H+) )>c(OH-)>c(H+) | B.c(NH )>c(Cl-)>c(OH-)>c(H+) )>c(Cl-)>c(OH-)>c(H+) |
C.c(Cl-)=c(NH )>c(H+)=c(OH-) )>c(H+)=c(OH-) | D.c(NH )>c(Cl-)>c(H+)>c(OH-) )>c(Cl-)>c(H+)>c(OH-) |
您最近一年使用:0次
2022-04-13更新
|
156次组卷
|
7卷引用:2015-2016学年浙江台州中学高二上第三次统练化学试卷
名校
8 . 25 ℃时,H2CO3的Ka1=4.4×10-7,Ka2=4.7×10-11。关于NaHCO3溶液的下列说法正确的是
A.CO 的水解常数Kh=2.1×10-4 的水解常数Kh=2.1×10-4 |
B.HCO 的电离程度大于HCO 的电离程度大于HCO 的水解程度 的水解程度 |
| C.加水稀释时水解程度增大,溶液的pH增大 |
D.c(Na+)+c(H+)=c( )+c( )+c( )+c(OH-) )+c(OH-) |
您最近一年使用:0次
2022-04-09更新
|
88次组卷
|
4卷引用:四川省绵阳市2019-2020学年高二下学期期末教学质量测试化学试题
解题方法
9 . 某课外小组对一些金属单质和化合物的性质进行研究。
(1)如表为“铝与氯化铜溶液反应”实验报告的一部分:
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的要求写离子方程式):置换反应____ ;化合反应____ 。
(2)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼金属锰。若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+。该反应的离子方程式是____ 。
(1)如表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中 | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
| 反应结束后分离出溶液备用 | —— |
| 红色固体用蒸馏水洗涤后,置于潮湿空气中 | 段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的要求写离子方程式):置换反应
(2)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼金属锰。若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+。该反应的离子方程式是
您最近一年使用:0次
10 . 常温下,向100mL0.01mol·L-1MOH溶液中逐滴加入0.02mol·L-1HA溶液,滴加过程中混合溶液的pH随着HA溶液体积变化如图所示(体积变化忽略不计)。
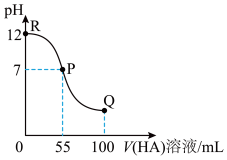
(1)由图中信息可知HA为___________ 酸(填“强”或 “弱”),理由是___________ 。
(2)R点时由水电离出的c(OH-)=___________ mol·L-1。
(3)常温下一定浓度的MA稀溶液中所有离子的浓度由大到小的顺序为:___________ 。
(4)Q点时所得溶液中,c(A-)+c(HA)___________ 2c(M+),c(M+)___________ c(HA)(填“>”、“<”或“=”)。

(1)由图中信息可知HA为
(2)R点时由水电离出的c(OH-)=
(3)常温下一定浓度的MA稀溶液中所有离子的浓度由大到小的顺序为:
(4)Q点时所得溶液中,c(A-)+c(HA)
您最近一年使用:0次



