名校
1 . 下列各溶液中,微粒的物质的量浓度关系正确的是
| A.0.1 mol/L pH<7的NaHSO3溶液中: c(HSO3-)>c(H2SO3)>c(SO32-) |
| B.在NaHCO3 溶液中一定有: c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) |
| C.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2CO3]<c[(NH4)2SO4]<c(NH4Cl) |
| D.10mL 0.5 mol/L CH3COONa溶液与10 mL 1 mol/L盐酸混合: c(Cl-)>c(H+)>c(Na+)>c(CH3COO-)>c(OH-) |
您最近一年使用:0次
2 . 下列有关说法正确的是
| A.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 |
| B.等物质的量浓度的CH3COOH溶液和HCl溶液中,水的电离程度相同 |
| C.0.1 mol/LNa2CO3溶液:c(OH-)=c(H2CO3)+c(HCO3-)+c(H+) |
D.对于反应2SO2+O2  2SO3,使用催化剂能加快反应速率和提高SO2平衡转化率 2SO3,使用催化剂能加快反应速率和提高SO2平衡转化率 |
您最近一年使用:0次
名校
3 . 设pC为溶液中粒子物质的量浓度的负对数,即:pC=-lgC。25℃时,某浓度H2R水溶液中,pC(H2R)、pC(HR-)、pC(R2-)随溶液pH的变化曲线如图所示。下列说法正确的是


| A.曲线I表明,c(R2-)随着pH增大而逐渐增大 |
| B.pH=1.3时,3c(R2-)+c(OH-)=10-1.3mol/L |
| C.常温下,该体系中c2(HR-)/c(R2-)·c(H2R)=1000 |
| D.NaHR水溶液中:c(Na+)>c(HR-)>c(OH-)>c(H+) |
您最近一年使用:0次
2018-05-24更新
|
774次组卷
|
6卷引用:【全国百强】河南省南阳市第一中学2018届高三第十六次考试理综化学试题
4 . 已知饱和碳酸的浓度约为0.033mol/L, Ka1=4.2×10-7、Ka2=5.61×10-11,其中的离子浓度大小顺序是
| A.c(H+)>c(HCO3-)>c(OH-)>(CO32-) |
| B.c(H+)>c(HCO3-)>c(CO32-)>c(OH-) |
| C.c(HCO3-)>c(H+)>c(CO32-)>c(OH-) |
| D.c(H+)>c(CO32-)>c(HCO3-)>c(OH-) |
您最近一年使用:0次
5 . 298K时,在H3PO4溶液中滴入NaOH溶液,溶液中H3PO4、H2PO4-、HPO42-、PO43-的物质的量分数δ(X)随pH的变化如图所示。下列叙述错误的是


| A.K(H3PO4)的数量级为10-8 |
| B.Na2HPO4溶液中:c(PO43-) <c(H2PO4-) |
| C.pH=7时c(H2PO4-)>c(HPO42-) |
| D.NaH2PO4溶液显碱性 |
您最近一年使用:0次
名校
解题方法
6 . H2X 和H2Y均为二元弱酸,常温下,将NaOH 溶液分别加到H2X 和H2Y的溶液中,在不同pH 环境下不同形态的粒子(即酸、酸式酸根、酸根离子)的组成分数如图所示:

下列说法正确的是

下列说法正确的是
| A.在pH=7的溶液中HX-、X2−、HY-和Y2−能大量共存 |
| B.向Na2X溶液中加入少量H2Y 溶液,发生反应:X2−+H2Y=HX-+HY- |
| C.1L.0.1 mol∙L−1NaHY溶液中n(HY-)+2n(Y2−)+n(H2Y) =0.1mol |
| D.HX-的水解平衡常数为Kb=10−7 |
您最近一年使用:0次
2018-01-20更新
|
437次组卷
|
3卷引用:河南省安阳市2018届高三第一次模拟考试理综化学试题
名校
7 . 化学上常用AG表示溶液的lg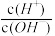 。25℃时,用0.100mol·L-1的NaOH溶液滴定20.00mL0.1mol·L-1的HNO2溶液。AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法不正确的是
。25℃时,用0.100mol·L-1的NaOH溶液滴定20.00mL0.1mol·L-1的HNO2溶液。AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法不正确的是

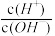 。25℃时,用0.100mol·L-1的NaOH溶液滴定20.00mL0.1mol·L-1的HNO2溶液。AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法不正确的是
。25℃时,用0.100mol·L-1的NaOH溶液滴定20.00mL0.1mol·L-1的HNO2溶液。AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法不正确的是
| A.C点时,加入NaOH溶液的体积不为20mL |
| B.D点溶液的pH=11.25 |
| C.B点溶液中存在2c(H+)-2c(OH-)=c(NO2-)-c(HNO2) |
| D.25℃时,HNO2的电离常数Ka=1.0×10-5.5 |
您最近一年使用:0次
2018-01-16更新
|
473次组卷
|
2卷引用:河南省南乐县第一高级中学2021-2022学年高二下学期3月月考化学试题
名校
解题方法
8 . 常温下有浓度均为0.1 mol 的四种溶液:①Na2CO3 ②NaHCO3 ③HCl ④NH3·H2O
的四种溶液:①Na2CO3 ②NaHCO3 ③HCl ④NH3·H2O
(1)有人称溶液①是油污的“清道夫”,原因是_______ (用离子方程式解释)
(2)这四种溶液中水的电离程度由大到小的顺序是(用序号填写)_______
(3)向④中加入少量氯化铵固体,此时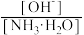 的值
的值_______ (填“增大”“减小”或“不变”)。
(4)等体积混合③和④的溶液,此时溶液中[NH ]+[NH3·H2O]=
]+[NH3·H2O]=_______ mol·L-1(填数值);此时溶液中离子浓度的大小顺序是:_______ ;若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积_______ ④的体积(填“大于”小于”或“等于”)
(5)将10 mL溶液③加水稀释至100 mL,则此时溶液中由水电离出的c( H+)=_______ mol·L-1。
 的四种溶液:①Na2CO3 ②NaHCO3 ③HCl ④NH3·H2O
的四种溶液:①Na2CO3 ②NaHCO3 ③HCl ④NH3·H2O (1)有人称溶液①是油污的“清道夫”,原因是
(2)这四种溶液中水的电离程度由大到小的顺序是(用序号填写)
(3)向④中加入少量氯化铵固体,此时
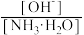 的值
的值(4)等体积混合③和④的溶液,此时溶液中[NH
 ]+[NH3·H2O]=
]+[NH3·H2O]=(5)将10 mL溶液③加水稀释至100 mL,则此时溶液中由水电离出的c( H+)=
您最近一年使用:0次
2018-01-02更新
|
496次组卷
|
3卷引用:河南省滑县第二高级中学2017-2018学年高二12月月考化学试题
名校
解题方法
9 . 碲(Te)的单质和化合物在化工生产等方面具有重要应用。
(1)下列关于碲及其化合物的叙述不正确的是_______。
(2)25℃时,亚碲酸(H2TeO3)的 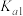 = 1×10-3,
= 1×10-3, 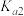 =2×10-8。0. 1 mol . L-1H2TeO3 的电离度 a 约为
=2×10-8。0. 1 mol . L-1H2TeO3 的电离度 a 约为___________ ( ); NaHTeO3的溶液的pH
); NaHTeO3的溶液的pH_______ 7(填“>”、“=”或“<”)。
(3)TeO2微溶于水,易溶于较浓的强酸和强碱。工业上常用铜阳极泥(主要含有TeO2、少量Ag、Au)为原料制备单质碲,其工艺流程如下:

①“碱浸”时TeO2发生反应的化学方程式为_________ 。
②“沉碲”时控制溶液的pH为4. 5~5. 0,生成Tea沉淀。酸性不能过强的原因是_________ ;防止局部酸度过大的操作方法是____________ 。
③“酸溶”后,将SO2通入TeCl4酸性溶液中进行“还原”得到碲,该反应的化学方程式是____________ 。
④工业上还可以通过电解铜阳极泥碱浸、过滤后的滤液得到单质碲。已知电解时的电极均为石墨,则阴极的电极反应式为__________ 。
(1)下列关于碲及其化合物的叙述不正确的是_______。
| A.Te位于元素周期表的第五周期ⅣA族 |
| B.Te的氧化物通常有TeO2和TeO3 |
| C.H2TeO4的酸性比H2SO4酸性强 |
| D.热稳定性H2Te比H2S弱,H2Te比HI强 |
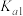 = 1×10-3,
= 1×10-3, 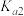 =2×10-8。0. 1 mol . L-1H2TeO3 的电离度 a 约为
=2×10-8。0. 1 mol . L-1H2TeO3 的电离度 a 约为 ); NaHTeO3的溶液的pH
); NaHTeO3的溶液的pH(3)TeO2微溶于水,易溶于较浓的强酸和强碱。工业上常用铜阳极泥(主要含有TeO2、少量Ag、Au)为原料制备单质碲,其工艺流程如下:

①“碱浸”时TeO2发生反应的化学方程式为
②“沉碲”时控制溶液的pH为4. 5~5. 0,生成Tea沉淀。酸性不能过强的原因是
③“酸溶”后,将SO2通入TeCl4酸性溶液中进行“还原”得到碲,该反应的化学方程式是
④工业上还可以通过电解铜阳极泥碱浸、过滤后的滤液得到单质碲。已知电解时的电极均为石墨,则阴极的电极反应式为
您最近一年使用:0次
2017-03-22更新
|
720次组卷
|
3卷引用:2017届河南省洛阳市高三第二次统一考试(3月)理综化学试卷
真题
名校
10 . 下列说法正确的是
A.25℃时 溶液的Kw大于 溶液的Kw大于 时 时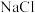 溶液的Kw 溶液的Kw |
B.SO2通入碘水中,反应离子方程式为 |
C.加入铝粉能产生H2的溶液中,可能存在大量的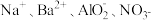 |
D.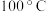 时,将pH=2的盐酸与pH=12的 时,将pH=2的盐酸与pH=12的 溶液等体积混合,溶液显中性 溶液等体积混合,溶液显中性 |
您最近一年使用:0次
2016-12-09更新
|
1238次组卷
|
6卷引用:河南省信阳高级中学2021-2022学年高二下学期4月月考化学试题
河南省信阳高级中学2021-2022学年高二下学期4月月考化学试题2011年普通高等学校招生全国统一考试化学卷(天津)(已下线)2012届云南省昆明一中高三第一次月考化学卷(已下线)2012届湖北省荆州中学高三第一次质量检查化学试卷(已下线)2011-2012学年河北省正定中学高二上学期期中考试化学试卷江西省南城县第二中学2018-2019学年高二上学期第二次月考化学试题



