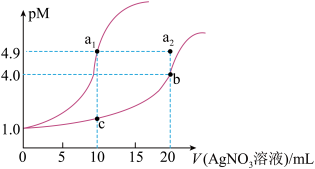
1 . 某温度下,向10mL0.1mol·L-1 NaCl溶液和10 mL 0.1mol·L-1 K2CrO4溶液中分别滴加0.l mol·L-1 AgNO3溶液。滴加过程中pM[-lgc(Cl-)或-lgc(CrO )]与所加AgNO3溶液体积之间的关系如图所示。已知Ag2CrO4为红棕色沉淀。下列说法错误的是
)]与所加AgNO3溶液体积之间的关系如图所示。已知Ag2CrO4为红棕色沉淀。下列说法错误的是
 )]与所加AgNO3溶液体积之间的关系如图所示。已知Ag2CrO4为红棕色沉淀。下列说法错误的是
)]与所加AgNO3溶液体积之间的关系如图所示。已知Ag2CrO4为红棕色沉淀。下列说法错误的是
A.该温度下, |
B. 、b、c三点所示溶液中 、b、c三点所示溶液中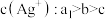 |
| C.若将上述NaCl溶液浓度改为0.2mol·L-1,则a1点会平移至a2点 |
| D.用AgNO3标准溶液滴定NaCl溶液时,可用K2CrO4溶液作指示剂 |
您最近一年使用:0次
名校
解题方法
2 . 一定温度下,氯化银在水中的沉淀溶解平衡曲线如图,下列说法不正确的是


| A.向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp不变 |
| B.向c点的溶液中加入0.1molAgNO3,则c(Cl-)减小 |
| C.图中a点对应的是不饱和溶液 |
| D.升高温度可以实现c点到b点的转化 |
您最近一年使用:0次
2021-10-09更新
|
578次组卷
|
7卷引用:山东省“山东学情”2021-2022学年高二11月期中联考化学(A)试题
3 . T1、T2两种温度下 在水中的沉淀溶解平衡曲线如图所示,请回答下列问题。
在水中的沉淀溶解平衡曲线如图所示,请回答下列问题。
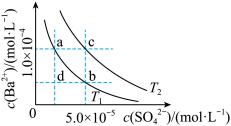
(1)T1___________ T2 (填“>”“<”或“=”),T2温度时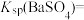
___________ 。
(2)根据T1温度时 的沉淀溶解平衡曲线,判断下列说法正确的是
的沉淀溶解平衡曲线,判断下列说法正确的是___________ (填序号)。
A.加入 固体可由a点变为b点
固体可由a点变为b点
B.T1温度下,在T1曲线上方区域(不含曲线)的任意一点时,均有 沉淀生成
沉淀生成
C.蒸发溶剂可能由d点变为T1,曲线上a、b之间(不含a、b)的某一点
D.升温可由b点变为d点
(3) T2温度时,现有0.2mol的 沉淀,每次用1 L饱和
沉淀,每次用1 L饱和 溶液(浓度为1.7mol/L)处理。若使
溶液(浓度为1.7mol/L)处理。若使 中的
中的 全部转化到溶液中,需要反复处理
全部转化到溶液中,需要反复处理___________ 次[提示: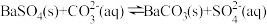
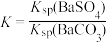 ,
,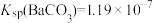 ]。
]。
 在水中的沉淀溶解平衡曲线如图所示,请回答下列问题。
在水中的沉淀溶解平衡曲线如图所示,请回答下列问题。
(1)T1
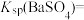
(2)根据T1温度时
 的沉淀溶解平衡曲线,判断下列说法正确的是
的沉淀溶解平衡曲线,判断下列说法正确的是A.加入
 固体可由a点变为b点
固体可由a点变为b点B.T1温度下,在T1曲线上方区域(不含曲线)的任意一点时,均有
 沉淀生成
沉淀生成C.蒸发溶剂可能由d点变为T1,曲线上a、b之间(不含a、b)的某一点
D.升温可由b点变为d点
(3) T2温度时,现有0.2mol的
 沉淀,每次用1 L饱和
沉淀,每次用1 L饱和 溶液(浓度为1.7mol/L)处理。若使
溶液(浓度为1.7mol/L)处理。若使 中的
中的 全部转化到溶液中,需要反复处理
全部转化到溶液中,需要反复处理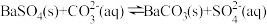
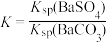 ,
,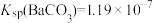 ]。
]。
您最近一年使用:0次
2021-08-07更新
|
1027次组卷
|
12卷引用:山东省东营市第一中学2021-2022学年高二上学期期中考试化学试题
山东省东营市第一中学2021-2022学年高二上学期期中考试化学试题课选择性必修1 专题3 第四单元 课时2 Ksp相关计算及其图像分析(已下线)3.4.1 沉淀溶解平衡-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)3.4.2 沉淀溶解平衡的应用-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)3.4.1 难溶电解质的沉淀溶解平衡(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡 课时2 Ksp图象及其相关计算高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡 课时2 Ksp图像及其相关计算(已下线)第3章 章末检测-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)3.4.1 沉淀溶解平衡-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)3.4.2沉淀溶解平衡原理的应用 课中微专题(11) 沉淀溶解平衡图像分析上海市向明中学 2023-2024学年高三上学期9月质量监控化学试题
解题方法
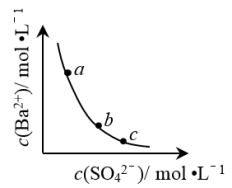
4 . 一定温度下,BaSO4(s)⇌Ba2+(aq)+ (aq)平衡体系中,c(Ba2+)和c(
(aq)平衡体系中,c(Ba2+)和c( )的关系如图所示。下列说法正确的是
)的关系如图所示。下列说法正确的是
 (aq)平衡体系中,c(Ba2+)和c(
(aq)平衡体系中,c(Ba2+)和c( )的关系如图所示。下列说法正确的是
)的关系如图所示。下列说法正确的是
| A.a、b、c三点对应的KW不相等 |
B.a、b、c三点对应c(Ba2+)•c( )的数值,a点最大 )的数值,a点最大 |
C.BaSO4在水中形成的饱和溶液,c(Ba2+)=c( ) ) |
| D.a点对应的溶液中加入BaSO4固体,c(Ba2+)沿曲线向b、c点方向变化 |
您最近一年使用:0次
解题方法
5 . 根据下列实验操作和现象所得到的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | Fe粉用稀硫酸完全溶解后滴加KSCN溶液,溶液不变红 | Fe粉没有被氧化 |
| B | 向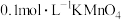 溶液中滴加H2O2溶液,溶液紫色褪去 溶液中滴加H2O2溶液,溶液紫色褪去 | H2O2具有氧化性 |
| C | 室温下测得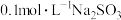 溶液pH约为10, 溶液pH约为10,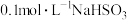 溶液pH约为5 溶液pH约为5 |  结合H+的能力比 结合H+的能力比 弱 弱 |
| D | 向黄色难溶物PbI2中加水并充分振荡,静置后取上层清液,滴加NaI溶液产生黄色沉淀 | PbI2存在沉淀溶解平衡 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
6 . 常温下,Cu(OH)2和Fe(OH)3饱和溶液的浓度随pH的变化如图所示,已知:Ksp[Cu(OH)2]=1×10-20,Ksp[Fe(OH)3]=1×10-38.下列说法正确的是
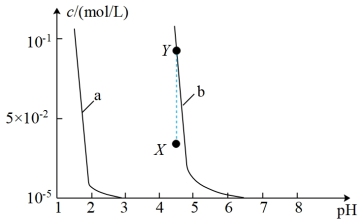

| A.曲线a对应的是Fe(OH)3饱和溶液 |
| B.调节pH为4.5可除去FeCl3中的CuCl2 |
| C.酸性溶液中Cu元素的存在形式可能为Cu2+或Cu(OH)2 |
| D.滴加NaOH溶液,可实现X到Y的转化 |
您最近一年使用:0次
解题方法
7 . 常温下,向20mL0.1mol·L-1BaCl2溶液中滴加0.2mol·L-1Na2CO3溶液的滴定曲线如图所示。已知:pBa=-lgc(Ba2+),pKa=-lgKa;常温下H2CO3:pKa1=6.4,pKa2=10.3。下列说法正确的是
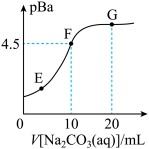

| A.常温下,Na2CO3溶液的pKh1=3.7(Kh1为一级水解常数) |
| B.常温下,Ksp(BaCO3)≈1.0×10-9 |
| C.E、F、G三点的Ksp从大到小的顺序为:G>F>E |
| D.其他条件相同,用MgCl2溶液替代BaCl2溶液,F点向G点迁移 |
您最近一年使用:0次
解题方法
8 . 常温时,若Ca(OH)2和CaWO4(钨酸钙)的沉淀溶解平衡曲线如图所示(已知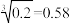 )。下列分析正确的是
)。下列分析正确的是

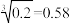 )。下列分析正确的是
)。下列分析正确的是
A.由图可知常温下 |
| B.饱和Ca(OH)2溶液中加入少量CaO,溶液变浑浊,但Ca2+离子数目不变 |
C.饱和Ca(OH)2溶液和饱和CaWO4溶液等体积混合: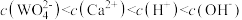 |
| D.d点的CaWO4溶液中,加入CaCl2固体,d点溶液组成沿da线向c点移动(假设混合后溶液体积不变) |
您最近一年使用:0次
9 . 硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。工业生产中利用方铅矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbSO4的工艺流程如图:

已知:i.PbCl2难溶于冷水,易溶于热水
ii.PbCl2(s)+2Cl-(aq)⇌PbCl (aq) △H>0
(aq) △H>0
iii.Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×10-5
(1)“浸取”过程中盐酸与MnO2、PbS发生反应生成PbCl2和S的化学方程式为_______ ,加入NaCl的目的是_______ 。
(2)沉降操作时加入冰水的作用是_______ 。
(3)20°C时,PbCl2(s)在不同浓度盐酸中的最大溶解量(g•L-1)如图所示。下列叙述正确的是_______ (填字母)
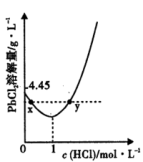
A.盐酸浓度越小,Ksp(PbCl2)越小
B.x、y两点对应的溶液中c(Pb2+)不相等
C当盐酸浓度为1mol•L-1时,溶液中c(Pb2+)一定最小
D.当盐酸浓度小于1mol•L-1时,随HCl浓度增大,PbCl2溶解量减少是因为Cl-浓度增大使PbCl2溶解平衡逆向移动
(4)调pH的目的是_______ ,PbCl2“转化”后得到PbSO4,当c(Cl-)=0.100mol/L时,c( )=
)=_______ 。
(5)滤液a经过处理后可以返回到_______ 工序循环使用

已知:i.PbCl2难溶于冷水,易溶于热水
ii.PbCl2(s)+2Cl-(aq)⇌PbCl
 (aq) △H>0
(aq) △H>0iii.Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×10-5
(1)“浸取”过程中盐酸与MnO2、PbS发生反应生成PbCl2和S的化学方程式为
(2)沉降操作时加入冰水的作用是
(3)20°C时,PbCl2(s)在不同浓度盐酸中的最大溶解量(g•L-1)如图所示。下列叙述正确的是

A.盐酸浓度越小,Ksp(PbCl2)越小
B.x、y两点对应的溶液中c(Pb2+)不相等
C当盐酸浓度为1mol•L-1时,溶液中c(Pb2+)一定最小
D.当盐酸浓度小于1mol•L-1时,随HCl浓度增大,PbCl2溶解量减少是因为Cl-浓度增大使PbCl2溶解平衡逆向移动
(4)调pH的目的是
 )=
)=(5)滤液a经过处理后可以返回到
您最近一年使用:0次
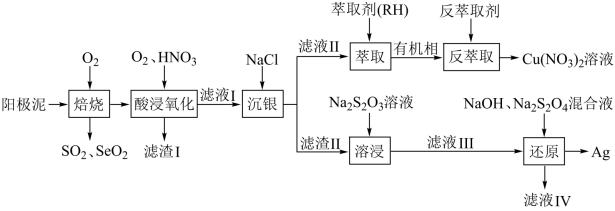
10 . 一种从阳极泥(主要成分为 Cu、Ag、Pt、Au、Ag2Se和Cu2S等)中回收 Se和贵重金属的工艺流程如下图所示。
已知:①该工艺中萃取与反萃取原理为: ;
;
② 易与 Ag+形成配离子:
易与 Ag+形成配离子: ,常温下该反应的平衡常数
,常温下该反应的平衡常数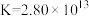 。
。
回答下列问题:
(1)“焙烧”产生的SO2与 SeO2的混合烟气可用水吸收制得单质 Se,该反应的化学方程式为_______ 。
(2)“滤渣Ⅰ”的主要成分是_______ ;“酸浸氧化”中通入氧气的目的是_______ 。
(3)“反萃取剂”最好选用_______ (填化学式)溶液。
(4)“溶浸”中发生的反应为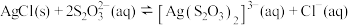 ,该反应的平衡常数K'=
,该反应的平衡常数K'=_______ 。[已知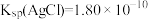 ]
]
(5)“滤液IV”中含有 Na2SO3,则“还原”中发生反应的离子方程式为_______ ;“滤液 IV”可返回“溶浸”工序循环使用,但循环多次后,银的浸出率会降低,原因是_______ (试用平衡原理解释)。

已知:①该工艺中萃取与反萃取原理为:
 ;
;②
 易与 Ag+形成配离子:
易与 Ag+形成配离子: ,常温下该反应的平衡常数
,常温下该反应的平衡常数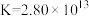 。
。回答下列问题:
(1)“焙烧”产生的SO2与 SeO2的混合烟气可用水吸收制得单质 Se,该反应的化学方程式为
(2)“滤渣Ⅰ”的主要成分是
(3)“反萃取剂”最好选用
(4)“溶浸”中发生的反应为
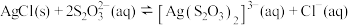 ,该反应的平衡常数K'=
,该反应的平衡常数K'=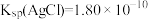 ]
](5)“滤液IV”中含有 Na2SO3,则“还原”中发生反应的离子方程式为
您最近一年使用:0次
2021-03-11更新
|
780次组卷
|
3卷引用:山东省临沂市2021届高三第一次模拟考试化学试题
山东省临沂市2021届高三第一次模拟考试化学试题山东省2020-2021学年普通高中学业水平等级考试化学试题(已下线)专题16 工艺流程综合题-备战2022年高考化学真题及地市好题专项集训【山东专用】



