名校
1 . 请同学们仔细阅读下表,并回答下列问题:
(1)写出①的元素符号___ ,②的原子结构示意图___ ,④的周期___ ,⑤的族___ ;
(2)甲元素最高价氧化物对应的水化物呈___ 性(填“酸”或“碱”),乙元素最高价氧化物对应的水化物的化学式为___ ,甲元素最高价氧化物对应的水化物与乙元素最高价氧化物对应的水化物相互反应的化学方程式为___ ;
(3)甲与乙两元素的单质反应生成物的电子式为___ 。
| 元素 | 甲 | 乙 | 丙 |
| 元素符号 | ① | Cl | O |
| 原子结构示意图 |  | ② | ③ |
| 周期 | 三 | ④ | 二 |
| 族 | ⑤ | ⅦA | ⅥA |
(2)甲元素最高价氧化物对应的水化物呈
(3)甲与乙两元素的单质反应生成物的电子式为
您最近一年使用:0次
名校
2 . 下表是元素周期表的一部分,表中序号分别代表某一元素 请回答下列问题。
请回答下列问题。
(1)①-⑩中,最活泼的金属元素是______ (写元素符号,下同);最不活泼的元素是 ______ ;可作半导体材料的元素是 ______ ;某元素的气态氢化物与其最高价氧化物的水化物可直接化合生成一种盐,该元素是______ 。
(2)④、⑤的简单离子,其半径更大的是______ (写离子符号)。
(3)⑧、⑨的气态氢化物,更稳定的是______ (填化学式)。
(4)元素的非金属性:①______ ⑦填“ ”或“
”或“ ”)。
”)。
(5)①-⑨的最高价氧化物的水化物中:碱性最强的是______ (填化学式),酸性最强的是 _________ (填化学式); 盐酸与⑥的最高价氧化物对应的水化物反应的离子方程式为 ______________________________ 。
 请回答下列问题。
请回答下列问题。 | 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)①-⑩中,最活泼的金属元素是
(2)④、⑤的简单离子,其半径更大的是
(3)⑧、⑨的气态氢化物,更稳定的是
(4)元素的非金属性:①
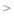 ”或“
”或“ ”)。
”)。(5)①-⑨的最高价氧化物的水化物中:碱性最强的是
您最近一年使用:0次
名校
解题方法
3 . 结合元素周期表回答下列问题:
(1)①表中实线是元素周期表的部分边界,请在图1中用实线补全元素周期表的边界________
②请画出金属与非金属的分界线________
③请在方框中(图3)按氦元素的式样写出h元素原子的相关信息________


(2)X、Y、Z是周期表中相邻的三种短周期元素,X和Y同周期,Y和Z同主族,三种元素原子的最外层电子数之和为17,核内质子数之和为31。
①X是______ , Z是______ (填写元素名称)
②X, Y, Z 三种元素的简单离子半径大小顺序是_____________________________
③三种元素形成的单质氧化性最强的化学式为______
(1)①表中实线是元素周期表的部分边界,请在图1中用实线补全元素周期表的边界
②请画出金属与非金属的分界线
③请在方框中(图3)按氦元素的式样写出h元素原子的相关信息


(2)X、Y、Z是周期表中相邻的三种短周期元素,X和Y同周期,Y和Z同主族,三种元素原子的最外层电子数之和为17,核内质子数之和为31。
①X是
②X, Y, Z 三种元素的简单离子半径大小顺序是
③三种元素形成的单质氧化性最强的化学式为
您最近一年使用:0次
名校
4 . 下表为元素周期表的一部分,表中列出10种元素在周期表中的位置,按要求回答下列问题。
(1)在这10种元素中,化学性质最不活泼的元素是________ (写序号),得电子能力最强的原子是________ (用元素符号表示);元素⑦的最高价氧化物对应的水化物是________________ (写化学式)。
(2)元素④的离子结构示意图为________________ 。
(3)①⑧⑨三种元素单核离子半径由大到小的顺序是(用相应的离子符号表示)________________ 。
(4)请写出:
(i)③的单质置换出⑥的单质的化学方程式:________________________ 。
(ii)①和⑤两种元素最高价氧化物对应的水化物相互反应的化学方程式为____________________ 。
(iii)②和⑨两种元素最高价氧化物对应的水化物相互反应的离子方程式为____________________ 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ⑥ | ⑧ | ⑩ | |||||
| 三 | ① | ③ | ⑤ | ⑦ | ⑨ | |||
| 四 | ② | ④ |
(1)在这10种元素中,化学性质最不活泼的元素是
(2)元素④的离子结构示意图为
(3)①⑧⑨三种元素单核离子半径由大到小的顺序是(用相应的离子符号表示)
(4)请写出:
(i)③的单质置换出⑥的单质的化学方程式:
(ii)①和⑤两种元素最高价氧化物对应的水化物相互反应的化学方程式为
(iii)②和⑨两种元素最高价氧化物对应的水化物相互反应的离子方程式为
您最近一年使用:0次
名校
5 . 某简单离子的结构示意图可表示为: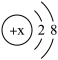 ,当x=8时,该粒子符号为
,当x=8时,该粒子符号为________ ;当x=11时,该粒子符号为________ ;当x=13时,写出该粒子的硝酸盐的化学式为________ .
 ,当x=8时,该粒子符号为
,当x=8时,该粒子符号为
您最近一年使用:0次
名校
6 . 下表是元素周期表的一部分,表中序号分别代表某一元素 请回答下列问题.
请回答下列问题.
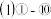 中,最活泼的金属元素是
中,最活泼的金属元素是 ______ (写元素符号,下同);最不活泼的元素是 ______ ;可作半导体材料的元素是 ______ ;某元素的气态氢化物与其最高价氧化物的水化物可直接化合生成一种盐,该元素是______ .
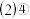 、
、 的简单离子,其半径更大的是
的简单离子,其半径更大的是 ______ (写离子符号).
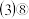 、
、 的气态氢化物,更稳定的是
的气态氢化物,更稳定的是 ______ (填化学式).
 元素的非金属性:
元素的非金属性:
______ 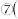 填“
填“ ”或“
”或“ ”).
”).
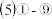 的最高价氧化物的水化物中:碱性最强的是
的最高价氧化物的水化物中:碱性最强的是 ______ (填化学式),酸性最强的是 _____ (填化学式); 酸性最强的物质与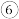 的最高价氧化物对应的水化物反应的离子方程式为
的最高价氧化物对应的水化物反应的离子方程式为 ______________________________ .
 请回答下列问题.
请回答下列问题. | 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 |  |  |  |  | ||||
| 3 |  | 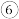 | 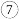 |  |  | 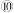 |
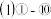 中,最活泼的金属元素是
中,最活泼的金属元素是 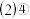 、
、 的简单离子,其半径更大的是
的简单离子,其半径更大的是 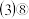 、
、 的气态氢化物,更稳定的是
的气态氢化物,更稳定的是  元素的非金属性:
元素的非金属性:
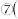 填“
填“ ”或“
”或“ ”).
”).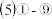 的最高价氧化物的水化物中:碱性最强的是
的最高价氧化物的水化物中:碱性最强的是 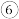 的最高价氧化物对应的水化物反应的离子方程式为
的最高价氧化物对应的水化物反应的离子方程式为
您最近一年使用:0次
名校
7 . I. 填空:
(1)写出表示含有8个质子、10个中子的原子的化学符号:_________ 。
(2)元素周期表中位于第8纵行的铁元素属于_________ 族。
(3)元素周期表中最活泼的非金属元素位于第_________ 纵行。
(4)所含元素超过18种的周期是第_________ 周期。
II. 4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性。
(1)元素x在周期表中的位置是第________ 周期、第________ 族。
(2)四种元素最高价氧化物的水化物中,酸性最强的是_____ ,碱性最强的是_____ (填化学式)。
(1)写出表示含有8个质子、10个中子的原子的化学符号:
(2)元素周期表中位于第8纵行的铁元素属于
(3)元素周期表中最活泼的非金属元素位于第
(4)所含元素超过18种的周期是第
II. 4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性。
| m | n | ||
| x | y |
(1)元素x在周期表中的位置是第
(2)四种元素最高价氧化物的水化物中,酸性最强的是
您最近一年使用:0次
名校
8 . 下表为元素周期表的一部分,表中列出11种元素在周期表中的位置,按要求回答下列各题:
(1)这11种元素中,化学性质最不活泼的元素是______ (填元素符号,下同),得电子能力最强的原子是______ ,失电子能力最强的单质与水反应的化学方程式是___________________ ,常温下单质为液态的非金属单质是____________ 。
(2)元素④的离子结构示意图为__________________ 。
(3)⑥⑦⑧气态氢化物的化学式分别为________ 、________ 、________ ,其中以_______ 最稳定。⑦⑨两种元素最高价氧化物对应水化物的化学式分别为________ 、________ ;其中以________ 酸性最强。
(4)写出③的单质置换出⑥的单质的化学方程式:__________________ 。
①和⑤两种元素最高价氧化物对应的水化物相互反应的离子方程式为_____________ 。
②和⑨两种元素最高价氧化物对应的水化物相互反应的离子方程式为_____________ 。
②的最高价氧化物对应水化物的水溶液与⑤的最高价氧化物反应的化学方程式为________ 。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑧ | ⑪ | |||||
| 3 | ① | ③ | ⑤ | ⑦ | ⑨ | |||
| 4 | ② | ④ | ⑩ |
(1)这11种元素中,化学性质最不活泼的元素是
(2)元素④的离子结构示意图为
(3)⑥⑦⑧气态氢化物的化学式分别为
(4)写出③的单质置换出⑥的单质的化学方程式:
①和⑤两种元素最高价氧化物对应的水化物相互反应的离子方程式为
②和⑨两种元素最高价氧化物对应的水化物相互反应的离子方程式为
②的最高价氧化物对应水化物的水溶液与⑤的最高价氧化物反应的化学方程式为
您最近一年使用:0次
名校
解题方法
9 . 近年来连续出现的铊中毒事件,给各科研单位及学校危险药品的管理敲响了警钟。铊的相关信息卡片如图所示:

(1)铊的原子序数为81,铊在元素周期表中位于第________ 周期第________ 族。
(2)若设铊的质量数为A,则铊原子中中子数和质子数之差为____________ 。
(3)下列推断正确的是________ 。
A.单质的还原性:Tl>Al B.原子半径:Al>Tl
C.碱性:Al(OH)3>Tl(OH)3 D.氧化性:Tl3+>Al3+
(4)铊(Tl)是某超导材料的组成元素之一。Tl3+与Ag在酸性介质中发生反应:
Tl3++2Ag===Tl++2Ag+。下列推断正确的是________ 。
A.Tl+最外层有1个电子 B.Tl能形成+3价和+1价的化合物
C.Tl3+的氧化性比Ag+弱 D.Tl+的还原性比Ag强

(1)铊的原子序数为81,铊在元素周期表中位于第
(2)若设铊的质量数为A,则铊原子中中子数和质子数之差为
(3)下列推断正确的是
A.单质的还原性:Tl>Al B.原子半径:Al>Tl
C.碱性:Al(OH)3>Tl(OH)3 D.氧化性:Tl3+>Al3+
(4)铊(Tl)是某超导材料的组成元素之一。Tl3+与Ag在酸性介质中发生反应:
Tl3++2Ag===Tl++2Ag+。下列推断正确的是
A.Tl+最外层有1个电子 B.Tl能形成+3价和+1价的化合物
C.Tl3+的氧化性比Ag+弱 D.Tl+的还原性比Ag强
您最近一年使用:0次
名校
10 . 下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。

试回答下列问题:
(1)元素p为26号元素,请写出其原子的三价阳离子的电子排布式:______________ 。
(2)e与a反应的产物的分子中中心原子的杂化形式为__________ ,该分子是__________ (填“极性”或“非极性”)分子。
(3)请写出f的氢化物在水中所存在氢键的表达式:(任写两种即可)_________________________ 。
(4)o、p两元素的部分电离能数据列于下表:
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是___________________________________ ;
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

请问晶胞中i原子的配位数为________ ,一个晶胞中i原子的数目为________ 。

试回答下列问题:
(1)元素p为26号元素,请写出其原子的三价阳离子的电子排布式:
(2)e与a反应的产物的分子中中心原子的杂化形式为
(3)请写出f的氢化物在水中所存在氢键的表达式:(任写两种即可)
(4)o、p两元素的部分电离能数据列于下表:
| 元素 | o | p | |
| 电离能 /kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1 509 | 1 561 | |
| I3 | 3 248 | 2 957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

请问晶胞中i原子的配位数为
您最近一年使用:0次
2017-07-19更新
|
50次组卷
|
2卷引用:宁夏银川市第一中学2016-2017学年高二下学期期末考试化学试题



