名校
1 . 下列叙述中,不正确的是
| A.HF、HCl、HBr、HI的稳定性依次增强 |
| B.臭氧是空间结构为V形的极性分子,在水中的溶解度大于氧气 |
| C.硝酸根离子中所有原子都在一个平面上 |
| D.CH3CH(OH)COOH为手性分子 |
您最近一年使用:0次
2021-01-15更新
|
1161次组卷
|
5卷引用:湖南省邵阳市第二中学2023-2024学年高二下学期入学考试化学试题
名校
解题方法
2 . 2001年是伟大的化学家、1954年诺贝尔化学奖得主、著名的化学结构大师、20世纪的科学怪杰鲍林(Linus Pauling)教授诞辰100周年(1901~1994)。1994年这位世纪老人谢世,人们打开他的办公室,发现里面有一块黑板,画得满满的,其中一个结构式如图所示。老人为什么画这个结构式?它是生命前物质?它能合成吗?它有什么性质?不得而知。这是鲍林留给世人的一个谜,也许这是永远无法解开的谜;也许你有朝一日能解开它,不管结果如何,让我们先对这个结构作一番考察:

(1)它的所有原子能否处于同一个平面上___________ (填“能”或“否”)。
(2)它是否带有电荷___________ (填“是”或“否”),C、N、O三种元素的第一电离能由小到大的顺序为___________ 。
(3)该分子中 杂化的N原子有
杂化的N原子有___________ 个。
(4)人们猜它是炸药的原因是___________ 。
(5)金属钼的晶胞结构如图所示,其晶胞堆积模型是___________ ;已知钼晶体密度为
 ,用
,用 表示阿伏加德罗常数的值,则金属钼的晶胞中两个钼原子的最小核间距为
表示阿伏加德罗常数的值,则金属钼的晶胞中两个钼原子的最小核间距为___________  。
。


(1)它的所有原子能否处于同一个平面上
(2)它是否带有电荷
(3)该分子中
 杂化的N原子有
杂化的N原子有(4)人们猜它是炸药的原因是
(5)金属钼的晶胞结构如图所示,其晶胞堆积模型是

 ,用
,用 表示阿伏加德罗常数的值,则金属钼的晶胞中两个钼原子的最小核间距为
表示阿伏加德罗常数的值,则金属钼的晶胞中两个钼原子的最小核间距为 。
。
您最近一年使用:0次
解题方法
3 . 下列说法正确的是
A.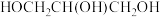 与 与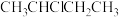 都是手性分子 都是手性分子 |
B. 和 和 的空间构型不相似 的空间构型不相似 |
C. 与 与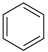 都是平面型分子 都是平面型分子 |
D. 和 和 都是直线型分子 都是直线型分子 |
您最近一年使用:0次
2020-08-26更新
|
135次组卷
|
3卷引用:湖南省永州市祁阳县第四中学2022-2023学年高二下学期第一次段考化学试题
名校
解题方法
4 . 美国化学家鲍林教授具有独特的化学想象力:只要给他物质的分子式,他就能大体上想象出这种物质的分子结构模型.多核离子所带电荷可以认为是中心原子得失电子所致,根据VSEPR模型,下列离子中所有原子都在同一平面上的一组是( )
A.NO 和NH 和NH | B.H3O+和ClO |
C.NO 和CO 和CO | D.PO 和SO 和SO |
您最近一年使用:0次
2020-06-17更新
|
492次组卷
|
16卷引用:湖南省长沙市长郡中学2022-2023学年高二上学期期末考试化学试题
湖南省长沙市长郡中学2022-2023学年高二上学期期末考试化学试题2016届山东省青岛市胶州一中高三上学期11月模拟化学试卷山西省沁县中学2018-2019学年高二下学期第一次月考化学试题宁夏回族自治区吴忠市吴忠中学2020年高二化学人教版选修3第二章《分子结构与性质》单元测试山西省孝义市2019-2020学年高二下学期3月阶段性考试化学试题新疆博尔塔拉蒙古自治州第五师高级中学2019-2020学年高二下学期期中考试化学试题河南省驻马店市正阳县高级中学2019-2020高二下学期第一次素质检测化学试题甘肃省静宁县第一中学2019-2020学年高二下学期期中考试(第二次月考)化学试题(实验班)新疆维吾尔自治区新源县第二中学2019-2020学年高二上学期第一次阶段测试化学试题广东省广州市真光中学2021-2022学年高二下学期3月月考化学试题吉林省白城市镇赉县第一中学校2021-2022学年高二下学期第一次月考化学试题(已下线)黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试变式汇编(1-10)江西省宜春市铜鼓中学2022-2023学年高二下学期第一次段考化学试题河南省淮滨高级中学2022-2023学年高二下学期期中教学质量检测化学试题广东省珠海市第一中学2022-2023学年高三下学期2月月考化学试题河南省信阳市第十高级中学2022-2023学年高二下学期期中教学质量检测化学试卷
解题方法
5 . 钛酸锌(ZnTiO3)是一种抗菌涂料,应用于人造骨骼等生物移植技术。回答下列问题:
(1)基态Zn原子的电子占据能量最高的能层符号为_____________ ,与Zn同周期的所有副族元素的基态原子中,最外层电子数与Zn相同的元素有___________ 种
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。则电负性C____ B(选填“>或“<”);第一电离能N>O,原因是__________________________________________ 。
(3)ZnTiO3与80%H2SO4反应可生成TiOSO4。
① 的空间构型为
的空间构型为_____________ ,其中硫原子采用____________ 杂化。
②与 互为等电子体的分子的化学式为
互为等电子体的分子的化学式为_________________ (任写一种即可)
(4)Zn与S所形成化合物晶体的晶胞如图所示。

①与Zn原子距离最近的Zn原子有___________ 个。
②该化合物的化学式为_________________________________ 。
③已知该晶体的晶胞参数为a×10-12m,阿伏加 德罗常数为NA。则该晶体的密度为__________________ g/cm3(列式即可)
(1)基态Zn原子的电子占据能量最高的能层符号为
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。则电负性C
(3)ZnTiO3与80%H2SO4反应可生成TiOSO4。
①
 的空间构型为
的空间构型为②与
 互为等电子体的分子的化学式为
互为等电子体的分子的化学式为(4)Zn与S所形成化合物晶体的晶胞如图所示。

①与Zn原子距离最近的Zn原子有
②该化合物的化学式为
③已知该晶体的晶胞参数为a×10-12m,阿伏加 德罗常数为NA。则该晶体的密度为
您最近一年使用:0次
名校
解题方法
6 . 下列表达方式正确的是( )
| A.24Cr 的外围电子排布式:3d44s2 |
B.CO2的立体结构模型 |
C.基态碳原子的价电子排布图为 |
D.N2的电子式: |
您最近一年使用:0次
2020-03-28更新
|
561次组卷
|
11卷引用:湖南省株洲市渌口区第三中学2022-2023学年高二下学期期中考试化学试题
湖南省株洲市渌口区第三中学2022-2023学年高二下学期期中考试化学试题山西省实验中学2019-2020学年高二下学期第一次月考化学试题山西省柳林县2020--2021学年高二下学期期中考试化学试题四川省成都市蒲江县蒲江中学2020-2021学年高二3月月考化学试题天津市武清区杨村第一中学2021-2022学年高二下学期第一次月考化学试题浙江省宁波市咸祥中学2021-2022学年高二下学期期中考试化学试题广东省普宁市第二中学2021-2022学年高二下学期期中考试化学试题广东省广州市真光中学2021-2022学年高二下学期3月月考化学试题吉林省长春外国语学校2021-2022学年高二下学期阶段测试化学试题浙江省丽水外国语学校高中部2021-2022学年高二下学期第一次阶段性考试(3月)化学试题山东省平邑县第一中学2022-2023学年高二下学期第一次月考化学试题
名校
解题方法
7 . 下列表述正确的是
A.Na2O2的电子式: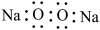 |
| B.N2的共价键类型:σ键和π键 |
C.中子数为30的Fe原子符号: Fe Fe |
| D.SO3分子的立体构型:三角锥形 |
您最近一年使用:0次
2020-03-09更新
|
1375次组卷
|
9卷引用:湖南省衡阳市田家炳实验中学2021-2022学年高二下学期3月质量检测化学试题
名校
解题方法
8 . 据报道,我国化学研究人员用Ni(NO3)2和Tb(CH3COO)3等合成了一个镍的一维链状配位聚合物(如图),对镍配合物在磁性、电化学性质等方面的研究提出了理论指导。
请回答下列问题:
(1)基态Ni原子的价电子轨道表达式为____________ ,Ni在元素周期表中处于第____________ 纵行。
(2)C、N、O三种元素中电负性最大的是____ (填元素符号),C在形成化合物时,其键型以共价键为主,原因是_____________ 。
(3)Ni(NO3)2中阴离子的空间构型是______ ,写出与该阴离子互为等电子体的一种分子的化学式:________ 。
(4)一维链状配位聚合物中,碳原子的杂化形式为________________________ 。
(5)已知: CH3COOH的沸点为117.9℃, HCOOCH3的沸点为32℃,CH3COOH的沸点高于 HCOOCH3的主要原因是______ 。
(6)已知:氧化镍的晶胞结构如图所示。
①若NA为阿伏加 德罗常数的值,晶体密度为ρg·cm-3,则该晶胞中最近的O2-之间的距离为____ pm(用含ρ、NA的代数式表示)。
②某缺陷氧化镍的组成为 Ni0.97O,其中Ni元素只有+2和+3两种价态,两种价态的镍离子数目之比为___ 。
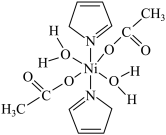
请回答下列问题:
(1)基态Ni原子的价电子轨道表达式为
(2)C、N、O三种元素中电负性最大的是
(3)Ni(NO3)2中阴离子的空间构型是
(4)一维链状配位聚合物中,碳原子的杂化形式为
(5)已知: CH3COOH的沸点为117.9℃, HCOOCH3的沸点为32℃,CH3COOH的沸点高于 HCOOCH3的主要原因是
(6)已知:氧化镍的晶胞结构如图所示。
①若NA为阿伏加 德罗常数的值,晶体密度为ρg·cm-3,则该晶胞中最近的O2-之间的距离为
②某缺陷氧化镍的组成为 Ni0.97O,其中Ni元素只有+2和+3两种价态,两种价态的镍离子数目之比为

您最近一年使用:0次
名校
9 . 下列分子的中心原子是 sp2 杂化的是( )
| A.CH4 | B.BF3 | C.H2O | D.NF3 |
您最近一年使用:0次
2019-11-21更新
|
208次组卷
|
3卷引用:湖南省怀化市中方县第一中学2021-2022学年高二下学期3月教学质量检测化学试题
名校
解题方法
10 . 氮的最高价氧化物为无色晶体,它由两种离子构成,已知其阴离子构型为平面三角形,则其阳离子的构型和阳离子中氮的杂化方式为( )
| A.平面三角形 sp2杂化 | B.V形 sp2杂化 |
| C.三角锥形 sp3杂化 | D.直线形 sp杂化 |
您最近一年使用:0次
2019-06-23更新
|
318次组卷
|
11卷引用:湖南省长沙市长郡梅溪湖中学2021-2022学年高二下学期入学考试化学试题
湖南省长沙市长郡梅溪湖中学2021-2022学年高二下学期入学考试化学试题2014-2015辽宁省葫芦岛市高二下学期市五校协作体期中化学试卷2016届河南省郑州市第一中学新高三年级调研检测化学试卷辽宁省辽河油田第二高级中学2018-2019学年高二下学期期中考试化学试题吉林省辽源市东辽县第一高级中学2019-2020高二5月月考化学试题(已下线)考向37 分子结构与性质-备战2022年高考化学一轮复习考点微专题吉林省实验中学2021-2022学年高二下学期线上质量检测化学试题第二章 本章复习提升2湖北省黄冈市麻城市第二中学2021-2022学年高二下学期3月月考化学试题 吉林省汪清县汪清四中2020-2021学年高二下学期期末考试化学试题黑龙江省富锦市第一中学2022-2023学年高二上学期期末考试化学试题



