名校
解题方法
1 . 钴的化合物在工业中有重要用途。请回答下列问题:
(1) 中配体NH3为
中配体NH3为___________ (填“极性”或“非极性”)分子,NH3分子中N-H键的键角___________ (填“>”、“<”或“=”) 中N-H键的键角,原因为
中N-H键的键角,原因为___________ 。
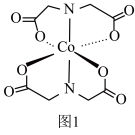
(2)Co的一种配合物结构如图1,其配位数为___________ ,C、N、O的第一电离能由大到小的顺序为___________ (填元素符号),其中C原子的杂化方式为___________ 。 )的一种氧化物在纳米储能领域应用广泛,其晶胞结构如图2所示(白球为Co,黑球为O)。已知该晶胞的晶胞参数为a pm,阿伏加德罗常数的值为NA。
)的一种氧化物在纳米储能领域应用广泛,其晶胞结构如图2所示(白球为Co,黑球为O)。已知该晶胞的晶胞参数为a pm,阿伏加德罗常数的值为NA。___________ 。
②与O原子最近且等距离的O原子有___________ 个。
③该晶体的密度为___________ g·cm-3。
(1)
 中配体NH3为
中配体NH3为 中N-H键的键角,原因为
中N-H键的键角,原因为(2)Co的一种配合物结构如图1,其配位数为
 )的一种氧化物在纳米储能领域应用广泛,其晶胞结构如图2所示(白球为Co,黑球为O)。已知该晶胞的晶胞参数为a pm,阿伏加德罗常数的值为NA。
)的一种氧化物在纳米储能领域应用广泛,其晶胞结构如图2所示(白球为Co,黑球为O)。已知该晶胞的晶胞参数为a pm,阿伏加德罗常数的值为NA。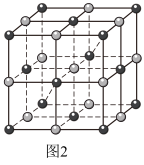
②与O原子最近且等距离的O原子有
③该晶体的密度为
您最近一年使用:0次
2023-10-27更新
|
236次组卷
|
4卷引用:河北省邢台市五岳联盟2023-2024学年高三上学期10月期中考试化学试题
解题方法
2 . 硼是一种用途广泛的工业原料,除了用于生产硼砂、硼酸和硼的各种化合物外,在制备储氢材料方面也有重要的用途,试回答下列问题:
(1)Ti(BH4)3是一种储氢材料,由TiCl4和LiBH4反应制得。基态Ti原子的核外电子排布式为___________ , 的价层电子对数是
的价层电子对数是___________ 。
(2)过渡金属Q与镧形成的合金是一种储氢材料,其中基态Q原子的价电子排布式为nd2n+2(n+1)sn-1,则Q元素的名称为___________ ;基态Q原子核外成对电子数和未成对电子数之比为___________ 。
(3)氨硼烷(NH3BH3)含氢量高,热稳定性好,是一种具有潜力的固体储氢材料,在四氢呋喃(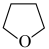 )作溶剂的条件下可合成氨硼烷:
)作溶剂的条件下可合成氨硼烷: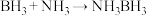 。
。
①测定晶体结构最常用的方法为___________ 。
②常温下,四氢呋喃在水中的溶解度大于环戊烷,其原因可能是___________ 。_
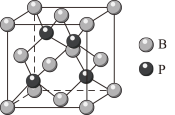
③硼与磷形成的一种晶体结构如图,晶体中离B原子最近的P原子有___________ 个;每个晶胞中的原子总数为___________ 。
(1)Ti(BH4)3是一种储氢材料,由TiCl4和LiBH4反应制得。基态Ti原子的核外电子排布式为
 的价层电子对数是
的价层电子对数是(2)过渡金属Q与镧形成的合金是一种储氢材料,其中基态Q原子的价电子排布式为nd2n+2(n+1)sn-1,则Q元素的名称为
(3)氨硼烷(NH3BH3)含氢量高,热稳定性好,是一种具有潜力的固体储氢材料,在四氢呋喃(
 )作溶剂的条件下可合成氨硼烷:
)作溶剂的条件下可合成氨硼烷: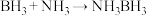 。
。①测定晶体结构最常用的方法为
②常温下,四氢呋喃在水中的溶解度大于环戊烷,其原因可能是
③硼与磷形成的一种晶体结构如图,晶体中离B原子最近的P原子有

您最近一年使用:0次
3 . 氟及其化合物用途非常广泛。回答下列问题:
(1)氢氟酸需贮存在聚四氟乙烯容器中。聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_______ 方法区分晶体、准晶体和非晶体。
(2)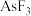 ,
, ,
, ,
,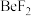 中价层电子对数不同于其他微粒的是
中价层电子对数不同于其他微粒的是_______ (填化学式,下同),立体结构为三角锥形的是_______ 。
(3)室温氟穿梭电池的电解质为氟氢离子液体,含 等离子,画出
等离子,画出 的结构式:
的结构式:_______ 。
(4) 在冶金、化工和建材等行业用途广泛。
在冶金、化工和建材等行业用途广泛。
①基于 设计的Born—Haber循环如图所示。
设计的Born—Haber循环如图所示。
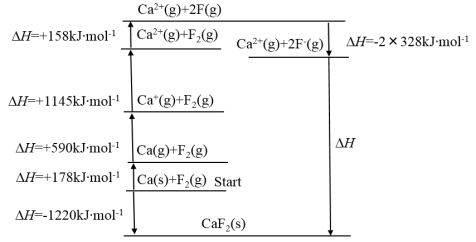
钙的第一电离能为_______  ;
; 键的键能为
键的键能为_______  。
。
② 的晶胞结构如图所示,其边长为
的晶胞结构如图所示,其边长为 。已知1号原子的坐标为
。已知1号原子的坐标为 ,3号原子的坐标为
,3号原子的坐标为 。则2号原子的坐标为
。则2号原子的坐标为_______ ; 与
与 间的最近距离为
间的最近距离为_______  。
。

(1)氢氟酸需贮存在聚四氟乙烯容器中。聚四氟乙烯是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过
(2)
 ,
, ,
, ,
, 中价层电子对数不同于其他微粒的是
中价层电子对数不同于其他微粒的是(3)室温氟穿梭电池的电解质为氟氢离子液体,含
 等离子,画出
等离子,画出 的结构式:
的结构式:(4)
 在冶金、化工和建材等行业用途广泛。
在冶金、化工和建材等行业用途广泛。①基于
 设计的Born—Haber循环如图所示。
设计的Born—Haber循环如图所示。
钙的第一电离能为
 ;
; 键的键能为
键的键能为 。
。②
 的晶胞结构如图所示,其边长为
的晶胞结构如图所示,其边长为 。已知1号原子的坐标为
。已知1号原子的坐标为 ,3号原子的坐标为
,3号原子的坐标为 。则2号原子的坐标为
。则2号原子的坐标为 与
与 间的最近距离为
间的最近距离为 。
。
您最近一年使用:0次
4 . 铬能形成多种配合物,许多铬的配合物都具有广泛用途。回答下列问题:
(1) 成为阳离子时首先失去的是
成为阳离子时首先失去的是_______ 轨道上的电子。
(2) 、
、 、C三种配合物的化学式和颜色如下:
、C三种配合物的化学式和颜色如下:
A.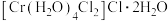 深绿色
深绿色
B. 绿色
绿色
C.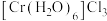 灰蓝色
灰蓝色
① 、
、 、
、 之间的关系是
之间的关系是_____ 。
②化合物 中与
中与 (Ⅲ)形成配位键的原子或离子是
(Ⅲ)形成配位键的原子或离子是_____ ,配位数为_____ 。
③相同物质的量的 、
、 、
、 分别与足量
分别与足量 溶液反应,生成
溶液反应,生成 的物质的量之比为
的物质的量之比为_____ 。
(3)Reineckesalt的结构如图所示。
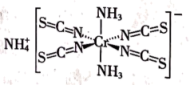
①阳离子的立体结构为_______ ; 的立体结构为
的立体结构为_____ 。
② 中碳原子的杂化方式为
中碳原子的杂化方式为_____ 。
(1)
 成为阳离子时首先失去的是
成为阳离子时首先失去的是(2)
 、
、 、C三种配合物的化学式和颜色如下:
、C三种配合物的化学式和颜色如下:A.
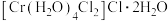 深绿色
深绿色B.
 绿色
绿色C.
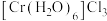 灰蓝色
灰蓝色①
 、
、 、
、 之间的关系是
之间的关系是②化合物
 中与
中与 (Ⅲ)形成配位键的原子或离子是
(Ⅲ)形成配位键的原子或离子是③相同物质的量的
 、
、 、
、 分别与足量
分别与足量 溶液反应,生成
溶液反应,生成 的物质的量之比为
的物质的量之比为(3)Reineckesalt的结构如图所示。

①阳离子的立体结构为
 的立体结构为
的立体结构为②
 中碳原子的杂化方式为
中碳原子的杂化方式为
您最近一年使用:0次
解题方法
5 . 氮及其化合物有许多用途。回答下列问题:
(1)基态 原子的电子排布式为
原子的电子排布式为________ ,锰的第三电离能比铁的第三电离能大,这是因为________________________________________________________ 。
(2) 的沸点(71℃)比
的沸点(71℃)比 的沸点(25.7℃)高,主要原因是
的沸点(25.7℃)高,主要原因是______________________ 。
(3)根据价层电子对互斥理论, 、
、 、
、 三种微粒中,中心原子价层电子对数不同于其他微粒的是
三种微粒中,中心原子价层电子对数不同于其他微粒的是_______ 。
(4) (氮化锰)的晶胞结构如图所示,晶胞参数为0.3851nm。该氮化锰的密度为
(氮化锰)的晶胞结构如图所示,晶胞参数为0.3851nm。该氮化锰的密度为 (列出计算式)。
(列出计算式)。________________________________________________________

(1)基态
 原子的电子排布式为
原子的电子排布式为(2)
 的沸点(71℃)比
的沸点(71℃)比 的沸点(25.7℃)高,主要原因是
的沸点(25.7℃)高,主要原因是(3)根据价层电子对互斥理论,
 、
、 、
、 三种微粒中,中心原子价层电子对数不同于其他微粒的是
三种微粒中,中心原子价层电子对数不同于其他微粒的是(4)
 (氮化锰)的晶胞结构如图所示,晶胞参数为0.3851nm。该氮化锰的密度为
(氮化锰)的晶胞结构如图所示,晶胞参数为0.3851nm。该氮化锰的密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
11-12高二上·四川雅安·阶段练习
6 . 铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为_______ ;
(2)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是_______ ;
(3) 的立体构型是
的立体构型是_______ ,其中S原子的杂化轨道类型是_______ ;
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为_______ ;一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______ ;该晶体中,原子之间的作用力是_______ ;
(5)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为___ 。
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为
(2)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是
(3)
 的立体构型是
的立体构型是(4)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为
(5)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为
您最近一年使用:0次
2016-12-09更新
|
757次组卷
|
3卷引用:河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:3.3 金属晶体
河北省邢台市第二中学2017-2018学年高二化学选修三课时训练:3.3 金属晶体(已下线)2011-2012学年四川省雅安中学高二12月月考化学试卷2011年普通高等学校招生全国统一考试化学(海南卷)



