解题方法
1 . 某种矿物饲料添加剂的结构简式如图,已知W、X、Y、Z原子序数依次增大,均为短周期元素,X、Y、Z为同周期相邻元素,Q为30号元素,下列叙述不正确的是
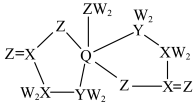
| A.同周期主族元素中第一电离能比Z大的只有一种 |
B.Q元素位于周期表的 区 区 |
C.X原子的杂化类型为 、 、 |
| D.该结构中存在共价键和配位键 |
您最近一年使用:0次
名校
解题方法
2 . 某科研团队,在前期新型电荷转移金属配合物研究中取得了一系列重要进展,引入金属Ni离子取代四硫富瓦烯四苯羧酸(M)配体中的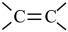 单元(如图所示),合成了具有不饱和配位点和新的氧化还原活性金属中心的N,从而赋予材料更加丰富的物理、化学功能。下列有关说法正确的是
单元(如图所示),合成了具有不饱和配位点和新的氧化还原活性金属中心的N,从而赋予材料更加丰富的物理、化学功能。下列有关说法正确的是
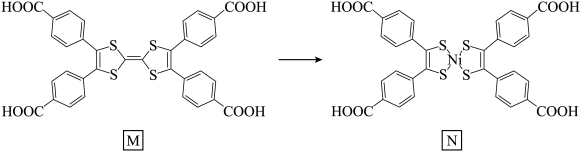
| A.M、N中所有原子一定共面 |
| B.N中Ni的配体和配位数均为4 |
| C.M与N中C原子的杂化方式完全相同 |
D.由于形成了共轭大 键,故M属于导电高分子 键,故M属于导电高分子 |
您最近一年使用:0次
2024-05-31更新
|
340次组卷
|
3卷引用:2024届辽宁省沈阳市第二中学高三下学期三模化学试题
解题方法
3 . 某化合物的结构如图所示,M、W、X、Y、Z是原子序数依次增大的短周期主族元素,其原子序数之和为31,Y原子的最外层电子数等于X原子核外电子总数,下列说法正确的是
A.电负性: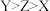 | B.简单离子半径: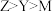 |
| C.X原子与Y原子之间存在配位键 | D.Y元素第一电离能比同周期相邻元素都低 |
您最近一年使用:0次
名校
解题方法
4 . 利用炼锌钴渣[主要含 、
、 、
、 和
和 、
、 单质]制备
单质]制备 和高纯
和高纯 的流程如下。
的流程如下。 时,
时,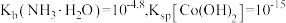
②锌的化合物与铝的化合物部分性质有相似性
请回答下列问题:
(1)写出“酸浸”过程中 发生反应的离子方程式
发生反应的离子方程式___________ 。
(2)“沉铁”过程中 实际用量远大于理论用量的主要原因
实际用量远大于理论用量的主要原因___________ ;该过程加入 的作用为
的作用为___________ 。
(3)“沉镍”过程 对溶液中
对溶液中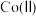 、
、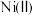 含量的影响如图。
含量的影响如图。
___________ 。
②该过程 可能发生的反应如下:
可能发生的反应如下:
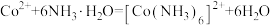
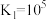


则
___________ 。
(4)“沉钴”过程生成 的离子方程式为
的离子方程式为___________ 。
(5)在电解过程中为了保持电解液成分稳定,应不断加入___________ (填化学式)。
(6)将含有未成对电子的物质置于外磁场中,会使磁场的强度增大,称其为顺磁性物质。下列物质中,属于顺磁性物质的是___________(填标号)。
 、
、 、
、 和
和 、
、 单质]制备
单质]制备 和高纯
和高纯 的流程如下。
的流程如下。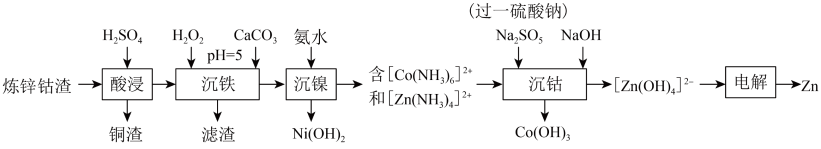
 时,
时,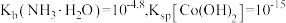
②锌的化合物与铝的化合物部分性质有相似性
请回答下列问题:
(1)写出“酸浸”过程中
 发生反应的离子方程式
发生反应的离子方程式(2)“沉铁”过程中
 实际用量远大于理论用量的主要原因
实际用量远大于理论用量的主要原因 的作用为
的作用为(3)“沉镍”过程
 对溶液中
对溶液中 、
、 含量的影响如图。
含量的影响如图。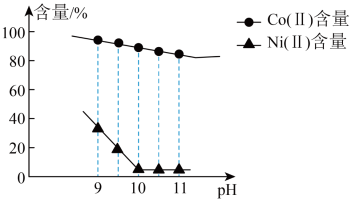

②该过程
 可能发生的反应如下:
可能发生的反应如下: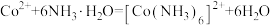
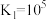


则

(4)“沉钴”过程生成
 的离子方程式为
的离子方程式为(5)在电解过程中为了保持电解液成分稳定,应不断加入
(6)将含有未成对电子的物质置于外磁场中,会使磁场的强度增大,称其为顺磁性物质。下列物质中,属于顺磁性物质的是___________(填标号)。
A. | B. | C. | D.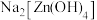 |
您最近一年使用:0次
解题方法
5 . 半导体在集成电路、消费电子、通信系统、光伏发电、照明、大功率电源转换等领域都有应用。
(1)硅是常见的半导体材料。金刚石和硅相比较,熔点更高的是_______ ,原因是_______ 。硅有晶体硅和无定形硅,可以用_______ (填方法名称)来区分晶体硅和无定形硅。
(2)2022年,科研人员发现立方砷化硼是科学界已知的最好的半导体之一,其结构如图所示。基态 原子的简化电子排布式为
原子的简化电子排布式为_______ ,立方砷化硼中,_______ (填“含有”或“不含有”)配位键。
(4)砷化镓被誉为“半导体贵族”,是雷达、电子计算机、人造卫星、宇宙飞船等高新产品中不可或缺的材料。已知 立方晶胞结构如图所示,其晶胞参数为
立方晶胞结构如图所示,其晶胞参数为 。1号原子和2号原子之间的距离为
。1号原子和2号原子之间的距离为_______  ;晶胞密度为
;晶胞密度为_______  (阿伏加德罗常数的值用
(阿伏加德罗常数的值用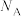 表示)。
表示)。
(1)硅是常见的半导体材料。金刚石和硅相比较,熔点更高的是
(2)2022年,科研人员发现立方砷化硼是科学界已知的最好的半导体之一,其结构如图所示。基态
 原子的简化电子排布式为
原子的简化电子排布式为
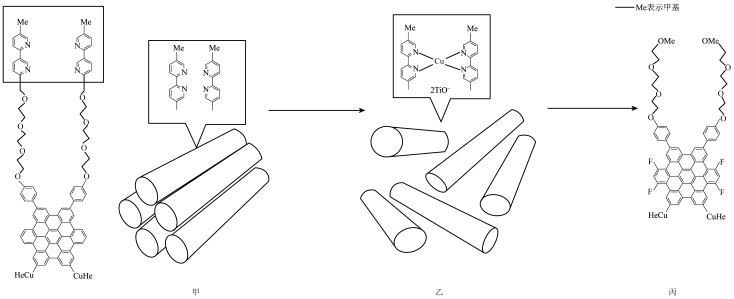
| A.分子识别和自组装是超分子的重要特征 |
B.甲分子中的氮原子的杂化方式均为 |
C.乙分子图示结构部分中,1个 形成了2个配位键 形成了2个配位键 |
| D.丙分子中存在氢键 |
(4)砷化镓被誉为“半导体贵族”,是雷达、电子计算机、人造卫星、宇宙飞船等高新产品中不可或缺的材料。已知
 立方晶胞结构如图所示,其晶胞参数为
立方晶胞结构如图所示,其晶胞参数为 。1号原子和2号原子之间的距离为
。1号原子和2号原子之间的距离为 ;晶胞密度为
;晶胞密度为 (阿伏加德罗常数的值用
(阿伏加德罗常数的值用 表示)。
表示)。
您最近一年使用:0次
名校
6 . 某种电解质的组成如图所示,已知该化合物的五元环上的5个原子共平面,且X、Y、Z、Q、W为原子序数依次增大的短周期元素,下列说法正确的是

| A.Z分别与F、Cl形成最简单的分子中,与F形成的分子键角更大 |
B. 中含有配位键 中含有配位键 |
C.冰的分子间氢键 |
D.在该物质中Z有 , , 的两种杂化方式 的两种杂化方式 |
您最近一年使用:0次
7 .  具有易液化、含氢密度高、应用广泛等优点,
具有易液化、含氢密度高、应用广泛等优点, 的合成及应用是科学研究的重要课题。
的合成及应用是科学研究的重要课题。
(1)以 、
、 合成
合成 ,Fe是常用的催化剂。
,Fe是常用的催化剂。
① 分子空间构型为
分子空间构型为________ ,写出 极易溶于水的原因
极易溶于水的原因________ 。
②实际生产中采用铁的氧化物 、FeO,使用前用
、FeO,使用前用 和
和 的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:
的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:

ⅰ.两种晶胞所含铁原子个数比为________ 。
ⅱ.图1晶胞的棱长为apm( ),则其密度
),则其密度
________  (写出化简的表达式)。
(写出化简的表达式)。
③我国科学家开发出Fe-LiH双中心催化剂,在合成 中显示出高催化活性。第一电离能
中显示出高催化活性。第一电离能 :
: ,从原子结构角度解释原因
,从原子结构角度解释原因________ 。
(2) 、
、 (氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
① 的中心原子的杂化轨道类型为
的中心原子的杂化轨道类型为________ 。
② 存在配位键,提供空轨道的是
存在配位键,提供空轨道的是________ 。其他含氮配合物,如 的配离子是
的配离子是________ 、配合物 的配体是
的配体是________ ,配位数为________ 。
(3)常温下 是橙黄色液体,其分子结构如图所示。
是橙黄色液体,其分子结构如图所示。
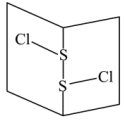
少量泄漏会产生窒息性气味,遇水易水解,并产生酸性悬浊液。
 分子中含有
分子中含有________ 键(填“极性”、“非极性”,下同),是________ 分子。
(4)已知N、P、As为同一主族元素,则写出三种元素最简单氢化物沸点由高到低的顺序为(用化学式表示)________ 。
 具有易液化、含氢密度高、应用广泛等优点,
具有易液化、含氢密度高、应用广泛等优点, 的合成及应用是科学研究的重要课题。
的合成及应用是科学研究的重要课题。(1)以
 、
、 合成
合成 ,Fe是常用的催化剂。
,Fe是常用的催化剂。①
 分子空间构型为
分子空间构型为 极易溶于水的原因
极易溶于水的原因②实际生产中采用铁的氧化物
 、FeO,使用前用
、FeO,使用前用 和
和 的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:
的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:
ⅰ.两种晶胞所含铁原子个数比为
ⅱ.图1晶胞的棱长为apm(
 ),则其密度
),则其密度
 (写出化简的表达式)。
(写出化简的表达式)。③我国科学家开发出Fe-LiH双中心催化剂,在合成
 中显示出高催化活性。第一电离能
中显示出高催化活性。第一电离能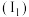 :
: ,从原子结构角度解释原因
,从原子结构角度解释原因(2)
 、
、 (氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。①
 的中心原子的杂化轨道类型为
的中心原子的杂化轨道类型为②
 存在配位键,提供空轨道的是
存在配位键,提供空轨道的是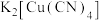 的配离子是
的配离子是 的配体是
的配体是(3)常温下
 是橙黄色液体,其分子结构如图所示。
是橙黄色液体,其分子结构如图所示。
少量泄漏会产生窒息性气味,遇水易水解,并产生酸性悬浊液。
 分子中含有
分子中含有(4)已知N、P、As为同一主族元素,则写出三种元素最简单氢化物沸点由高到低的顺序为(用化学式表示)
您最近一年使用:0次
名校
8 . 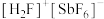 (氟锑酸)是一种超强酸(Sb为第5周期ⅤA族元素),是HF与
(氟锑酸)是一种超强酸(Sb为第5周期ⅤA族元素),是HF与 反应的产物。下列说法错误的是
反应的产物。下列说法错误的是
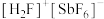 (氟锑酸)是一种超强酸(Sb为第5周期ⅤA族元素),是HF与
(氟锑酸)是一种超强酸(Sb为第5周期ⅤA族元素),是HF与 反应的产物。下列说法错误的是
反应的产物。下列说法错误的是A.F的价电子排布式为 | B. 中的键角为180° 中的键角为180° |
C. 中含有配位键 中含有配位键 | D. 的空间结构为正八面体形 的空间结构为正八面体形 |
您最近一年使用:0次
名校
解题方法
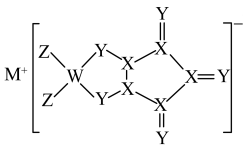
9 . M、W、X、Y为原子序数依次增大的短周期主族元素,最外层电子数之和为16。W与Y的质子数之和是X的2倍。Z元素的基态原子未成对电子数为2,且价层电子的空间运动状态有6种。由5种元素形成的一种配位化合物结构如图所示。
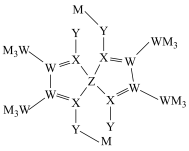
| A.同周期中第一电离能小于X的元素有4种 |
| B.简单氢化物的还原性:X<Y |
| C.1mol该物质中含配位键的数目为4NA |
| D.元素Z的化合价为0价 |
您最近一年使用:0次
2024-03-21更新
|
881次组卷
|
3卷引用:辽宁省实验中学2023-2024学年高二下学期第一次月考化学试题
辽宁省实验中学2023-2024学年高二下学期第一次月考化学试题山东省济宁市2024届高三下学期一模考试化学试题(已下线)压轴题05?“位-构-性”元素推断(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
名校
10 . 氮及其化合物在生产、环保研究等方面用途非常广泛,回答下列问题:
(1)用浓氨水除去Fe(OH)3样品中少量的Cu(OH)2,生成[Cu(NH3)4]2+,1mol[Cu(NH3)4]2+含______ molσ键。
(2)硝酸厂尾气可以回收制备硝酸。已知:
①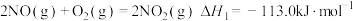
②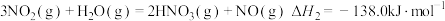
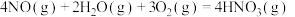 ,
,
______  。
。
(3)在隔绝空气的密闭容器中发生反应:FeSO4(aq)+NO(g) Fe(NO)SO4(aq)(棕黄色),下列叙述正确的是______。(填标号)
Fe(NO)SO4(aq)(棕黄色),下列叙述正确的是______。(填标号)
(4)向一恒容密闭容器中充入适量NH3和O2,在一定条件下发生反应,氧化产物是N2、NO、NO2、N2O中的一种,达到平衡时改变温度,反应物和生成物的浓度与温度关系如图所示:______ (填化学式),写出该反应的化学方程式:______ 。
②正反应
______ (填“>”“<”或“=”)0,判断依据是______
③T3℃时NH3的平衡转化率为______ 。
(1)用浓氨水除去Fe(OH)3样品中少量的Cu(OH)2,生成[Cu(NH3)4]2+,1mol[Cu(NH3)4]2+含
(2)硝酸厂尾气可以回收制备硝酸。已知:
①
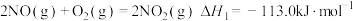
②
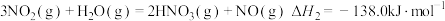
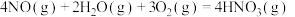 ,
,
 。
。(3)在隔绝空气的密闭容器中发生反应:FeSO4(aq)+NO(g)
 Fe(NO)SO4(aq)(棕黄色),下列叙述正确的是______。(填标号)
Fe(NO)SO4(aq)(棕黄色),下列叙述正确的是______。(填标号)| A.溶液颜色不变,反应达到平衡状态 | B.其他条件不变,充入少量O2,平衡不移动 |
| C.其他条件不变,加少量FeSO4,溶液颜色加深 | D.其他条件不变,微热,溶液颜色加深 |
(4)向一恒容密闭容器中充入适量NH3和O2,在一定条件下发生反应,氧化产物是N2、NO、NO2、N2O中的一种,达到平衡时改变温度,反应物和生成物的浓度与温度关系如图所示:

②正反应

③T3℃时NH3的平衡转化率为
您最近一年使用:0次
2024-03-19更新
|
385次组卷
|
3卷引用:辽宁省辽阳市2024届高三第一次模拟考试化学试卷



