解题方法
1 . 氧族元素包括氧、硫、硒等,这些元素的单质及其化合物在工农业生产和科学研究中具有广泛的用途。回答下列问题:
(1)下列属于氧原子激发态的轨道表示式的有___________ (填字母,下同),其中失去最外层上一个电子所需能量最低的是___________ 。
a. b.
b.
c.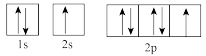 d.
d.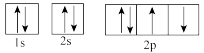
(2)科学研究表明,过硫化氢(也叫二硫化氢)加入烯烃中可制备硫醇,其熔沸点及制备方法如下表所示:
① 的结构为
的结构为 ,其中2个S原子的
,其中2个S原子的___________ 杂化轨道形成S—S___________ (填“ ”或“
”或“ ”)共价键。
”)共价键。
② 分子结构中H—O—O键角为
分子结构中H—O—O键角为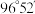 ,则
,则 分子结构中H—S—S键角
分子结构中H—S—S键角___________ (填“=”“>”或“<”)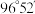 。
。
③ 的熔沸点比
的熔沸点比 的熔沸点低的原因是
的熔沸点低的原因是___________ 。
(3)在能源逐渐匮乏的形势下,超导材料显得尤为重要。Li、Fe、Se三种元素组成的某新型超导材料的晶胞结构如图所示:
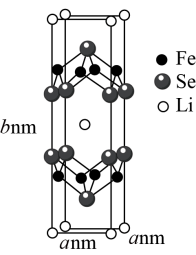
1个晶胞中的Se原子数为___________ 。晶胞的部分参数如图所示,且晶胞棱边夹角均为90°,晶体密度为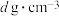 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为___________ (列式表示)。
(1)下列属于氧原子激发态的轨道表示式的有
a.
 b.
b.
c.
 d.
d.
(2)科学研究表明,过硫化氢(也叫二硫化氢)加入烯烃中可制备硫醇,其熔沸点及制备方法如下表所示:
| 物质 | 熔点/℃ | 沸点/℃ |  制备方法 制备方法 |
 | -90.0 | 71.0 | 加热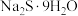 至熔融,再把硫溶入其中,得多硫化钠溶液。在263K下,将该溶液注入稀硫酸中,得多硫化氢混合物,分离、干燥、真空蒸馏,即得 至熔融,再把硫溶入其中,得多硫化钠溶液。在263K下,将该溶液注入稀硫酸中,得多硫化氢混合物,分离、干燥、真空蒸馏,即得 |
 | -0.4 | 150.0 |
 的结构为
的结构为 ,其中2个S原子的
,其中2个S原子的 ”或“
”或“ ”)共价键。
”)共价键。②
 分子结构中H—O—O键角为
分子结构中H—O—O键角为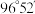 ,则
,则 分子结构中H—S—S键角
分子结构中H—S—S键角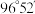 。
。③
 的熔沸点比
的熔沸点比 的熔沸点低的原因是
的熔沸点低的原因是(3)在能源逐渐匮乏的形势下,超导材料显得尤为重要。Li、Fe、Se三种元素组成的某新型超导材料的晶胞结构如图所示:

1个晶胞中的Se原子数为
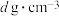 ,则阿伏加德罗常数的值为
,则阿伏加德罗常数的值为
您最近一年使用:0次
解题方法
2 . 砷(As)与磷同主族,砷的化合物在药物,半导体,科研中具有较为广泛的用途。回答下列问题:
(1)基态磷原子的核外电子排布式是____ ,基态砷原子的价电子中有____ 个未成对电子。
(2)As,Se为同周期相邻元素,则第一电离能:As_______ Se(填“>”“<”或“=”)。
(3)在 存在下,将适量的乙炔气体通入
存在下,将适量的乙炔气体通入 溶液中可得到
溶液中可得到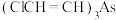 。
。
① 的熔沸点低,易升华,原因是
的熔沸点低,易升华,原因是_______ 。
② 在蒸气状态下存在双聚氯化铝[
在蒸气状态下存在双聚氯化铝[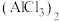 ],结构如图所示,双聚氧化铝中存在配位键,该配位键形成时,提供孤对电子的原子是
],结构如图所示,双聚氧化铝中存在配位键,该配位键形成时,提供孤对电子的原子是_______ (用元素符号表示)。

③800℃时,双聚氯化铝完全分解为 ,单分子
,单分子 的空间构型是
的空间构型是_______ ,而 的空间构型是
的空间构型是_______ 。
(4)砷化镓是一种新型的半导体材料,其晶胞结构如图1所示,图2为晶胞沿z轴的平面投影图,图中a点的原子坐标为 ,则b点的原子坐标为
,则b点的原子坐标为_______ 。

(1)基态磷原子的核外电子排布式是
(2)As,Se为同周期相邻元素,则第一电离能:As
(3)在
 存在下,将适量的乙炔气体通入
存在下,将适量的乙炔气体通入 溶液中可得到
溶液中可得到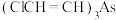 。
。①
 的熔沸点低,易升华,原因是
的熔沸点低,易升华,原因是②
 在蒸气状态下存在双聚氯化铝[
在蒸气状态下存在双聚氯化铝[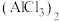 ],结构如图所示,双聚氧化铝中存在配位键,该配位键形成时,提供孤对电子的原子是
],结构如图所示,双聚氧化铝中存在配位键,该配位键形成时,提供孤对电子的原子是
③800℃时,双聚氯化铝完全分解为
 ,单分子
,单分子 的空间构型是
的空间构型是 的空间构型是
的空间构型是(4)砷化镓是一种新型的半导体材料,其晶胞结构如图1所示,图2为晶胞沿z轴的平面投影图,图中a点的原子坐标为
 ,则b点的原子坐标为
,则b点的原子坐标为
您最近一年使用:0次
3 . 碳酸二甲酯是一种环保性能优异,用途广泛的化工原料,其合成方法有多种。
I.在催化剂作用下由CO2制备碳酸二甲酯的过程如图:

(1)基态氮原子的轨道表示式为____ 。
a.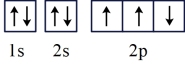 b.
b. c.
c.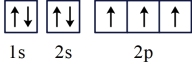
(2)尿素中N的第一电离能比O的高,原因是:
①O失去的是已经配对的电子,配对电子相互排斥,因而电离能较低;
②____ 。
(3)下列关于氨气的叙述不正确 的是___ (填字母)。
a.NH3的键角小于CH4的键角,是因为NH3的中心原子上孤电子对有较大斥力
b.NH3极易溶解在水中,只因氨分子与水分子间形成了氢键
c.NH3的沸点比PH3的高,是因为N—H的键能比P—H的大
II.在CeO2—ZrO2固溶体的催化体系中也能将CO2转化为碳酸二甲酯。
(4)氧化锆(化学式为ZrO2)晶胞结构如图所示,在晶胞中Zr4+的数量是____ ,若该晶胞的密度为ρg•cm-3,用NA表示阿伏加德罗常数的值,则该晶胞的体积是___ cm3(列出计算式)。(氧化锆的摩尔质量M=123g•mol-1)

(5)Ce、Zr、Mn和Fe都是过渡金属元素,Mn与Fe两元素的部分电离能如表所示。
①铁元素位于元素周期表____ 族,属于____ 区。
②比较两元素的I2、I3可知,气态Mn2+再失去1个电子比气态Fe2+再失去1个电子更难,请从原子结构分析原因____ 。
I.在催化剂作用下由CO2制备碳酸二甲酯的过程如图:

(1)基态氮原子的轨道表示式为
a.
 b.
b. c.
c.
(2)尿素中N的第一电离能比O的高,原因是:
①O失去的是已经配对的电子,配对电子相互排斥,因而电离能较低;
②
(3)下列关于氨气的叙述
a.NH3的键角小于CH4的键角,是因为NH3的中心原子上孤电子对有较大斥力
b.NH3极易溶解在水中,只因氨分子与水分子间形成了氢键
c.NH3的沸点比PH3的高,是因为N—H的键能比P—H的大
II.在CeO2—ZrO2固溶体的催化体系中也能将CO2转化为碳酸二甲酯。
(4)氧化锆(化学式为ZrO2)晶胞结构如图所示,在晶胞中Zr4+的数量是

(5)Ce、Zr、Mn和Fe都是过渡金属元素,Mn与Fe两元素的部分电离能如表所示。
| 元素 | 电离能(kJ·mol-1) | ||
| I1 | I2 | I3 | |
| Mn | 717 | 1509 | 3248 |
| Fe | 759 | 1561 | 2957 |
②比较两元素的I2、I3可知,气态Mn2+再失去1个电子比气态Fe2+再失去1个电子更难,请从原子结构分析原因
您最近一年使用:0次
解题方法
4 . 碳族元素中的碳、硅、锗及其化合物在诸多领域有重要用途。
(1)碳族元素位于周期表_______ 区,基态锗原子外围电子的轨道表示式为_______ ,基态锗原子核外有_______ 种空间运动状态不同的电子。
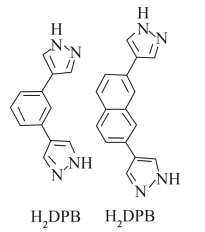
(2)科学家以 、
、 等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。
等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。 和
和 结构中含氮碳环均为平面结构,则N的杂化方式是
结构中含氮碳环均为平面结构,则N的杂化方式是_______ 。
(3)金刚石(甲)、石墨(乙)、C60(丙)的结构如下图所示:
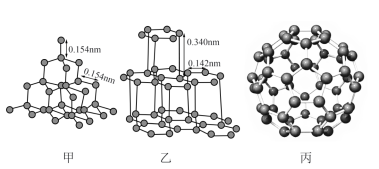
①12g金刚石和石墨中含有的σ键数目之比为_______ 。
②金刚石的熔点高于C60,但低于石墨,原因是_______ 。
③C60的晶胞呈分子密堆积,下列晶体中,与C60具有相同晶体结构的是_______ 。
A.CO2 B.冰 C.Zn D.Ag E.NaCl
(4)一种低温超导体立方晶胞结构如下图所示:
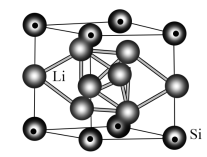
①该晶体的化学式为_______ 。
②若晶胞参数为apm,该晶体的密度ρ=_______  。(列出计算式即可,设NA表示阿伏加德罗常数的值)
。(列出计算式即可,设NA表示阿伏加德罗常数的值)
(1)碳族元素位于周期表
(2)科学家以
 、
、 等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。
等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。 和
和 结构中含氮碳环均为平面结构,则N的杂化方式是
结构中含氮碳环均为平面结构,则N的杂化方式是
(3)金刚石(甲)、石墨(乙)、C60(丙)的结构如下图所示:

①12g金刚石和石墨中含有的σ键数目之比为
②金刚石的熔点高于C60,但低于石墨,原因是
③C60的晶胞呈分子密堆积,下列晶体中,与C60具有相同晶体结构的是
A.CO2 B.冰 C.Zn D.Ag E.NaCl
(4)一种低温超导体立方晶胞结构如下图所示:

①该晶体的化学式为
②若晶胞参数为apm,该晶体的密度ρ=
 。(列出计算式即可,设NA表示阿伏加德罗常数的值)
。(列出计算式即可,设NA表示阿伏加德罗常数的值)
您最近一年使用:0次
5 . 氮是一种典型的非金属元素,其单质及化合物在生活和生产中具有广泛的用途。回答下列问题:
(1)磷元素与氮元素同主族,基态磷原子有____ 个未成对电子,白磷的分子式为P4,目前科学家合成了N4分子,其分子结构与P4相似,N4分子中氮原子的杂化轨道类型是____ ,N—N—N键角为_____ 。
(2)甲胺是一种有机物,其化学式为CH3NH2:
①它的电子式为____ ,其中所含元素的电负性由大到小的顺序是____ 。
②已知CH3NH2比NH3接收质子的能力强,可能的原因是_____ 。
③已知甲胺与乙烷的相对分子质量接近,但其熔沸点比乙烷高得多,其原因为____ 。
④在配位化学中,甲胺是一种常见的配体,写出它与Cd2+形成的配位数为4的配离子的化学式____ 。
(3)已知氨在一定条件下可形成一种立方晶系,其立方晶胞沿x、y或z轴投影图均如图所示。已知晶胞的棱长为apm,则该晶体的密度为____ g/cm3(写出数学表达式,设NA为阿伏加德罗常数的值)。

(1)磷元素与氮元素同主族,基态磷原子有
(2)甲胺是一种有机物,其化学式为CH3NH2:
①它的电子式为
②已知CH3NH2比NH3接收质子的能力强,可能的原因是
③已知甲胺与乙烷的相对分子质量接近,但其熔沸点比乙烷高得多,其原因为
④在配位化学中,甲胺是一种常见的配体,写出它与Cd2+形成的配位数为4的配离子的化学式
(3)已知氨在一定条件下可形成一种立方晶系,其立方晶胞沿x、y或z轴投影图均如图所示。已知晶胞的棱长为apm,则该晶体的密度为

您最近一年使用:0次



