名校
1 . 下列有关物质性质与应用的对应关系正确的是
| 选项 | 性质 | 实际应用 |
| A | 小苏打不稳定,受热分解生成CO2 | 用于泡沫灭火器 |
| B | 聚乙炔是无限延伸的线状结构 | 用于导电材料 |
| C | Al(OH)3受热分解,生成高熔点物质和水 | 用作塑料的阻燃剂 |
| D | 石墨是混合型晶体,含大π键 | 用作润滑剂 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-03-22更新
|
1373次组卷
|
7卷引用:河北省五个一联盟2022-2023学年高三上学期12月联考化学试题
河北省五个一联盟2022-2023学年高三上学期12月联考化学试题山东省济南市2022届高三3月高考模拟考试(一模)化学试题(已下线)秘籍02 化学与STSE-备战2022年高考化学抢分秘籍(全国通用)湖北省随州市曾都区第一中学2022届高三下学期第二次学业水平选择性模拟考试化学试题(已下线)专项06 元素及其化合物-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)(已下线)专题05 元素及其化合物-三年(2020-2022)高考真题分项汇编(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(选择题1-5)
名校
解题方法
2 . 硼是第ⅢA族唯一的非金属元素,是农作物生长必需的微量营养元素。硼的单质及化合物都有重要用途。回答下列问题:
(1)下列硼原子电子排布图表示的状态中,能量最低和最高的分别是___________ 、___________ (填标号)。
A. B.
B. 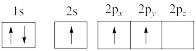
C. D.
D.
(2)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图所示),若其中有两个原子为 ,其余为
,其余为 ,则该结构单元有
,则该结构单元有___________ 种不同的结构类型。

(3)氨硼烷(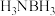 )含氢量高热稳定性好,是一种具有潜力的固体储氢材料。
)含氢量高热稳定性好,是一种具有潜力的固体储氢材料。
①在第二周期中,第一电离能介于B和N之间的有___________ 种元素。
②原子个数和价电子数目均相等的微粒互称为等电子体。则与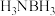 电子数也相等的等电子体分子是
电子数也相等的等电子体分子是___________ (写分子式)。
(4)硼酸是一元弱酸,但 本身不能电离,只能通过结合来自水中的
本身不能电离,只能通过结合来自水中的 而释放出
而释放出 ,则在水溶液中
,则在水溶液中 的电离方程式为
的电离方程式为___________ 。
(5)硼与第ⅤA族元素组成的化合物氮化硼(BN)、磷化硼(BP)、砷化硼(BAs)的晶体结构与单晶硅相似,其中氮化硼(BN)和磷化硼(BP)是受到高度关注的耐磨涂料,砷化硼(BAs)是一种超高热导率半导体材料。
①氮化硼晶体的熔点要比磷化硼晶体高,其原因是___________ 。
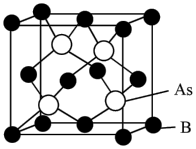
②砷化硼(BAs)的晶胞结构如下图所示,已知阿伏加德罗常数的值为 ,若晶胞中B原子到As原子最近距离为a pm,则该晶体的密度ρ=
,若晶胞中B原子到As原子最近距离为a pm,则该晶体的密度ρ=___________  (列出含a、
(列出含a、 的计算式即可)。
的计算式即可)。
(6)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为___________ ;该晶体的化学式为___________ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点,B点原子的分数坐标分别为(0,0,0)、(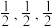 ),则C点原子的分数坐标为
),则C点原子的分数坐标为___________ 晶胞中C、D间距离
___________  。
。

(1)下列硼原子电子排布图表示的状态中,能量最低和最高的分别是
A.
 B.
B. 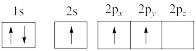
C.
 D.
D.
(2)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图所示),若其中有两个原子为
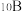 ,其余为
,其余为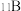 ,则该结构单元有
,则该结构单元有
(3)氨硼烷(
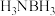 )含氢量高热稳定性好,是一种具有潜力的固体储氢材料。
)含氢量高热稳定性好,是一种具有潜力的固体储氢材料。①在第二周期中,第一电离能介于B和N之间的有
②原子个数和价电子数目均相等的微粒互称为等电子体。则与
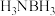 电子数也相等的等电子体分子是
电子数也相等的等电子体分子是(4)硼酸是一元弱酸,但
 本身不能电离,只能通过结合来自水中的
本身不能电离,只能通过结合来自水中的 而释放出
而释放出 ,则在水溶液中
,则在水溶液中 的电离方程式为
的电离方程式为(5)硼与第ⅤA族元素组成的化合物氮化硼(BN)、磷化硼(BP)、砷化硼(BAs)的晶体结构与单晶硅相似,其中氮化硼(BN)和磷化硼(BP)是受到高度关注的耐磨涂料,砷化硼(BAs)是一种超高热导率半导体材料。
①氮化硼晶体的熔点要比磷化硼晶体高,其原因是
②砷化硼(BAs)的晶胞结构如下图所示,已知阿伏加德罗常数的值为
 ,若晶胞中B原子到As原子最近距离为a pm,则该晶体的密度ρ=
,若晶胞中B原子到As原子最近距离为a pm,则该晶体的密度ρ= (列出含a、
(列出含a、 的计算式即可)。
的计算式即可)。
(6)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为
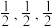 ),则C点原子的分数坐标为
),则C点原子的分数坐标为
 。
。
您最近一年使用:0次
解题方法
3 . 氮、磷、氯、溴、铁、铜等元素及其化合物在现代农业、科技和国防建设中有着许多独特的用途。LiFePO4是新型锂离子电池的电极材料,可利用FeCl3、NH4H2PO4、LiC1和苯胺(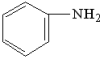 )等原料来制备。回答下列问题。
)等原料来制备。回答下列问题。
(1)铁元素在元素周期表中的位置为_______ ,基态Fe2+的价层电子排布图(轨道表达式)为_______ 。
(2)NH4H2PO4中,除氢元素外,其余三种元素第一电离能最大的是_______ (填元素符号)。
(3)苯胺和甲苯相对分子质量接近,但苯胺熔点明显比甲苯的高,原因是_______ 。
(4)红磷在氯气中燃烧可以得到PCl3和PCl5,其中气态PCl3分子的立体构型为_______ 。研究发现固态PCl5和PBr5的结构分别为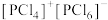 和
和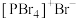 ,则它们的晶体类型为
,则它们的晶体类型为_______ 。
(5)已知NH3分子中H-N-H的键角为107.3°,则配合物[Cu(NH3)4]SO4中H-N-H的键角_______ 107.3°(填“大于”“小于”“等于”)。
(6)铁酸钇是一种典型的单相多铁性材料,其正交相晶胞结构以及各原子的投影位置如图所示。

已知1号O原子空间坐标为(0,0, ),2号O原子空间坐标为(
),2号O原子空间坐标为( ,
, −m,
−m, −n),则3号Fe原子的空间坐标为
−n),则3号Fe原子的空间坐标为_______ ,若晶胞参数分别为apm、bpm和cpm,阿伏加德罗常数的值用NA表示,则该晶体的密度为_______ g·cm−3(列出表达式)。
 )等原料来制备。回答下列问题。
)等原料来制备。回答下列问题。(1)铁元素在元素周期表中的位置为
(2)NH4H2PO4中,除氢元素外,其余三种元素第一电离能最大的是
(3)苯胺和甲苯相对分子质量接近,但苯胺熔点明显比甲苯的高,原因是
(4)红磷在氯气中燃烧可以得到PCl3和PCl5,其中气态PCl3分子的立体构型为
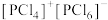 和
和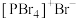 ,则它们的晶体类型为
,则它们的晶体类型为(5)已知NH3分子中H-N-H的键角为107.3°,则配合物[Cu(NH3)4]SO4中H-N-H的键角
(6)铁酸钇是一种典型的单相多铁性材料,其正交相晶胞结构以及各原子的投影位置如图所示。

已知1号O原子空间坐标为(0,0,
 ),2号O原子空间坐标为(
),2号O原子空间坐标为( ,
, −m,
−m, −n),则3号Fe原子的空间坐标为
−n),则3号Fe原子的空间坐标为
您最近一年使用:0次
2022-09-26更新
|
502次组卷
|
3卷引用:河北省廊坊市第十五中学2021-2022学年高三下学期第一次模拟测试化学试题
河北省廊坊市第十五中学2021-2022学年高三下学期第一次模拟测试化学试题河北省高碑店市崇德实验中学2022-2023学年高三上学期期中考试化学试题(已下线)2022年河北省高考真题变式题(14-18)
4 . C、N、O、Ca、Ba、Cu、Hg等元素及其化合物在工农业生产和生活中有重要用途。请回答下列问题:
(1)基态Cu原子价层电子的轨道表示式为_______ 。
(2)基态气态原子获得一个电子变为气态一价负离子放出的能量称为第一电子亲和能。C、N、O三种元素的第一电子亲和能分别为-121 kJ·mol-1、7 kJ·mol-1、-141kJ·mol-1。请解释N元素第一电子亲和能异常的原因:_______ 。
(3)氨水的主要成分为NH3·H2O,农业上经稀释后可作化肥。
①氨水的施用原则是“一不离土,二不离水”。不离土就是要深施覆土,不离水就是加水稀释,这样做的目的是_______ 。
②NH3和H2O相比,键角较大的是_______ (填化学式),原因是_______ 。
(4)O、Ca、Ba 、Cu、Hg可以形成超导材料HBCO,晶胞结构如图所示。

①晶胞中Ba与Ca均位于体内,晶胞中与Ca距离最近的O原子 有_______ 个 ,Ca原子与Cu原子之间的最短距离为_______ pm。
②设阿伏加德罗常数的值为NA,则晶胞的密度为_______ g·cm-3。
(1)基态Cu原子价层电子的轨道表示式为
(2)基态气态原子获得一个电子变为气态一价负离子放出的能量称为第一电子亲和能。C、N、O三种元素的第一电子亲和能分别为-121 kJ·mol-1、7 kJ·mol-1、-141kJ·mol-1。请解释N元素第一电子亲和能异常的原因:
(3)氨水的主要成分为NH3·H2O,农业上经稀释后可作化肥。
①氨水的施用原则是“一不离土,二不离水”。不离土就是要深施覆土,不离水就是加水稀释,这样做的目的是
②NH3和H2O相比,键角较大的是
(4)O、Ca、Ba 、Cu、Hg可以形成超导材料HBCO,晶胞结构如图所示。

①晶胞中Ba与Ca均位于体内,晶胞中与Ca距离最近的O原子 有
②设阿伏加德罗常数的值为NA,则晶胞的密度为
您最近一年使用:0次
名校
解题方法
5 . 氮、铁、钴等元素的化合物在现代农业、科技、国防建设中有着许多独特的用途。
(1)铁、钴位于周期表的_______ 区, 的电子式为
的电子式为_______ ,N、C、O的第一电离能由大到小的顺序为_______ , 中心离子的电子排布式为
中心离子的电子排布式为_______ ,已知 的几何构型为正八面体形,推测
的几何构型为正八面体形,推测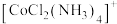 的空间结构有
的空间结构有_______ 种。
(2)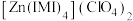 是
是 的一种配合物,IMI的结构为
的一种配合物,IMI的结构为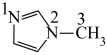 ,IMI中大π键可表示为
,IMI中大π键可表示为
_______ (已知苯中的大π键可表示为 ),该配合物的配位原子为
),该配合物的配位原子为_______ (填序号),配位数为_______ ,IMI的某种衍生物与甘氨酸形成的离子化合物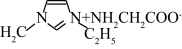 常温下为液态而非固态。原因是
常温下为液态而非固态。原因是_______ 。
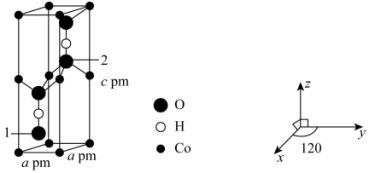
(3)Co可以形成六方晶系晶体,晶胞结构如图所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子坐标。已知晶胞含对称中心,其中1号O原子的坐标为(0.6667,0.3333,0.1077),则2号O原子的坐标为_______ 。设 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为_______  (用代数式表示)。
(用代数式表示)。
(1)铁、钴位于周期表的
 的电子式为
的电子式为 中心离子的电子排布式为
中心离子的电子排布式为 的几何构型为正八面体形,推测
的几何构型为正八面体形,推测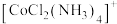 的空间结构有
的空间结构有(2)
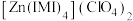 是
是 的一种配合物,IMI的结构为
的一种配合物,IMI的结构为 ,IMI中大π键可表示为
,IMI中大π键可表示为 ),该配合物的配位原子为
),该配合物的配位原子为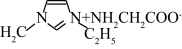 常温下为液态而非固态。原因是
常温下为液态而非固态。原因是(3)Co可以形成六方晶系晶体,晶胞结构如图所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子坐标。已知晶胞含对称中心,其中1号O原子的坐标为(0.6667,0.3333,0.1077),则2号O原子的坐标为
 为阿伏加德罗常数的值,该晶体的密度为
为阿伏加德罗常数的值,该晶体的密度为 (用代数式表示)。
(用代数式表示)。
您最近一年使用:0次
6 . VA族元素氮、磷、砷(As)、锑(Sb)、铋(Bi)的单质及其化合物在科研和生产中有许多重要用途。
(1)铋合金可用于自动喷水器的安全塞,一旦发生火灾时,安全塞会“自动”熔化,喷出水来灭火。已知原子中运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的铋原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的铋原子,其价电子自旋磁量子数的代数和为_______ 。
(2)第三周期元素中第一电离能大于磷的元素有_______ (填元素符号)。
(3)下列氮原子的电子排布图表示的状态中,能量由低到高的顺序是_______ (填字母代号)。
A.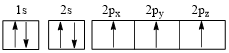 B.
B.
C.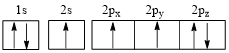 D.
D.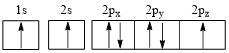
(4) 可用于制造火柴,其分子结构如图1所示。
可用于制造火柴,其分子结构如图1所示。
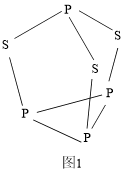
① 分子中磷原子的杂化轨道类型为
分子中磷原子的杂化轨道类型为_______ 。
②每摩尔 分子中含有的孤电子对的数目为
分子中含有的孤电子对的数目为_______ 。
(5)直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,如图2所示。则这类磷酸根离子的最简单的表示形式为_______ 。

(6) 中
中 的等电子体为
的等电子体为_______ 。(写一种分子)
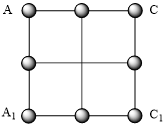
(7)磷化镓是一种由ⅢA族元素镓(Ga)与VA族元素磷(P)人工合成的Ⅲ-V族化合物半导体材料.晶胞结构可看作金刚石晶胞内部的碳原子被Ga原子代替,顶点和面心的碳原子被P原子代替.磷化镓的晶胞结构如图3,图4中矩形 是沿晶胞对角面取得的截图:
是沿晶胞对角面取得的截图:
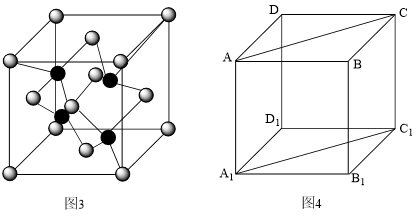
请画出晶胞中镓(Ga)原子在矩形 中的位置
中的位置_______ 。
(8)若晶胞密度为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则晶胞中距离最近的P和
,则晶胞中距离最近的P和 之间距离为
之间距离为_______  (列出计算表达式)。
(列出计算表达式)。
(1)铋合金可用于自动喷水器的安全塞,一旦发生火灾时,安全塞会“自动”熔化,喷出水来灭火。已知原子中运动的电子有两种相反的自旋状态,若一种自旋状态用
 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的铋原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的铋原子,其价电子自旋磁量子数的代数和为(2)第三周期元素中第一电离能大于磷的元素有
(3)下列氮原子的电子排布图表示的状态中,能量由低到高的顺序是
A.
 B.
B.
C.
 D.
D.
(4)
 可用于制造火柴,其分子结构如图1所示。
可用于制造火柴,其分子结构如图1所示。
①
 分子中磷原子的杂化轨道类型为
分子中磷原子的杂化轨道类型为②每摩尔
 分子中含有的孤电子对的数目为
分子中含有的孤电子对的数目为(5)直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,如图2所示。则这类磷酸根离子的最简单的表示形式为

(6)
 中
中 的等电子体为
的等电子体为(7)磷化镓是一种由ⅢA族元素镓(Ga)与VA族元素磷(P)人工合成的Ⅲ-V族化合物半导体材料.晶胞结构可看作金刚石晶胞内部的碳原子被Ga原子代替,顶点和面心的碳原子被P原子代替.磷化镓的晶胞结构如图3,图4中矩形
 是沿晶胞对角面取得的截图:
是沿晶胞对角面取得的截图:
请画出晶胞中镓(Ga)原子在矩形
 中的位置
中的位置
(8)若晶胞密度为
 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则晶胞中距离最近的P和
,则晶胞中距离最近的P和 之间距离为
之间距离为 (列出计算表达式)。
(列出计算表达式)。
您最近一年使用:0次
2022-03-24更新
|
181次组卷
|
2卷引用:河北省2021-2022学高三下学期3月全过程纵向评价化学试题
2022·河北·模拟预测
解题方法
7 . 卤族元素及其化合物用途非常广泛。回答下列问题:
(1) 可以与一定量的水形成
可以与一定量的水形成 晶体,基态B原子核外电子的空间运动状态有
晶体,基态B原子核外电子的空间运动状态有_______ 种, 中B原子采用的是
中B原子采用的是_______ 杂化。
(2)氯的化合物很多,常见的有 、
、 等.其中
等.其中 常温常压下为无色液体,则
常温常压下为无色液体,则 的空间构型为
的空间构型为_______ ,其固体的晶体类型为_______ 。无水 不能干燥
不能干燥 是因为形成了
是因为形成了 ,形成的配位离子中提供空轨道的是
,形成的配位离子中提供空轨道的是_______ ,提供孤对电子的是_______ 。
(3)某化合物 由
由 和
和 层交替堆叠构成.该化合物的所有组成元素位于元素周期表的
层交替堆叠构成.该化合物的所有组成元素位于元素周期表的_______ (填“s”“d”或“p”)区。O、S、N,3种元素的第一电离能由大到小的顺序是_______ 。
(4) 为直线形分子,属四方晶系,
为直线形分子,属四方晶系, 晶体结构如图所示.晶胞棱边夹角均为
晶体结构如图所示.晶胞棱边夹角均为 ,1个
,1个 晶胞中有
晶胞中有_______ 个 分子。若
分子。若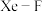 键的键长为190pm,设阿伏加德罗常数的值为
键的键长为190pm,设阿伏加德罗常数的值为 ,该晶体的密度为
,该晶体的密度为_______  (结果保留两位小数)。
(结果保留两位小数)。

(1)
 可以与一定量的水形成
可以与一定量的水形成 晶体,基态B原子核外电子的空间运动状态有
晶体,基态B原子核外电子的空间运动状态有 中B原子采用的是
中B原子采用的是(2)氯的化合物很多,常见的有
 、
、 等.其中
等.其中 常温常压下为无色液体,则
常温常压下为无色液体,则 的空间构型为
的空间构型为 不能干燥
不能干燥 是因为形成了
是因为形成了 ,形成的配位离子中提供空轨道的是
,形成的配位离子中提供空轨道的是(3)某化合物
 由
由 和
和 层交替堆叠构成.该化合物的所有组成元素位于元素周期表的
层交替堆叠构成.该化合物的所有组成元素位于元素周期表的(4)
 为直线形分子,属四方晶系,
为直线形分子,属四方晶系, 晶体结构如图所示.晶胞棱边夹角均为
晶体结构如图所示.晶胞棱边夹角均为 ,1个
,1个 晶胞中有
晶胞中有 分子。若
分子。若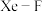 键的键长为190pm,设阿伏加德罗常数的值为
键的键长为190pm,设阿伏加德罗常数的值为 ,该晶体的密度为
,该晶体的密度为 (结果保留两位小数)。
(结果保留两位小数)。
您最近一年使用:0次
名校
解题方法
8 . 卤族元素及其化合物种类繁多,有着非常重要的用途,回答下列问题:
(1)基态Br原子的电子排布式为[Ar]____ 。
(2)HF分子的极性____ (填“大于”“等于”或“小于”,以下同)HCl,同一条件下,HF在水中的溶解度____ HCl,HF的沸点____ HCl。SOCl2中心S原子VSEPR模型为____ 。1mol氟硼酸铵NH4BF4中含有____ mol配位键。
(3)一种Ag2HgI4固体导电材料为四方晶系,其晶胞参数为apm、apm和2apm,晶胞沿x、y、z的方向投影(如图所示),A、B、C表示三种不同原子的投影,标记为n的原子分数坐标为( ,
, ,
, ),则m的原子分数坐标为
),则m的原子分数坐标为____ ,距离Hg最近的Ag有____ 个。设NA为阿伏加德罗常数的值,Ag2HgI4的摩尔质量为Mg•mol-1,该晶体的密度为____ g•cm-3(用代数式表示)。

(1)基态Br原子的电子排布式为[Ar]
(2)HF分子的极性
(3)一种Ag2HgI4固体导电材料为四方晶系,其晶胞参数为apm、apm和2apm,晶胞沿x、y、z的方向投影(如图所示),A、B、C表示三种不同原子的投影,标记为n的原子分数坐标为(
 ,
, ,
, ),则m的原子分数坐标为
),则m的原子分数坐标为
您最近一年使用:0次
2022-03-22更新
|
1247次组卷
|
3卷引用:河北省衡水中学2023届高三上学期三调考试化学试题
9 . ⅤA族元素及其化合物在生产、生活中用途广泛。
(1)①P4S3常用于制造火柴,P和S的第一电离能较大的是____ 。
②As4S4俗称雄黄,其中基态As原子的核外电子排布式为[Ar]____ ,有____ 个未成对电子。
③P、S、As电负性由大到小的顺序是____ 。
(2)NH3、PH3、AsH3中沸点最高的是___ ,其主要原因是____ 。
(3)白磷在氯气中燃烧可以得到PCl3和PCl5,其中气态PCl3分子的立体构型为___ 。
(4)锑酸亚铁晶胞如图所示,其晶胞参数分别为a nm、b nm、c nm,α=β=γ=90°,则:
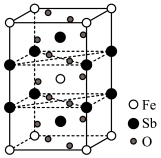
①锑酸亚铁的化学式为____ 。
②晶体的密度为___ g·cm-3(设NA为阿伏加德罗常数的值)。
(1)①P4S3常用于制造火柴,P和S的第一电离能较大的是
②As4S4俗称雄黄,其中基态As原子的核外电子排布式为[Ar]
③P、S、As电负性由大到小的顺序是
(2)NH3、PH3、AsH3中沸点最高的是
(3)白磷在氯气中燃烧可以得到PCl3和PCl5,其中气态PCl3分子的立体构型为
(4)锑酸亚铁晶胞如图所示,其晶胞参数分别为a nm、b nm、c nm,α=β=γ=90°,则:

①锑酸亚铁的化学式为
②晶体的密度为
您最近一年使用:0次
10 . 钴及其配合物在生活、生产中用途广泛。请回答下列问题:
(1)基态Co原子的电子排布式为_______ 。
(2) 是一种不溶于水的紫红色固体,由于其热稳定性较好,可用作聚氯乙烯的染色剂和稳定剂。在该配合物中,Co的化合价为
是一种不溶于水的紫红色固体,由于其热稳定性较好,可用作聚氯乙烯的染色剂和稳定剂。在该配合物中,Co的化合价为_______ 价,中心原子的配体为_______ 。 中含有的配位键数目为
中含有的配位键数目为_______ ,当向其中加入足量硝酸银溶液时,生成的AgCl质量为_______ g。
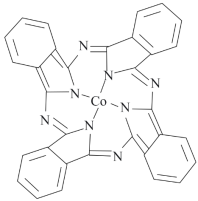
(3)酞菁钴(结构简式如图)主要应用于工业涂料印墨及塑料着色。C原子的杂化方式为_______ ,该配合物涉及的非金属元素的第一电离能由大到小的顺序是_______ (填元素符号)。
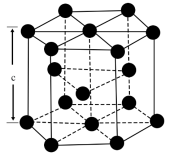
(4)金属钴单质的晶体结构有三种,其中一种六方晶胞结构如图所示,该晶胞中的钴原子数目为_______ ,设阿伏加德罗常数的值为 ,晶胞的底面积为
,晶胞的底面积为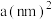 ,晶胞的密度为
,晶胞的密度为 ,则该晶胞的高c为
,则该晶胞的高c为_______ nm。
(1)基态Co原子的电子排布式为
(2)
 是一种不溶于水的紫红色固体,由于其热稳定性较好,可用作聚氯乙烯的染色剂和稳定剂。在该配合物中,Co的化合价为
是一种不溶于水的紫红色固体,由于其热稳定性较好,可用作聚氯乙烯的染色剂和稳定剂。在该配合物中,Co的化合价为 中含有的配位键数目为
中含有的配位键数目为(3)酞菁钴(结构简式如图)主要应用于工业涂料印墨及塑料着色。C原子的杂化方式为

(4)金属钴单质的晶体结构有三种,其中一种六方晶胞结构如图所示,该晶胞中的钴原子数目为
 ,晶胞的底面积为
,晶胞的底面积为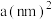 ,晶胞的密度为
,晶胞的密度为 ,则该晶胞的高c为
,则该晶胞的高c为
您最近一年使用:0次
2022-03-20更新
|
109次组卷
|
3卷引用:河北省邢台市四校联考2021-2022学年高二下学期第二次月考化学试题



