名校
解题方法
1 . Fe、Ni均为Ⅷ族元素,与C、N、O、P等组成的化合物有广泛的用途。回答下列问题:
(1)基态 的价层电子轨道表达式为
的价层电子轨道表达式为_______ ,C、N、O的第一电离能从小到大的顺序为_______ 。
(2)N、P可形成一些复杂离子,如 、
、 、
、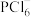 等。
等。 中N原子的杂化类型为
中N原子的杂化类型为_______ , 的空间构型为
的空间构型为_______ 。
(3)Fe、Ni易与CO形成配合物, 中σ键与π键个数比为
中σ键与π键个数比为_______ , 熔点-25℃,沸点43℃,不溶于水,溶于乙醇、苯等有机溶剂,
熔点-25℃,沸点43℃,不溶于水,溶于乙醇、苯等有机溶剂, 为
为_______ 晶体。
(4)FeO、NiO的晶体类型与结构和NaCl相同。
①熔点FeO_______ NiO(填“>”、“<”或“=”)。
②FeO晶胞如图, 的配位数为
的配位数为_______ 。

(1)基态
 的价层电子轨道表达式为
的价层电子轨道表达式为(2)N、P可形成一些复杂离子,如
 、
、 、
、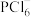 等。
等。 中N原子的杂化类型为
中N原子的杂化类型为 的空间构型为
的空间构型为(3)Fe、Ni易与CO形成配合物,
 中σ键与π键个数比为
中σ键与π键个数比为 熔点-25℃,沸点43℃,不溶于水,溶于乙醇、苯等有机溶剂,
熔点-25℃,沸点43℃,不溶于水,溶于乙醇、苯等有机溶剂, 为
为(4)FeO、NiO的晶体类型与结构和NaCl相同。
①熔点FeO
②FeO晶胞如图,
 的配位数为
的配位数为
您最近一年使用:0次
2 . 许多元素及它们的化合物在科学研究和工业生产中具有多种用途。请回答下列有关问题:
(1)现代化学中,常利用____ 上的特征谱线来鉴定元素。
(2)某同学画出的基态碳原子的核外电子排布图为 ,该电子排布图背了
,该电子排布图背了____ 。CH 、—CH3、CH
、—CH3、CH 都是重要的有机反应中间体。CH
都是重要的有机反应中间体。CH 、CH
、CH 的空间构型分别为
的空间构型分别为____ 、____ 。
(3)咪唑的结构为 。分子中的大π键可用符号π
。分子中的大π键可用符号π 表示。其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π
表示。其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π )。咪唑分子中的大π键可表示为
)。咪唑分子中的大π键可表示为____ ,咪唑比环戊烯C5H8熔点高的主要原因是____ 。
(4) 中孤电子对与π键比值为
中孤电子对与π键比值为_____ ,碳原子的杂化方式为____ 。
(5)铁氮化合物是磁性材料研究中的热点课题之一,因其具有高饱和磁化强度、低矫顽力。有望获得较高的微波磁导率,具有极大的市场潜力。其四子格结构如图所示,已知晶体密度为ρg·cm-3,阿伏加德罗常数为NA。

①写出氮化铁中铁的堆积方式为____ 。
②该化合物的化学式为____ 。
③计算出Fe(II)围成的八面体的体积为____ cm3。
(1)现代化学中,常利用
(2)某同学画出的基态碳原子的核外电子排布图为
 ,该电子排布图背了
,该电子排布图背了 、—CH3、CH
、—CH3、CH 都是重要的有机反应中间体。CH
都是重要的有机反应中间体。CH 、CH
、CH 的空间构型分别为
的空间构型分别为(3)咪唑的结构为
 。分子中的大π键可用符号π
。分子中的大π键可用符号π 表示。其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π
表示。其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π )。咪唑分子中的大π键可表示为
)。咪唑分子中的大π键可表示为(4)
 中孤电子对与π键比值为
中孤电子对与π键比值为(5)铁氮化合物是磁性材料研究中的热点课题之一,因其具有高饱和磁化强度、低矫顽力。有望获得较高的微波磁导率,具有极大的市场潜力。其四子格结构如图所示,已知晶体密度为ρg·cm-3,阿伏加德罗常数为NA。

①写出氮化铁中铁的堆积方式为
②该化合物的化学式为
③计算出Fe(II)围成的八面体的体积为
您最近一年使用:0次
名校
解题方法
3 . 金属铜和镍及其化合物在工业、农业、国防以及航天等领域都有广泛的用途。请回答下列有关问题:
(1)胆矾 可写成
可写成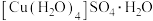 ,其结构示意图如图1所示:
,其结构示意图如图1所示:

①基态 原子的核外电子排布式为
原子的核外电子排布式为_______ 。
② 的空间构型为
的空间构型为_______ 。
③该物质中除了含离子键外,还有_______ 等作用。
(2)某鲜红色含镍物质的结构如图2所示:

①图中非金属元素的电负性由大到小的顺序为_______ (填元素符号)。
②该物质中C原子的杂化轨道类型是_______ 。
(3)镍和铜的第二电离能分别为 、
、 。则
。则
_______  (填“>”“<”或“=”),其原因是
(填“>”“<”或“=”),其原因是_______ 。
(4)已知氧化镍的晶胞结构如图3所示:

①某缺陷氧化镍的组成为 ,其中
,其中 元素只有
元素只有 和
和 两种价态,则
两种价态,则 和
和 两种价态的镍离子数之比为
两种价态的镍离子数之比为_______ 。
②若该晶体无缺陷,其密度为 ,晶胞中最近的
,晶胞中最近的 之间的距离为
之间的距离为 ,则阿伏加德罗常数
,则阿伏加德罗常数
_______ (用含 、a的代数式表示)。
、a的代数式表示)。
(1)胆矾
 可写成
可写成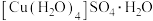 ,其结构示意图如图1所示:
,其结构示意图如图1所示:
①基态
 原子的核外电子排布式为
原子的核外电子排布式为②
 的空间构型为
的空间构型为③该物质中除了含离子键外,还有
(2)某鲜红色含镍物质的结构如图2所示:

①图中非金属元素的电负性由大到小的顺序为
②该物质中C原子的杂化轨道类型是
(3)镍和铜的第二电离能分别为
 、
、 。则
。则
 (填“>”“<”或“=”),其原因是
(填“>”“<”或“=”),其原因是(4)已知氧化镍的晶胞结构如图3所示:

①某缺陷氧化镍的组成为
 ,其中
,其中 元素只有
元素只有 和
和 两种价态,则
两种价态,则 和
和 两种价态的镍离子数之比为
两种价态的镍离子数之比为②若该晶体无缺陷,其密度为
 ,晶胞中最近的
,晶胞中最近的 之间的距离为
之间的距离为 ,则阿伏加德罗常数
,则阿伏加德罗常数
 、a的代数式表示)。
、a的代数式表示)。
您最近一年使用:0次
2022-04-09更新
|
313次组卷
|
2卷引用:新疆石河子第一中学2021-2022学年高二4月月考化学试题
4 . VA族元素及其化合物在材料等方面有重要用途。根据所学知识回答下列问题:
(1)基态砷原子处于最高能级的电子云轮廓图为_______ 形。
(2)NH3、PH3、AsH3是同主族元素的氢化物,其中键角最小的是________ 。
(3)叠氮化钠(NaN3)用于汽车的安气囊中,当发生车祸时迅速分解放出氮气,使安全气囊充气。可与酸反应生成叠氮酸(HN3),叠氮酸中3个氮原子的杂化类型分别为___________ (不分先后)。
(4)N原子之间可以形成π键,而As原子之间较难形成π键。从原子结构角度分析,其原因为________ 。
(5)往硫酸铜溶液中加入过量氨水,可生成配离子[Cu(NH3)4]2+。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是______ 。
(6)磷的含氧酸有很多种,其中有磷酸(H3PO4)、亚磷酸(H3PO3)、次磷酸(H3PO2)等。
①已知NaH2PO2是次磷酸的正盐,则1molH3PO2中含有的σ键的物质的量为___ mol。
②磷酸通过分子间脱水缩合形成多磷酸,如:
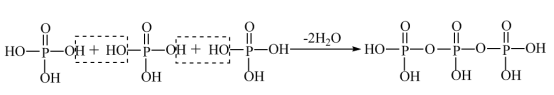
如果有n个磷酸分子间脱水形成链状的多磷酸,则相应的酸根可写为_______ 。
(7)HgCl2和不同浓度NH3–NH4Cl反应得到某种含汞化合物的晶胞结构(有四个等同的小立方体)如图所示。(部分微粒不在晶胞内,每个Hg原子均处于小立方体的面心)

写出该含汞化合物的化学式:______ 。则该晶体的密度ρ=_____ g·cm-3(设阿伏加德罗常数的值为NA,用含a、NA的代数式表示)。
(1)基态砷原子处于最高能级的电子云轮廓图为
(2)NH3、PH3、AsH3是同主族元素的氢化物,其中键角最小的是
(3)叠氮化钠(NaN3)用于汽车的安气囊中,当发生车祸时迅速分解放出氮气,使安全气囊充气。可与酸反应生成叠氮酸(HN3),叠氮酸中3个氮原子的杂化类型分别为
(4)N原子之间可以形成π键,而As原子之间较难形成π键。从原子结构角度分析,其原因为
(5)往硫酸铜溶液中加入过量氨水,可生成配离子[Cu(NH3)4]2+。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是
(6)磷的含氧酸有很多种,其中有磷酸(H3PO4)、亚磷酸(H3PO3)、次磷酸(H3PO2)等。
①已知NaH2PO2是次磷酸的正盐,则1molH3PO2中含有的σ键的物质的量为
②磷酸通过分子间脱水缩合形成多磷酸,如:

如果有n个磷酸分子间脱水形成链状的多磷酸,则相应的酸根可写为
(7)HgCl2和不同浓度NH3–NH4Cl反应得到某种含汞化合物的晶胞结构(有四个等同的小立方体)如图所示。(部分微粒不在晶胞内,每个Hg原子均处于小立方体的面心)

写出该含汞化合物的化学式:
您最近一年使用:0次
2022-01-11更新
|
329次组卷
|
5卷引用:新疆昌吉州2021-2022学年高三上学期第二次高考质量检测化学试题
新疆昌吉州2021-2022学年高三上学期第二次高考质量检测化学试题河北省邢台市名校联盟2021-2022学年高三上学期期末测试化学试题 (已下线)一轮巩固卷6-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(广东专用)青海省海东市2022届高考一模理科综合化学试题陕西省商洛市2021-2022学年高三上学期期末教学质量检测理科综合化学试题
名校
解题方法
5 . 金属元素Fe、Ni、Pt均为周期表中同族元素。
(1)Fe是常见的金属,生活中用途广泛。请回答下列问题:
①Fe的一种晶胞结构如图所示,测得晶胞边长为apm,则Fe原子半径为__ pm。

②已知:FeO晶体晶胞结构为NaCl型,与O2-距离最近且等距离的亚铁离子围成的立体构型为__ 。
(2)铂可与不同的配体形成多种配合物,分子式为[Pt(NH3)2Cl4]的配合物的配位体是___ ;该配合物有两种不同的颜色,其中橙黄色比较不稳定,在水中的溶解度大;呈亮黄色的物质在水中的溶解度小,如图所示的结构示意图中呈亮黄色的是__ (填“A”或“B”)。

(3)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图。

①测知镧镍合金晶胞体积为9.0×10-23cm3,则镧镍合金的晶体密度为___ g·cm-3(不必计算结果)。
②储氢原理为:镧镍合金吸附H2,H2解离为原子,H原子储存在其中形成化合物。若储氢后,氢原子占据晶胞中上下底面的棱和面心,则形成的储氢化合物的化学式为___ 。
(1)Fe是常见的金属,生活中用途广泛。请回答下列问题:
①Fe的一种晶胞结构如图所示,测得晶胞边长为apm,则Fe原子半径为

②已知:FeO晶体晶胞结构为NaCl型,与O2-距离最近且等距离的亚铁离子围成的立体构型为
(2)铂可与不同的配体形成多种配合物,分子式为[Pt(NH3)2Cl4]的配合物的配位体是

(3)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图。

①测知镧镍合金晶胞体积为9.0×10-23cm3,则镧镍合金的晶体密度为
②储氢原理为:镧镍合金吸附H2,H2解离为原子,H原子储存在其中形成化合物。若储氢后,氢原子占据晶胞中上下底面的棱和面心,则形成的储氢化合物的化学式为
您最近一年使用:0次
2021-05-06更新
|
125次组卷
|
3卷引用:新疆乌鲁木齐市第七十中学2021-2022学年高二下学期期中考试化学试题



