名校
解题方法
1 .  及其化合物在生产生活方面都有重要的用途.回答下列问题:
及其化合物在生产生活方面都有重要的用途.回答下列问题:
(1)基态铁原子的核外电子排布式为:______ , 比
比 更稳定的原因是:
更稳定的原因是:______ 。
(2) 中铁元素的配位数是
中铁元素的配位数是______ ,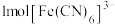 中含有的
中含有的 键的数目为
键的数目为______ , 中C原子的杂化方式为
中C原子的杂化方式为______ 。
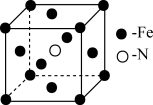
(3)铁和氨在 可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:
可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:______ 。
(4)血红素铁用作铁强化剂,其吸收率比一般铁剂高3倍,图中画出 与N原子间的化学键(若是配位键,需要用箭头加以表示)
与N原子间的化学键(若是配位键,需要用箭头加以表示)______ 。

 及其化合物在生产生活方面都有重要的用途.回答下列问题:
及其化合物在生产生活方面都有重要的用途.回答下列问题:(1)基态铁原子的核外电子排布式为:
 比
比 更稳定的原因是:
更稳定的原因是:(2)
 中铁元素的配位数是
中铁元素的配位数是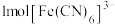 中含有的
中含有的 键的数目为
键的数目为 中C原子的杂化方式为
中C原子的杂化方式为(3)铁和氨在
 可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:
可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式:
(4)血红素铁用作铁强化剂,其吸收率比一般铁剂高3倍,图中画出
 与N原子间的化学键(若是配位键,需要用箭头加以表示)
与N原子间的化学键(若是配位键,需要用箭头加以表示)
您最近一年使用:0次
2 . 碳族元素中的碳、硅、锗、铅及其化合物在诸多领域有重要用途。下列说法正确的是
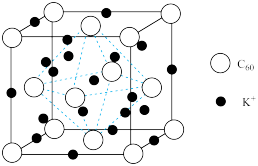

| A.一种超导体晶胞如图所示,1个晶胞中含有240个C原子 |
| B.硅是重要的半导体材料,可制成二极管、三极管和光导纤维 |
C.基态锗(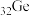 )原子外围电子排布式为 )原子外围电子排布式为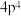 |
D.铅蓄电池放电时的负极反应为: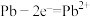 |
您最近一年使用:0次
名校
解题方法
3 . 钛的化合物如 、
、 、
、 、
、 等均有着广泛用途。
等均有着广泛用途。
(1)写出Ti的基态原子的核外电子排布式:_______ 。
(2) 熔点是-25℃,沸点136.4℃,可溶于苯或
熔点是-25℃,沸点136.4℃,可溶于苯或 ,该晶体属于
,该晶体属于_______ 晶体; 中B原子的杂化类型为
中B原子的杂化类型为_______ 。
(3)在 催化作用下,可将
催化作用下,可将 氧化成
氧化成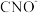 ,进而得到
,进而得到 。与
。与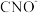 互为等电子体的分子化学式为
互为等电子体的分子化学式为_______ 。
(4) 难溶于水和稀酸,但能溶于浓硫酸,析出含有钛酰离子的晶体,钛酰离子常成为链状聚合形式的阳离子,其结构形式如图1,化学式为
难溶于水和稀酸,但能溶于浓硫酸,析出含有钛酰离子的晶体,钛酰离子常成为链状聚合形式的阳离子,其结构形式如图1,化学式为_______ 。

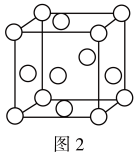
(5)金属钛内部原子的堆积方式是面心立方堆积方式,如图2,若该晶胞的密度为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶胞的边长为
,则该晶胞的边长为_______ cm。
 、
、 、
、 、
、 等均有着广泛用途。
等均有着广泛用途。(1)写出Ti的基态原子的核外电子排布式:
(2)
 熔点是-25℃,沸点136.4℃,可溶于苯或
熔点是-25℃,沸点136.4℃,可溶于苯或 ,该晶体属于
,该晶体属于 中B原子的杂化类型为
中B原子的杂化类型为(3)在
 催化作用下,可将
催化作用下,可将 氧化成
氧化成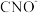 ,进而得到
,进而得到 。与
。与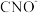 互为等电子体的分子化学式为
互为等电子体的分子化学式为(4)
 难溶于水和稀酸,但能溶于浓硫酸,析出含有钛酰离子的晶体,钛酰离子常成为链状聚合形式的阳离子,其结构形式如图1,化学式为
难溶于水和稀酸,但能溶于浓硫酸,析出含有钛酰离子的晶体,钛酰离子常成为链状聚合形式的阳离子,其结构形式如图1,化学式为
(5)金属钛内部原子的堆积方式是面心立方堆积方式,如图2,若该晶胞的密度为
 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶胞的边长为
,则该晶胞的边长为
您最近一年使用:0次
4 . 硼、镓、氮的化合物在生产、生活中有广泛用途:
(1)氮化镓(GaN)是新型的半导体材料。基态Ga原子的价电子排布图为____ ;基态N原子的核外有___ 种空间运动状态的电子。
Fe、Ni元素性质非常相似,属于铁系元素,得到广泛应用,请回答下列问题:
(2)Fe元素位于元素周期表的____ 区(填分区)。
(3)基态Ni3+核外电子排布式为____ 。
(4)鉴定Ni2+的特征反应是将丁二酮肟加入Ni2+盐溶液中,生成鲜红色的螯合物M,M结构如图1所示:

①组成M的五种元素中,除H元素外,另外四种元素第一电离能由大到小的顺序为___ (填元素符号),其中C原子的杂化类型为___ 。
②图中各微粒间不存在的作用力有___ (填标号)。
a.配位键b.极性键c.非极性键d.π键e.离子键f.氢键
(5)一种铁氮化合物具有高磁导率,可用于制电子元件,其晶胞结构如图2所示。

该铁氮化合物的化学式为____ 。
(1)氮化镓(GaN)是新型的半导体材料。基态Ga原子的价电子排布图为
Fe、Ni元素性质非常相似,属于铁系元素,得到广泛应用,请回答下列问题:
(2)Fe元素位于元素周期表的
(3)基态Ni3+核外电子排布式为
(4)鉴定Ni2+的特征反应是将丁二酮肟加入Ni2+盐溶液中,生成鲜红色的螯合物M,M结构如图1所示:

①组成M的五种元素中,除H元素外,另外四种元素第一电离能由大到小的顺序为
②图中各微粒间不存在的作用力有
a.配位键b.极性键c.非极性键d.π键e.离子键f.氢键
(5)一种铁氮化合物具有高磁导率,可用于制电子元件,其晶胞结构如图2所示。

该铁氮化合物的化学式为
您最近一年使用:0次
名校
解题方法
5 . N、P、As及其化合物在生产生活方面都有重要的用途。回答下列问题:
(1)As原子的基态核外电子排布式为___________ 。
(2)Pt(NH3)2Cl2有如图所示两种结构,Pt2+的配位体是___________ 。顺铂在水中溶解度较大,反铂在水中溶解度小,顺铂在水中溶解度较大的原因是___________ 。
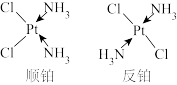
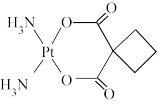
(3)碳铂是一种广谱抗癌药物,其结构如图。其分子中碳原子轨道杂化类型为___________ 。
(4)PCl3和BCl3混合与H2在1000℃条件下可得到一种半导体材料,其晶胞结构如图所示。BCl3的空间构型为___________ (用文字描述),该反应的化学方程式为___________ 。

(1)As原子的基态核外电子排布式为
(2)Pt(NH3)2Cl2有如图所示两种结构,Pt2+的配位体是
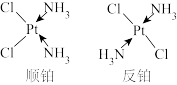
(3)碳铂是一种广谱抗癌药物,其结构如图。其分子中碳原子轨道杂化类型为

(4)PCl3和BCl3混合与H2在1000℃条件下可得到一种半导体材料,其晶胞结构如图所示。BCl3的空间构型为

您最近一年使用:0次
2022·江苏·模拟预测
解题方法
6 . 含硫矿物如黄铁矿(FeS2)、黄铜矿、芒硝在工业上有着重要的用途。收集黄铜矿炼铜过程中产生的SO2制备SO3,其反应为2SO2(g)+O2(g) 2SO3(g)
2SO3(g) 
 下列有关说法正确的是
下列有关说法正确的是

 2SO3(g)
2SO3(g) 
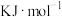 下列有关说法正确的是
下列有关说法正确的是
| A.SO2溶于水所得溶液能导电,所以SO2是电解质 |
B. 的空间构型为平面三角形 的空间构型为平面三角形 |
| C.电负性:O<S |
| D.黄铜矿的晶胞如图所示,则其化学式为:CuFeS2 |
您最近一年使用:0次
7 . 铁元素被称为“人类第一元素”,铁及其化合物具有广泛的用途。
(1)水体中过量的 是一种重要污染物,可利用纳米铁粉将其除去。
是一种重要污染物,可利用纳米铁粉将其除去。
①基态铁原子核外电子排布式:___________ ;铁元素在元素周期表中的位置为___________ ,属于___________ 区元素。
②相同条件下,向含有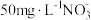 的两份水样中分别加入纳米铁粉、纳米铁粉-活性炭-铜粉,
的两份水样中分别加入纳米铁粉、纳米铁粉-活性炭-铜粉, 的去除速率差异如图1所示,产生该差异的可能原因为
的去除速率差异如图1所示,产生该差异的可能原因为___________ 。


(2)铁镁合金是目前储氢密度最高的材料之一,其晶胞结构如图2所示。储氢时, 分子位于晶胞体心和棱的中心位置。
分子位于晶胞体心和棱的中心位置。
①该晶胞中 的配位数是
的配位数是___________ 。
②该合金储满氢后所得晶体的化学式是___________ 。
(3)在生产中,常用 处理
处理 的含
的含 (
( 价)废水得到
价)废水得到 和
和 。
。 易被氧化为
易被氧化为 ,请利用核外电子排布的相关原理解释其原因:
,请利用核外电子排布的相关原理解释其原因:___________ 。
(1)水体中过量的
 是一种重要污染物,可利用纳米铁粉将其除去。
是一种重要污染物,可利用纳米铁粉将其除去。①基态铁原子核外电子排布式:
②相同条件下,向含有
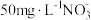 的两份水样中分别加入纳米铁粉、纳米铁粉-活性炭-铜粉,
的两份水样中分别加入纳米铁粉、纳米铁粉-活性炭-铜粉, 的去除速率差异如图1所示,产生该差异的可能原因为
的去除速率差异如图1所示,产生该差异的可能原因为

(2)铁镁合金是目前储氢密度最高的材料之一,其晶胞结构如图2所示。储氢时,
 分子位于晶胞体心和棱的中心位置。
分子位于晶胞体心和棱的中心位置。①该晶胞中
 的配位数是
的配位数是②该合金储满氢后所得晶体的化学式是
(3)在生产中,常用
 处理
处理 的含
的含 (
( 价)废水得到
价)废水得到 和
和 。
。 易被氧化为
易被氧化为 ,请利用核外电子排布的相关原理解释其原因:
,请利用核外电子排布的相关原理解释其原因:
您最近一年使用:0次
2022-06-28更新
|
226次组卷
|
2卷引用:江苏省徐州市2021-2022学年高二下学期期末抽测化学试题



