名校
解题方法
1 . 氮的相关化合物在材料等方面有重要用途。回答下列问题:
(1)基态N原子的核外电子排布式为_______ ,第一电离能: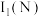
_______ 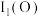 (填“大于”或“小于”)。
(填“大于”或“小于”)。
(2)N及其同族的P、As均可形成类似的氢化物, 、
、 ,
, 的沸点由高到低的顺序为
的沸点由高到低的顺序为_______ (填化学式)。
(3)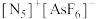 是一种全氮阳离子形成的高能物质,其结构如图所示,其中N原子的杂化轨道类型为
是一种全氮阳离子形成的高能物质,其结构如图所示,其中N原子的杂化轨道类型为_______ 。 与EDTA形成的螯合物的结构如图所示,1个该配合物中通过螯合作用形成的配位键有
与EDTA形成的螯合物的结构如图所示,1个该配合物中通过螯合作用形成的配位键有_______ 个,其中提供孤对电子的原子为_______ (写元素符号)。 ,则C点的原子坐标参数为
,则C点的原子坐标参数为_______ 。
②已知晶胞参数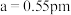 ,则该晶体的密度为
,则该晶体的密度为_______  (用
(用 表示阿伏加德罗常数,只列出计算表达式即可。)
表示阿伏加德罗常数,只列出计算表达式即可。)
(1)基态N原子的核外电子排布式为
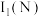
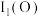 (填“大于”或“小于”)。
(填“大于”或“小于”)。(2)N及其同族的P、As均可形成类似的氢化物,
 、
、 ,
, 的沸点由高到低的顺序为
的沸点由高到低的顺序为(3)
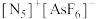 是一种全氮阳离子形成的高能物质,其结构如图所示,其中N原子的杂化轨道类型为
是一种全氮阳离子形成的高能物质,其结构如图所示,其中N原子的杂化轨道类型为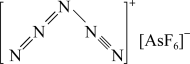
 与EDTA形成的螯合物的结构如图所示,1个该配合物中通过螯合作用形成的配位键有
与EDTA形成的螯合物的结构如图所示,1个该配合物中通过螯合作用形成的配位键有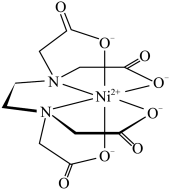

 ,则C点的原子坐标参数为
,则C点的原子坐标参数为②已知晶胞参数
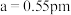 ,则该晶体的密度为
,则该晶体的密度为 (用
(用 表示阿伏加德罗常数,只列出计算表达式即可。)
表示阿伏加德罗常数,只列出计算表达式即可。)
您最近一年使用:0次
名校
解题方法
2 . 由 、
、 、
、 、
、 等元素组成的新型材料有着广泛的用途,回答下列问题。
等元素组成的新型材料有着广泛的用途,回答下列问题。
(1)与 相邻的铜基态原子核外电子排布式是
相邻的铜基态原子核外电子排布式是_________ , 、
、 、
、 的第一电离能由大到小顺序为
的第一电离能由大到小顺序为_________ 。
(2) 分子中的中心原子杂化轨道类型是
分子中的中心原子杂化轨道类型是_________ ,该分子构型为_________ 。
(3)已知 与
与 的晶体结构(如图1)相同,其中
的晶体结构(如图1)相同,其中 和
和 的离子半径分别为
的离子半径分别为 和
和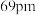 。则熔点:
。则熔点:
_________  (填“>”、“<”或“=”),理由是
(填“>”、“<”或“=”),理由是_________ 。

(4)若 晶胞中离子坐标参数
晶胞中离子坐标参数 为
为 ,
, 为
为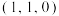 ,则
,则 离子坐标参数为
离子坐标参数为_________ 。
(5)若 晶胞边长为
晶胞边长为 ,试计算
,试计算 晶体的密度
晶体的密度_________  (列出计算式即可)。
(列出计算式即可)。
 、
、 、
、 、
、 等元素组成的新型材料有着广泛的用途,回答下列问题。
等元素组成的新型材料有着广泛的用途,回答下列问题。(1)与
 相邻的铜基态原子核外电子排布式是
相邻的铜基态原子核外电子排布式是 、
、 、
、 的第一电离能由大到小顺序为
的第一电离能由大到小顺序为(2)
 分子中的中心原子杂化轨道类型是
分子中的中心原子杂化轨道类型是(3)已知
 与
与 的晶体结构(如图1)相同,其中
的晶体结构(如图1)相同,其中 和
和 的离子半径分别为
的离子半径分别为 和
和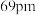 。则熔点:
。则熔点:
 (填“>”、“<”或“=”),理由是
(填“>”、“<”或“=”),理由是
(4)若
 晶胞中离子坐标参数
晶胞中离子坐标参数 为
为 ,
, 为
为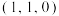 ,则
,则 离子坐标参数为
离子坐标参数为(5)若
 晶胞边长为
晶胞边长为 ,试计算
,试计算 晶体的密度
晶体的密度 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
名校
解题方法
3 . 碳族元素及其化合物在国家工业领域有非常重要用途。回答下列问题:
(1)基态锗原子价层电子排布式为_______ 。
(2)干冰晶胞如图,顶点和面心是 分子。在干冰晶体中每个
分子。在干冰晶体中每个  分子周围有
分子周围有_______ 个  分子相邻。
分子相邻。
(3)关于C、Si及其化合物的结构和性质, 下列叙述正确的是_______
(4) 中碳原子的杂化轨道类型有
中碳原子的杂化轨道类型有_______ 。
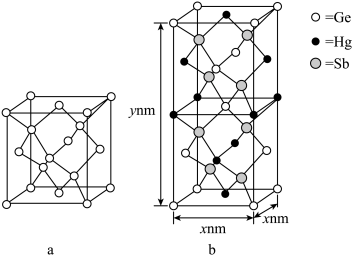
(5)理论计算预测, 由汞(Hg) 、锗 (Ge) 、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图 a 所示)中部分Ge原子被Hg和Sb取代后形成,设X的最简式的式量Mr, 则X晶体的密度为_______  (列出计算式)。
(列出计算式)。
(1)基态锗原子价层电子排布式为
(2)干冰晶胞如图,顶点和面心是
 分子。在干冰晶体中每个
分子。在干冰晶体中每个  分子周围有
分子周围有 分子相邻。
分子相邻。
(3)关于C、Si及其化合物的结构和性质, 下列叙述正确的是_______
| A.分子稳定性: C2H6<Si2H6 |
B. 是原子晶体, 硬度:SiC>C(金刚石) 是原子晶体, 硬度:SiC>C(金刚石) |
| C.还原性: SiH4<CH4 |
D.Si的原子半径大于C原子半径, 难以形成 键 键 |
 中碳原子的杂化轨道类型有
中碳原子的杂化轨道类型有(5)理论计算预测, 由汞(Hg) 、锗 (Ge) 、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图 a 所示)中部分Ge原子被Hg和Sb取代后形成,设X的最简式的式量Mr, 则X晶体的密度为
 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
名校
4 . 铜及其化合物在科学研究和工农业生产中有许多用途。回答下列问题:
(1) 溶液可以吸收合成氨中对催化剂有毒害的CO气体[醋酸根(
溶液可以吸收合成氨中对催化剂有毒害的CO气体[醋酸根( )简写成
)简写成 ],反应的化学方程式为:
],反应的化学方程式为: 。
。
①基态 的核外电子排布式为
的核外电子排布式为___________ 。
② 中C原子的杂化轨道类型为
中C原子的杂化轨道类型为___________ 。
③ 中所含非金属元素的电负性由大到小的顺序是
中所含非金属元素的电负性由大到小的顺序是___________ (用元素符号表示)。
④ 中N原子形成的H—N—H键角
中N原子形成的H—N—H键角___________ (填“大于”“小于”或“等于”)气态 中的键角,原因是
中的键角,原因是___________ 。
⑤1个 中含有的共价键数为
中含有的共价键数为___________ 。
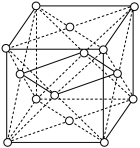
(2)Cu—Mn—Al合金为磁性形状记忆合金材料之一,其晶胞结构如图所示:

①合金的化学式为___________ 。
②若A原子的坐标参数为(0,1,0),则B原子的坐标参数为___________ 。
③已知该合金晶体的边长为a cm,则最近的两个Al原子间的距离为___________ nm
(1)
 溶液可以吸收合成氨中对催化剂有毒害的CO气体[醋酸根(
溶液可以吸收合成氨中对催化剂有毒害的CO气体[醋酸根( )简写成
)简写成 ],反应的化学方程式为:
],反应的化学方程式为: 。
。①基态
 的核外电子排布式为
的核外电子排布式为②
 中C原子的杂化轨道类型为
中C原子的杂化轨道类型为③
 中所含非金属元素的电负性由大到小的顺序是
中所含非金属元素的电负性由大到小的顺序是④
 中N原子形成的H—N—H键角
中N原子形成的H—N—H键角 中的键角,原因是
中的键角,原因是⑤1个
 中含有的共价键数为
中含有的共价键数为(2)Cu—Mn—Al合金为磁性形状记忆合金材料之一,其晶胞结构如图所示:

①合金的化学式为
②若A原子的坐标参数为(0,1,0),则B原子的坐标参数为
③已知该合金晶体的边长为a cm,则最近的两个Al原子间的距离为
您最近一年使用:0次
名校
5 . 铜及其化合物在科学研究和工业生产中具有许多用途,请回答下列问题:
(1)画出基态Cu原子的价电子排布式_______ 。
(2)已知高温下 比CuO稳定,从核外电子排布角度解释高温下
比CuO稳定,从核外电子排布角度解释高温下 更稳定的原因
更稳定的原因_______ 。
(3)配合物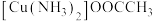 中碳原子的杂化类型是
中碳原子的杂化类型是_______ ,配体的空间构型为_______ 。C、N、O三元素的第一电离能由大到小的顺序是_______ (用元素符号表示)。
(4)M原子的价电子排布式为 ,铜与M形成化合物的晶胞如图所示(白球代表铜原子)。
,铜与M形成化合物的晶胞如图所示(白球代表铜原子)。
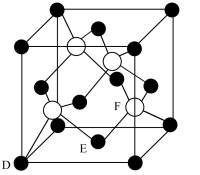
①该晶体的化学式为_______ 。
②原子坐标参数,表示晶胞内部个原子的相对位置。上图晶胞中,其中原子坐标参数D为(0,0,0);E为 。则F原子的坐标参数为
。则F原子的坐标参数为_______ 。
③已知该晶体的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体中Cu原子和M原子之间的最短距离为
,则该晶体中Cu原子和M原子之间的最短距离为_______ pm(写出计算式)。
(1)画出基态Cu原子的价电子排布式
(2)已知高温下
 比CuO稳定,从核外电子排布角度解释高温下
比CuO稳定,从核外电子排布角度解释高温下 更稳定的原因
更稳定的原因(3)配合物
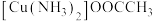 中碳原子的杂化类型是
中碳原子的杂化类型是(4)M原子的价电子排布式为
 ,铜与M形成化合物的晶胞如图所示(白球代表铜原子)。
,铜与M形成化合物的晶胞如图所示(白球代表铜原子)。
①该晶体的化学式为
②原子坐标参数,表示晶胞内部个原子的相对位置。上图晶胞中,其中原子坐标参数D为(0,0,0);E为
 。则F原子的坐标参数为
。则F原子的坐标参数为③已知该晶体的密度为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体中Cu原子和M原子之间的最短距离为
,则该晶体中Cu原子和M原子之间的最短距离为
您最近一年使用:0次
2022-08-27更新
|
147次组卷
|
2卷引用:黑龙江省绥化市第九中学2021-2022学年高二下学期期末考试化学试题
6 . 铜及其化合物有许多特殊用途,最近科研人员用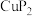 作电极电催化
作电极电催化 ,
, 经甲酸盐、乙醛最终转化为1-丁醇,铜则转化为
经甲酸盐、乙醛最终转化为1-丁醇,铜则转化为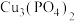 和
和 。回答下列问题:。
。回答下列问题:。
(1)基态磷原子的价电子排布图为_______ ,基态Cu原子电子占据最高能级的电子云轮廓图为_______ 形。
(2)Cu、O、P三种元素中,电负性由大到小的顺序为_______ 。
(3) 的空间构型为
的空间构型为_______ ,其中P采取_______ 杂化方式。
(4)1-丁醇、1-氯丁烷的沸点依次为118℃、78.2℃,前者沸点较高的原因是_______ 。
(5)Cu、Mn、Al形成的一种金属间化合物的晶体结构如图所示。已知晶胞参数为apm,内部正方形的边长为bpm,NA表示阿伏加德罗常数。

该晶体的密度为_______ (用含a、NA的代数式表示,不用化简);P、Q间的距离为_______ pm(要求同上)。
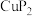 作电极电催化
作电极电催化 ,
, 经甲酸盐、乙醛最终转化为1-丁醇,铜则转化为
经甲酸盐、乙醛最终转化为1-丁醇,铜则转化为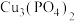 和
和 。回答下列问题:。
。回答下列问题:。(1)基态磷原子的价电子排布图为
(2)Cu、O、P三种元素中,电负性由大到小的顺序为
(3)
 的空间构型为
的空间构型为(4)1-丁醇、1-氯丁烷的沸点依次为118℃、78.2℃,前者沸点较高的原因是
(5)Cu、Mn、Al形成的一种金属间化合物的晶体结构如图所示。已知晶胞参数为apm,内部正方形的边长为bpm,NA表示阿伏加德罗常数。

该晶体的密度为
您最近一年使用:0次
名校
解题方法
7 . VA族元素及其化合物在生产、生活中用途广泛。
(1)P4S3常用于制造火柴,P和S的第一电离能较大的是____ (填元素符号)。
(2)As4S4俗称雄黄,其中基态As原子的价电子排布式为____ ,有____ 个未成对电子。
(3)研究发现固态PCl5和PBr5均为离子晶体,但其结构不同,分别为[PCl4]+[PCl6]-和[PBr4]+Br-,分析PCl5和PBr5结构存在差异的主要原因是____ 。
(4)汽车尾气催化剂可将NO2还原为无毒害的气体,防止HNO3型酸雨的形成,NO2的空间构型为____ ,从结构的角度说明HNO3的酸性强于HNO2的原因:____ 。
(5)CrCl3能与H2O、NH3形成配位数为6的配合物,且相应两种配体的物质的量之比为2∶1,lmol该配合物溶于水,加入足量的硝酸银溶液,可得430.5g白色沉淀,则该配合物的化学式为____ 。(Cr的相对原子质量为52)
(6)贵金属磷化物Rh2P(化学式式量为237)可用作电解水的高效催化剂,其立方晶胞如图所示。已知晶胞边长为apm,晶体中与P距离最近的Rh的数目为____ ,晶体的密度为____ g·cm-3(列出计算式)。

(1)P4S3常用于制造火柴,P和S的第一电离能较大的是
(2)As4S4俗称雄黄,其中基态As原子的价电子排布式为
(3)研究发现固态PCl5和PBr5均为离子晶体,但其结构不同,分别为[PCl4]+[PCl6]-和[PBr4]+Br-,分析PCl5和PBr5结构存在差异的主要原因是
(4)汽车尾气催化剂可将NO2还原为无毒害的气体,防止HNO3型酸雨的形成,NO2的空间构型为
(5)CrCl3能与H2O、NH3形成配位数为6的配合物,且相应两种配体的物质的量之比为2∶1,lmol该配合物溶于水,加入足量的硝酸银溶液,可得430.5g白色沉淀,则该配合物的化学式为
(6)贵金属磷化物Rh2P(化学式式量为237)可用作电解水的高效催化剂,其立方晶胞如图所示。已知晶胞边长为apm,晶体中与P距离最近的Rh的数目为

您最近一年使用:0次
名校
解题方法
8 . 氮的相关化合物在材料等方面有重要用途。回答下列问题:
(1)基态N原子的核外电子排布式为_______ ,第一电离能
_______  (填“大于”或“小于)。
(填“大于”或“小于)。
(2)①N及其同族的P、As均可形成类似的氢化物, 的沸点由高到低的顺序为
的沸点由高到低的顺序为_______ (填化学式)。
② 的键角
的键角_______ 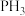 的键角(填“大于”或“小于),原因为
的键角(填“大于”或“小于),原因为_______ 。
(3)写出 溶于氨水形成配合物的离子方程式
溶于氨水形成配合物的离子方程式_______ 。
(4) 是一种全氮阳离子形成的高能物质,其阳离子结构如图所示,其中N原子的杂化轨道类型为
是一种全氮阳离子形成的高能物质,其阳离子结构如图所示,其中N原子的杂化轨道类型为_______ 。

(5)科学家近期首次合成了具有极性对称性的氮化物钙钛矿材料-LaWN₃,其立方晶胞结构如图所示,晶胞中La、W、N分别处于顶角、体心、面心位置,晶胞参数为a nm。

①与La紧邻的N个数为_______ 。
②在 ,晶胞结构的另一种表示中,W处于各顶角位置,则在新的晶胞中,La处于
,晶胞结构的另一种表示中,W处于各顶角位置,则在新的晶胞中,La处于_______ 位置,N处于_______ 位置。
③设La、W、N的式量分别为 阿伏加德罗常数的值为
阿伏加德罗常数的值为 则该晶体的密度为
则该晶体的密度为_______  (列出计算表达式)。
(列出计算表达式)。
(1)基态N原子的核外电子排布式为

 (填“大于”或“小于)。
(填“大于”或“小于)。(2)①N及其同族的P、As均可形成类似的氢化物,
 的沸点由高到低的顺序为
的沸点由高到低的顺序为②
 的键角
的键角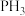 的键角(填“大于”或“小于),原因为
的键角(填“大于”或“小于),原因为(3)写出
 溶于氨水形成配合物的离子方程式
溶于氨水形成配合物的离子方程式(4)
 是一种全氮阳离子形成的高能物质,其阳离子结构如图所示,其中N原子的杂化轨道类型为
是一种全氮阳离子形成的高能物质,其阳离子结构如图所示,其中N原子的杂化轨道类型为
(5)科学家近期首次合成了具有极性对称性的氮化物钙钛矿材料-LaWN₃,其立方晶胞结构如图所示,晶胞中La、W、N分别处于顶角、体心、面心位置,晶胞参数为a nm。

①与La紧邻的N个数为
②在
 ,晶胞结构的另一种表示中,W处于各顶角位置,则在新的晶胞中,La处于
,晶胞结构的另一种表示中,W处于各顶角位置,则在新的晶胞中,La处于③设La、W、N的式量分别为
 阿伏加德罗常数的值为
阿伏加德罗常数的值为 则该晶体的密度为
则该晶体的密度为 (列出计算表达式)。
(列出计算表达式)。
您最近一年使用:0次
名校
解题方法
9 . 碳族元素及其化合物在国家工业领域有非常重要用途。回答下列问题:
(1)基态锗原子价层电子排布式为_______ 。
(2)我国提出力争在2030年前实现碳达峰、2060年前实现碳中和,我国科学家研发的“液态阳光”项目利用了太阳能产生的电能电解水制氢,再选择高效催化剂将二氧化碳加氢合成甲醇等液体燃料,这将为实现碳达峰、碳中和提供了科学的方法,其中CO2分子中有_______ σ键和_______ π键,在干冰晶体中每个CO2分子周围有_______ 个CO2分子相邻。

(3)关于C、Si及其化合物的结构和性质,下列叙述正确的是_______(填序号)。
(4) 中碳原子的杂化轨道类型有
中碳原子的杂化轨道类型有_______ 。
(5)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成。

①b为X的晶胞,该晶胞中粒子个数比Hg:Ge:Sb=_______ 。
②设X的最简式的式量为Mr,则X晶体的密度为_______ g/cm3(列出计算式)。
(1)基态锗原子价层电子排布式为
(2)我国提出力争在2030年前实现碳达峰、2060年前实现碳中和,我国科学家研发的“液态阳光”项目利用了太阳能产生的电能电解水制氢,再选择高效催化剂将二氧化碳加氢合成甲醇等液体燃料,这将为实现碳达峰、碳中和提供了科学的方法,其中CO2分子中有

(3)关于C、Si及其化合物的结构和性质,下列叙述正确的是_______(填序号)。
| A.分子稳定性:C2H6<Si2H6 |
| B.SiC是原子晶体,硬度:SiC>C(金刚石) |
| C.还原性:SiH4<CH4 |
| D.Si的原子半径大于C原子半径,难以形成π键 |
 中碳原子的杂化轨道类型有
中碳原子的杂化轨道类型有(5)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成。

①b为X的晶胞,该晶胞中粒子个数比Hg:Ge:Sb=
②设X的最简式的式量为Mr,则X晶体的密度为
您最近一年使用:0次
2022-06-06更新
|
320次组卷
|
2卷引用:黑龙江省牡丹江市第二高级中学2022-2023学年高三上学期第二次阶段测试化学试题
名校
10 . 氮(N)、磷(P)、砷(As)等第VA族元素的化合物在研究和生产中有重要用途,请回答下列问题:
(1)第三周期元素的原子中,第一电离能大于磷原子的有_______ 种。
(2)氮族元素氢化物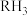 (
( 、
、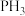 、
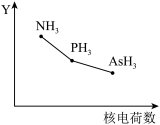
、 )的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的氢化物(
)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的氢化物(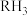 )性质可能为_______(填序号)。
)性质可能为_______(填序号)。
(3)经测定发现,某种 固体由
固体由 和
和 两种离子组成,阳离子中N原子的杂化方式是
两种离子组成,阳离子中N原子的杂化方式是_______ 杂化,阴离子的空间构型为_______ 。
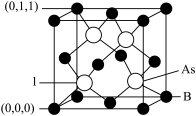
(4)超高热导率半导体材料——砷化硼(BAs)的晶胞结构如下图所示,已知阿伏加德罗常数的值为 ,若晶胞参数为a pm,则该晶体的密度为
,若晶胞参数为a pm,则该晶体的密度为_______ 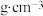 (列出含a、
(列出含a、 的计算式即可)。
的计算式即可)。
(1)第三周期元素的原子中,第一电离能大于磷原子的有
(2)氮族元素氢化物
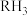 (
( 、
、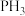 、
、 )的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的氢化物(
)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的氢化物(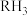 )性质可能为_______(填序号)。
)性质可能为_______(填序号)。
| A.稳定性 | B.沸点 | C.分子间作用力 | D.还原性 |
 固体由
固体由 和
和 两种离子组成,阳离子中N原子的杂化方式是
两种离子组成,阳离子中N原子的杂化方式是(4)超高热导率半导体材料——砷化硼(BAs)的晶胞结构如下图所示,已知阿伏加德罗常数的值为
 ,若晶胞参数为a pm,则该晶体的密度为
,若晶胞参数为a pm,则该晶体的密度为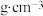 (列出含a、
(列出含a、 的计算式即可)。
的计算式即可)。
您最近一年使用:0次



