1 . 钒、钨、锌在工业上用途广泛。
(1)基态钒(V)元素在周期表中的位置为_______ ,其最高化合价为_______ ,与其同周期且未成对电子数相同的元素符号为_______ ;
(2)钒能形成多种配合物。钒的两种配合物X、Y化学式均为V(NH3)3ClSO4,取X、Y的溶液进行如下实验(已知配体难电离出来),所用试剂及所得现象如表所示:
则X的配离子为_______ ,Y的配体为_______ 。
(3)NaxWO3是一类色彩丰富的非整比化合物,其晶体结构如图2所示,若Na+无空缺,化学式为NaWO3,完全空缺则为WO3,每填入1个Na+,相应有1个W6+还原为W5+。NaxWO3的颜色与x值的对应关系如图1所示,已知NaxWO3晶体中n(W6+):n(W5+)=2:3,则其颜色为_______ 色。

(4)如图3是金属钨晶体中的一个晶胞的结构模型(原子间实际是相互接触的)。其中心的原子位于立方体的体心。实验测得金属钨的半径为rcm,假定金属钨为等直径的刚性球,请回答以下各题:

①每一个晶胞中分摊到_______ 个钨原子。
②计算晶胞的空间利用率_______ (写出表达式,不计算具体数值)。
(1)基态钒(V)元素在周期表中的位置为
(2)钒能形成多种配合物。钒的两种配合物X、Y化学式均为V(NH3)3ClSO4,取X、Y的溶液进行如下实验(已知配体难电离出来),所用试剂及所得现象如表所示:
| 原溶液 | X溶液 | X溶液 | Y溶液 | Y溶液 |
| 所加试剂 | BaCl2溶液 | AgNO3溶液 | BaCl2溶液 | AgNO3溶液 |
| 现象 | 白色沉淀 | 无明显变化 | 无明显变化 | 白色沉淀 |
则X的配离子为
(3)NaxWO3是一类色彩丰富的非整比化合物,其晶体结构如图2所示,若Na+无空缺,化学式为NaWO3,完全空缺则为WO3,每填入1个Na+,相应有1个W6+还原为W5+。NaxWO3的颜色与x值的对应关系如图1所示,已知NaxWO3晶体中n(W6+):n(W5+)=2:3,则其颜色为

(4)如图3是金属钨晶体中的一个晶胞的结构模型(原子间实际是相互接触的)。其中心的原子位于立方体的体心。实验测得金属钨的半径为rcm,假定金属钨为等直径的刚性球,请回答以下各题:

①每一个晶胞中分摊到
②计算晶胞的空间利用率
您最近一年使用:0次
名校
解题方法
2 . 硼元素从发现之初就有着重要用途,古埃及制造玻璃使用硼砂作溶剂,古代炼丹家也使用过硼砂。晶态硼的熔沸点高、硬度大。工业上可用碱法制备单质硼,制备流程如下:

(1)B在元素周期表中的位置是_______ 。 是有机化学中的常用试剂,其电子式为
是有机化学中的常用试剂,其电子式为_______ 。
(2)滤渣1是_______ (填化学式),通入 的目的是
的目的是_______ 。
(3)以 和Mg为原料制备硼单质,用化学反应方程式表示其制备过程:
和Mg为原料制备硼单质,用化学反应方程式表示其制备过程:_______ 。
(4) 是潜在的储氢材料,为白色晶体,稳定无毒。
是潜在的储氢材料,为白色晶体,稳定无毒。
① 在催化剂作用下与水反应释放氢气,另一产物的阴离子
在催化剂作用下与水反应释放氢气,另一产物的阴离子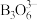 具有环状结构,写出
具有环状结构,写出 与水反应的化学方程式:
与水反应的化学方程式:_______ 。
②熔化
 可缓慢释放2g氢气,并转变为化合物A;A在高于500℃时释放氢气,转变为BN。A不稳定,容易形成聚合物,请写出聚合物的结构式:
可缓慢释放2g氢气,并转变为化合物A;A在高于500℃时释放氢气,转变为BN。A不稳定,容易形成聚合物,请写出聚合物的结构式:_______ 。
(5)氮化硼(BN)有多种晶形。它可以和碳一样形成与石墨相似的平面六边形的层状结构,如题图1,层中 共价键的键长比
共价键的键长比 单键的键长短,其原因是
单键的键长短,其原因是_______ 。

(6)已知立方氮化硼晶胞(图2)边长为apm,阿伏加德罗常数的值为 ,则晶体的密度为
,则晶体的密度为_______  。
。


(1)B在元素周期表中的位置是
 是有机化学中的常用试剂,其电子式为
是有机化学中的常用试剂,其电子式为(2)滤渣1是
 的目的是
的目的是(3)以
 和Mg为原料制备硼单质,用化学反应方程式表示其制备过程:
和Mg为原料制备硼单质,用化学反应方程式表示其制备过程:(4)
 是潜在的储氢材料,为白色晶体,稳定无毒。
是潜在的储氢材料,为白色晶体,稳定无毒。①
 在催化剂作用下与水反应释放氢气,另一产物的阴离子
在催化剂作用下与水反应释放氢气,另一产物的阴离子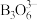 具有环状结构,写出
具有环状结构,写出 与水反应的化学方程式:
与水反应的化学方程式:②熔化
 可缓慢释放2g氢气,并转变为化合物A;A在高于500℃时释放氢气,转变为BN。A不稳定,容易形成聚合物,请写出聚合物的结构式:
可缓慢释放2g氢气,并转变为化合物A;A在高于500℃时释放氢气,转变为BN。A不稳定,容易形成聚合物,请写出聚合物的结构式:(5)氮化硼(BN)有多种晶形。它可以和碳一样形成与石墨相似的平面六边形的层状结构,如题图1,层中
 共价键的键长比
共价键的键长比 单键的键长短,其原因是
单键的键长短,其原因是
(6)已知立方氮化硼晶胞(图2)边长为apm,阿伏加德罗常数的值为
 ,则晶体的密度为
,则晶体的密度为 。
。
您最近一年使用:0次
2022-12-03更新
|
262次组卷
|
2卷引用:重庆市南开中学校2022-2023学年高三上学期第四次月考化学试题
名校
3 . 氮元素在农药生产及工业制造业等领域用途非常广泛。回答下列问题:
(1)NH3是重要的配体,其中H—N—H的键角为107.3°。
①NH3分子的VSEPR模型为___________ 。
②[Cu(NH3)4]2+中H—N—H的键角_____ 107.3°(填“大于”“小于”或“等于”)。
③甲基胺离子(CH3NH3+)的电子式为______________ 。
(2)已知氨在一定条件下可形成一种立方晶系,其立方晶胞沿x、y或z轴投影图均如图所示。已知晶胞的棱长为a pm,则该晶体的密度为______ g/cm3。(写出数学表达式,设NA为阿伏加德罗常数的值)。

(3)CO和H2可以合成简单有机物,已知CO、H2合成CH3OH、HCOOCH3的能量变化如图所示,计算:2CH3OH(g) HCOOCH3(g)+2H2(g) △H=
HCOOCH3(g)+2H2(g) △H=_____ 。

已知键能数据如下表,则C≡O的键能为__________ kJ•mol-1。
(4)利用电解原理,可将氨气转化为高纯氢气,其装置如图所示。
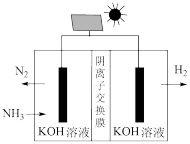
电解过程中OH—的移动方向为____ (填“从左往右”或“从右往左”);阳极的电极反应式为______________ 。
(1)NH3是重要的配体,其中H—N—H的键角为107.3°。
①NH3分子的VSEPR模型为
②[Cu(NH3)4]2+中H—N—H的键角
③甲基胺离子(CH3NH3+)的电子式为
(2)已知氨在一定条件下可形成一种立方晶系,其立方晶胞沿x、y或z轴投影图均如图所示。已知晶胞的棱长为a pm,则该晶体的密度为

(3)CO和H2可以合成简单有机物,已知CO、H2合成CH3OH、HCOOCH3的能量变化如图所示,计算:2CH3OH(g)
 HCOOCH3(g)+2H2(g) △H=
HCOOCH3(g)+2H2(g) △H=
已知键能数据如下表,则C≡O的键能为
化学键 | H-H | C-O | C≡O | H-O | C-H |
键能/(kJ•mol-1) | 436 | 326 | A | 464 | 414 |

电解过程中OH—的移动方向为
您最近一年使用:0次
名校
解题方法
4 . 铜及其化合物在科学研究和工农业生产中有许多用途。回答下列问题:
(1)[Cu(NH3)2]SO4溶液可以吸收合成氨中对催化剂有毒害的CO气体,反应的化学方程式为:[Cu(NH3)2]SO4+CO+NH3⇌[Cu(NH3)3CO]SO4
①基态Cu+的价层电子排布图为_______ 。
② 的空间结构为
的空间结构为_______ 。
③N、O和S的第一电离能由大到小的顺序是_______ (用元素符号表示)。
④[Cu(NH3)3CO]SO4晶体中存在的化学键类型有_______ (填字母)。
A.离子键 B.极性共价键 C.非极性共价键 D.氢键 E.配位键 F.π键
(2)Cu—Mn—Al合金为磁性形状记忆合金材料之一,其晶胞结构如图所示:
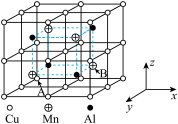
①该合金的化学式为_______ 。
②若A原子的坐标参数为(0,0,0),则B原子的坐标参数为_______ 。
③已知该合金晶体的密度为ρ g·cm-3,则最近的两个Cu原子间的距离为_______ nm(阿伏加德罗常数的值用NA表示)。
(1)[Cu(NH3)2]SO4溶液可以吸收合成氨中对催化剂有毒害的CO气体,反应的化学方程式为:[Cu(NH3)2]SO4+CO+NH3⇌[Cu(NH3)3CO]SO4
①基态Cu+的价层电子排布图为
②
 的空间结构为
的空间结构为③N、O和S的第一电离能由大到小的顺序是
④[Cu(NH3)3CO]SO4晶体中存在的化学键类型有
A.离子键 B.极性共价键 C.非极性共价键 D.氢键 E.配位键 F.π键
(2)Cu—Mn—Al合金为磁性形状记忆合金材料之一,其晶胞结构如图所示:

①该合金的化学式为
②若A原子的坐标参数为(0,0,0),则B原子的坐标参数为
③已知该合金晶体的密度为ρ g·cm-3,则最近的两个Cu原子间的距离为
您最近一年使用:0次
名校
5 . 某物质用途非常广泛,可用来制造耐火陶瓷,作颜料,还可以用于冶炼金属。其具有的长方体形晶胞结构可用下图表示,已知6个N原子形成了正八面体,晶胞参数的单位为pm,M原子的相对原子质量为m,N原子的相对原子质量为n。下列说法错误的是
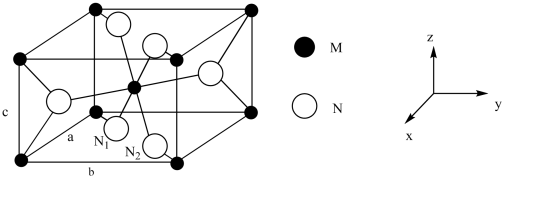

A.该物质的化学式可能为 |
B.该晶胞密度为 |
| C.M原子的配位数为6,N原子的配位数为3 |
D.若 原子的坐标为(x,x,0),则 原子的坐标为(x,x,0),则 原子的分数坐标为(1-x,1-x,0) 原子的分数坐标为(1-x,1-x,0) |
您最近一年使用:0次
名校
解题方法
6 . Ⅰ、由CO2、甲醇为原料合成绿色化学品碳酸二甲酯(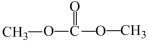 )的过程如图,请回答下列问题:
)的过程如图,请回答下列问题:
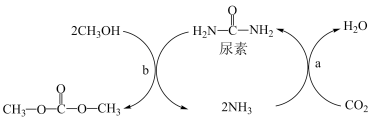
(1)下列说法不正确的是___________ (填字母)。
A.上述过程a中,从反应物到产物,C和N元素的杂化方式均保持不变
B.NH3极易溶解在水中,只因氨分子与水分子间形成了氢键
C.尿素的沸点比碳酸二甲酯的高,主要原因为前者能形成分子间氢键,而后者不能形成分子间氢键
Ⅱ、硫元素在化合物中常表现出多种化合价,它的许多化合物在研究和生产中有许多重要用途。回答下列问题:
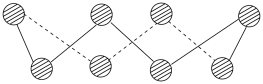
(2)S单质的常见形式为S8,其环状结构如图所示,S原子的杂化轨道类型是___________ 。
(3) 的电子式是
的电子式是___________ ,依据 理论推测
理论推测 的空间构型为
的空间构型为___________ ,常温下 是气体而
是气体而 是液体的原因是
是液体的原因是___________ 。
(4) 的键角
的键角___________  的键角(填“大于”或“小于”),理由是
的键角(填“大于”或“小于”),理由是___________ 。
(5) 在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方
在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方 晶体结构如图所示。
晶体结构如图所示。
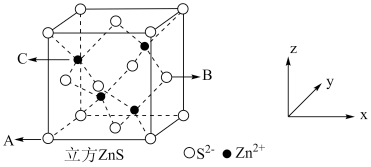
①已知A、B点的原子坐标分别为 和
和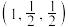 ,则C点的原子坐标为
,则C点的原子坐标为___________ ;
②若晶胞棱长为 ,密度为
,密度为___________  (
( 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
 )的过程如图,请回答下列问题:
)的过程如图,请回答下列问题:
(1)下列说法不正确的是
A.上述过程a中,从反应物到产物,C和N元素的杂化方式均保持不变
B.NH3极易溶解在水中,只因氨分子与水分子间形成了氢键
C.尿素的沸点比碳酸二甲酯的高,主要原因为前者能形成分子间氢键,而后者不能形成分子间氢键
Ⅱ、硫元素在化合物中常表现出多种化合价,它的许多化合物在研究和生产中有许多重要用途。回答下列问题:
(2)S单质的常见形式为S8,其环状结构如图所示,S原子的杂化轨道类型是

(3)
 的电子式是
的电子式是 理论推测
理论推测 的空间构型为
的空间构型为 是气体而
是气体而 是液体的原因是
是液体的原因是(4)
 的键角
的键角 的键角(填“大于”或“小于”),理由是
的键角(填“大于”或“小于”),理由是(5)
 在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方
在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方 晶体结构如图所示。
晶体结构如图所示。
①已知A、B点的原子坐标分别为
 和
和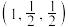 ,则C点的原子坐标为
,则C点的原子坐标为②若晶胞棱长为
 ,密度为
,密度为 (
( 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
您最近一年使用:0次
2022-09-05更新
|
351次组卷
|
6卷引用:重庆市育才中学校2023届高三上学期开学测试化学试题
7 . 镓及其化合物在合金工业、制药工业、电池工业有广泛的应用。回答下列问题:
(1)基态Ga原子的价层电子排布式为_______ 。
(2)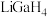 是一种温和的还原剂,其可由
是一种温和的还原剂,其可由 和过量的LiH反应制得:
和过量的LiH反应制得: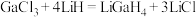 。
。
①已知 的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为
的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为_______ 。
② 在270℃左右以二聚物存在,该二聚物的每个原子都满足8电子稳定结构,写出它的结构式:
在270℃左右以二聚物存在,该二聚物的每个原子都满足8电子稳定结构,写出它的结构式:_______ 。
③ 的立体构型为
的立体构型为_______ 。
(3)一种含镓的药物合成方法如图所示:_______ ,1 mol化合物I中含有的 键的物质的量为
键的物质的量为_______ 。化合物Ⅰ中所含元素的电负性由大到小的顺序为_______ (用元素符号表示)。
②化合物Ⅱ中Ga的配位数为_______ ,x=_______ 。
(4)Ga、Li和O三种原子形成的一种晶体基片在二极管中有重要用途。其四方晶胞结构如图所示:_______ (填选项字母)。 表示阿伏加德罗常数的值,晶胞参数为
表示阿伏加德罗常数的值,晶胞参数为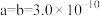 m,
m,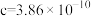 m,则其密度为
m,则其密度为_______  (列出计算式即可)。
(列出计算式即可)。
(1)基态Ga原子的价层电子排布式为
(2)
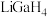 是一种温和的还原剂,其可由
是一种温和的还原剂,其可由 和过量的LiH反应制得:
和过量的LiH反应制得: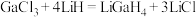 。
。①已知
 的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为
的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为②
 在270℃左右以二聚物存在,该二聚物的每个原子都满足8电子稳定结构,写出它的结构式:
在270℃左右以二聚物存在,该二聚物的每个原子都满足8电子稳定结构,写出它的结构式:③
 的立体构型为
的立体构型为(3)一种含镓的药物合成方法如图所示:

 键的物质的量为
键的物质的量为②化合物Ⅱ中Ga的配位数为
(4)Ga、Li和O三种原子形成的一种晶体基片在二极管中有重要用途。其四方晶胞结构如图所示:

A. B.
B.  C.
C. 
 表示阿伏加德罗常数的值,晶胞参数为
表示阿伏加德罗常数的值,晶胞参数为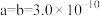 m,
m,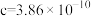 m,则其密度为
m,则其密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
2023-02-27更新
|
957次组卷
|
5卷引用:2022年重庆高考真题化学试题变式题(结构与性质)
(已下线)2022年重庆高考真题化学试题变式题(结构与性质)广东省广州市等3地东莞市东华松山湖高级中学有限公司等2校2023届高三下学期一模化学试题(已下线)专题20 结构与性质(已下线)结构与性质陕西省商洛市2023-2024学年高三下学期第四次模拟考试理综试题-高中化学
名校
解题方法
8 . 氨、磷、铁、钴等元素的化合物在现代农业、科技、国防建设中有着许多独特的用途。
(1)N2H4是一种良好的火箭发射燃料,熔点、沸点分别为1.4℃、113.5℃。N2H4中氮原子的杂化轨道类型为___ ,N2H4沸点较高的主要原因是___ 。
(2) 的一种结构如图1所示,氢原子只有一种化学环境,氨原子有两种化学环境,其中的大π键可表示为
的一种结构如图1所示,氢原子只有一种化学环境,氨原子有两种化学环境,其中的大π键可表示为___ (已知苯中的大Π键可表示为Π )。
)。

(3)磷原子在成键时,能将一个3s电子激发进入3d能级而参加成键,写出该激发态磷原子的核外电子排布式____ 。
(4)铁、钴与CN-、CO,NH3易形成配合物Fe(CO)5、Fe(CN) 、Co(CN)
、Co(CN) 和[Co(NH3)4]3+等。铁、钴位于周期表的
和[Co(NH3)4]3+等。铁、钴位于周期表的___ 区,CN-的电子式为___ ,N、C、O的第一电离能由大到小的顺序为___ ,已知[Co(NH3)6]3+的几何构型为正八面体形,推测[CoCl2(NH3)4]+的空间结构有___ 种。
(5)Co可以形成六方晶系的CoO(OH),晶胞结构如图2所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子坐标.已知晶胞含对称中心,其中1号O原子的坐标为(0.6667,0.3333,0.1077),则2号O原子的坐标为____ 。设NA为阿伏加德罗常数的值,该晶体的密度为____ g/cm3(用代数式表示)。

(1)N2H4是一种良好的火箭发射燃料,熔点、沸点分别为1.4℃、113.5℃。N2H4中氮原子的杂化轨道类型为
(2)
 的一种结构如图1所示,氢原子只有一种化学环境,氨原子有两种化学环境,其中的大π键可表示为
的一种结构如图1所示,氢原子只有一种化学环境,氨原子有两种化学环境,其中的大π键可表示为 )。
)。
(3)磷原子在成键时,能将一个3s电子激发进入3d能级而参加成键,写出该激发态磷原子的核外电子排布式
(4)铁、钴与CN-、CO,NH3易形成配合物Fe(CO)5、Fe(CN)
 、Co(CN)
、Co(CN) 和[Co(NH3)4]3+等。铁、钴位于周期表的
和[Co(NH3)4]3+等。铁、钴位于周期表的(5)Co可以形成六方晶系的CoO(OH),晶胞结构如图2所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子坐标.已知晶胞含对称中心,其中1号O原子的坐标为(0.6667,0.3333,0.1077),则2号O原子的坐标为

您最近一年使用:0次
2022-03-20更新
|
386次组卷
|
4卷引用:重庆市2022届高三第七次质量检测化学试题
重庆市2022届高三第七次质量检测化学试题湖南省湘潭市湘乡市东山学校2022学年高三下学期期中考试化学试题(已下线)专题18 物质结构与性质(综合题)-三年(2020-2022)高考真题分项汇编湖南省常德市石门县第一中学2022届高三下学期月考化学试题
名校
解题方法
9 . 过渡金属在能源、环境、材料、生命科学等领域发挥着重要作用。
I.研究表明新冠病毒在铜表面存活时间最短,仅为4小时,铜被称为细菌病毒的“杀手”。
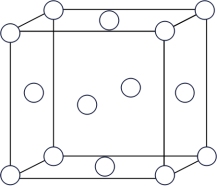
(1)铜的晶胞结构如图所示,与铜原子最近且等距离的铜原子有_______ 个。
(2)碱式硫酸铜(Cu2(OH)2SO4)是农药波尔多液的有效杀菌成分,其中非金属元素电负性由大到小的顺序是_______ ,阴离子SO 中心原子的价层电子对数目为
中心原子的价层电子对数目为_______ (列出计算式)。
II.铁是地球表面最丰富的金属之一,其合金、化合物具有广泛用途。
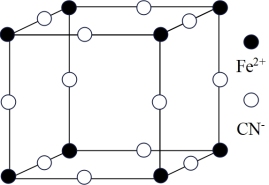
(3)普鲁士蓝俗称铁蓝,是含有铁元素的一种化合物,可以解铊中毒,结构如图所示(K+未画出),平均每两个立方体中含有一个K+,该晶体的化学式为_______ ,又知该晶体中铁元素有+2价和十3价两种,则Fe3+与Fe2+的个数比为_______ 。
III.TiO2-aNb是常见的光学活性物质。
(4)基态Ti原子的电子所占据的最高能层符号为_______ 。
(5)TiO2通过氮掺杂反应生成TiO2-aNb,表示如图。

①立方晶系TiO2晶胞参数如图甲所示,其晶体的密度为_______ g/cm3。
②图乙TiO2-aNb晶体中a=_______ 。
I.研究表明新冠病毒在铜表面存活时间最短,仅为4小时,铜被称为细菌病毒的“杀手”。
(1)铜的晶胞结构如图所示,与铜原子最近且等距离的铜原子有

(2)碱式硫酸铜(Cu2(OH)2SO4)是农药波尔多液的有效杀菌成分,其中非金属元素电负性由大到小的顺序是
 中心原子的价层电子对数目为
中心原子的价层电子对数目为II.铁是地球表面最丰富的金属之一,其合金、化合物具有广泛用途。
(3)普鲁士蓝俗称铁蓝,是含有铁元素的一种化合物,可以解铊中毒,结构如图所示(K+未画出),平均每两个立方体中含有一个K+,该晶体的化学式为

III.TiO2-aNb是常见的光学活性物质。
(4)基态Ti原子的电子所占据的最高能层符号为
(5)TiO2通过氮掺杂反应生成TiO2-aNb,表示如图。

①立方晶系TiO2晶胞参数如图甲所示,其晶体的密度为
②图乙TiO2-aNb晶体中a=
您最近一年使用:0次
名校
解题方法
10 . 2019年的化学诺贝尔奖颁给了为锂电池研究作出贡献的三位科学家,其研究的是两种常见锂电池:一种是采用镍钴锰酸锂Li(NiCoMn)O2或镍钴铝酸锂为正极的“三元材料锂电池”;另一种是采用磷酸铁锂(LiFePO4)为正极的电池。请回答下列问题:
(1)Mn位于元素周期表的_______ 区(填“s”或“p”或“d”或“ds”或“f”),基态钴原子的未成对电子数为_______ ,1mol [CoCl (NH3)5] Cl2 中含σ键数目为_______ NA。
(2)磷元素的最高价氧化物的水化物H3PO4在工业上有诸多特殊的用途,其中PO 的空间构型是
的空间构型是_______ ,中心原子的杂化方式是_______ 。
(3)PH3是_______ 分子(填“极性”或“非极性”),其在水中的溶解性比NH3小,原因是_______ 。
(4)硫化锂Li2S(摩尔质量M g∙mol-1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如图。若硫化锂晶体的密度为ρ g·cm-3,则距离最近的两个S2-的距离是_______ cm。(用含ρ、M、NA的计算式表示)
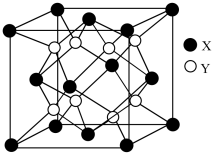
(1)Mn位于元素周期表的
(2)磷元素的最高价氧化物的水化物H3PO4在工业上有诸多特殊的用途,其中PO
 的空间构型是
的空间构型是(3)PH3是
(4)硫化锂Li2S(摩尔质量M g∙mol-1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如图。若硫化锂晶体的密度为ρ g·cm-3,则距离最近的两个S2-的距离是

您最近一年使用:0次



