解题方法
1 . Fe、Ni均为重要的元素,与C、N、O等组成的化合物有广泛的用途。回答下列问题:
(1)基态Fe原子的原子结构示意图为______ ,依据电子排布特点,铁属于元素周期表中______ 区元素。
(2)甘氨酸亚铁络合物[(H2NCH2COO)2Fe]是一种新型的铁营养强化剂。
①(H2NCH2COO)2Fe中含有的第二周期元素的第一电离能由大到小的顺序为______ 。
②甘氨酸(H2NCH2COOH)的沸点比相同相对分子质量的烷烃高很多,原因是_____ 。
(3)FeO、NiO的晶胞结构和NaCl相同。
①已知离子半径r(Fe2+)>r(Ni2+),则熔点FeO______ NiO(填“>”、“<”或“=”)。
②FeO晶胞如图,Fe2+的配位数为_____ 。

③FeO在氧气中加热,部分Fe2+被氧化为Fe3+。晶体结构产生铁离子缺位的缺陷,其组成变为FexO(x<1),测得晶胞边长为apm,密度为ρg•cm-3,则x=______ (填写计算表达式)。
(1)基态Fe原子的原子结构示意图为
(2)甘氨酸亚铁络合物[(H2NCH2COO)2Fe]是一种新型的铁营养强化剂。
①(H2NCH2COO)2Fe中含有的第二周期元素的第一电离能由大到小的顺序为
②甘氨酸(H2NCH2COOH)的沸点比相同相对分子质量的烷烃高很多,原因是
(3)FeO、NiO的晶胞结构和NaCl相同。
①已知离子半径r(Fe2+)>r(Ni2+),则熔点FeO
②FeO晶胞如图,Fe2+的配位数为

③FeO在氧气中加热,部分Fe2+被氧化为Fe3+。晶体结构产生铁离子缺位的缺陷,其组成变为FexO(x<1),测得晶胞边长为apm,密度为ρg•cm-3,则x=
您最近一年使用:0次
名校
2 . 铬、铁、钴、铜等金属及其化合物在工业上有重要用途。请回答:
(1)基态铬原子的价电子排布图为 (填序号)。
(2)CrO2Cl2和NaClO均可作化工生产的氧化剂或氯化剂。制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl +2CrO2Cl2+3COCl2↑。
①上述描述中涉及的非金属元素电负性由大到小的顺序是__________ (填序号)。
A.C>Cl>O B.C<Cl<O C.O>Cl>C D.C<O<Cl
②常温时CrO2Cl2是一种易溶于CCl4的液体,则固态CrO2Cl2属于_____ 晶体。
③配合物CrCl3·6H2O中心离子Cr3+的配位数为6,向含0.1molCrCl3·6H2O 的溶液中滴加2mol·L-1 AgNO3溶液,反应完全后共消耗AgNO3溶液50mL,则配合物的化学式应该写为__________ (填序号)。
A.[Cr(H2O)4Cl] Cl2·2H2O B.[Cr(H2O)4Cl2] Cl·2H2O
C.[Cr(H2O)4Cl2] Cl D.[Cr(H2O)3Cl3]·H2O
(3)Co3+与NO 形成的配合物与K+生成黄色沉淀可以检验溶液中的K+。
形成的配合物与K+生成黄色沉淀可以检验溶液中的K+。
①配体 的立体构型为
的立体构型为__________ (填序号)。
A. 三角锥形 B. 平面三角形 C.直线形 D.V形
② 的中心原子的杂化类型为
的中心原子的杂化类型为__________ (填序号)。
A. sp B. sp2 C.sp3 D.dsp2
③N原子中有_______ 种能量不同的电子。
(4)铁和氨气在640 ℃可发生置换反应,产物之一的晶胞结构如图所示。

化学式为_____ 。该晶胞中只由铁原子构成的晶胞堆积模型为__________ 。若两个最近的Fe原子间的距离为a nm,则该晶体的密度是______________ (填序号)g/cm3(设阿伏加德罗常数的值为NA)。
A. B.
B. ×1030 C.
×1030 C. ×
× ×1027 D.
×1027 D.  ×1021
×1021
(5)如上述晶胞将N原子放在顶点,则Fe原子会在晶胞中出现的位置是棱心和__________ 。
(1)基态铬原子的价电子排布图为 (填序号)。
A. | B. |
C.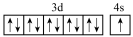 | D. |
①上述描述中涉及的非金属元素电负性由大到小的顺序是
A.C>Cl>O B.C<Cl<O C.O>Cl>C D.C<O<Cl
②常温时CrO2Cl2是一种易溶于CCl4的液体,则固态CrO2Cl2属于
③配合物CrCl3·6H2O中心离子Cr3+的配位数为6,向含0.1molCrCl3·6H2O 的溶液中滴加2mol·L-1 AgNO3溶液,反应完全后共消耗AgNO3溶液50mL,则配合物的化学式应该写为
A.[Cr(H2O)4Cl] Cl2·2H2O B.[Cr(H2O)4Cl2] Cl·2H2O
C.[Cr(H2O)4Cl2] Cl D.[Cr(H2O)3Cl3]·H2O
(3)Co3+与NO
 形成的配合物与K+生成黄色沉淀可以检验溶液中的K+。
形成的配合物与K+生成黄色沉淀可以检验溶液中的K+。①配体
 的立体构型为
的立体构型为A. 三角锥形 B. 平面三角形 C.直线形 D.V形
②
 的中心原子的杂化类型为
的中心原子的杂化类型为A. sp B. sp2 C.sp3 D.dsp2
③N原子中有
(4)铁和氨气在640 ℃可发生置换反应,产物之一的晶胞结构如图所示。

化学式为
A.
 B.
B. ×1030 C.
×1030 C. ×
× ×1027 D.
×1027 D.  ×1021
×1021(5)如上述晶胞将N原子放在顶点,则Fe原子会在晶胞中出现的位置是棱心和
您最近一年使用:0次
解题方法
3 . 在元素周期表中,铜副族(IB族)包括铜、银、金等元素,在生产、生活和科研中都有着广泛用途和重要的研究价值。
(1)铜副族位于周期表_______ 区,基态Cu原子的价电子排布式为 _______ 。
(2)向 溶液中滴加少量氨水,反应现象为
溶液中滴加少量氨水,反应现象为_______ 。继续滴加氨水可得到深蓝色透明溶液,写出该反应的离子方程式_______ 。 的空间构型为
的空间构型为_______ ,中心原子S的杂化方式为_______ 。
(3) 中配位原子是S原子而非O原子,其原因是
中配位原子是S原子而非O原子,其原因是_______ , 中三种元素电负性由大到小排序为
中三种元素电负性由大到小排序为_______ 。
(4)在离子晶体中,当 (阳离子)∶r(阴离子)
(阳离子)∶r(阴离子) 时,AB型化合物往往采用和NaCl晶体相同的晶体结构。已知
时,AB型化合物往往采用和NaCl晶体相同的晶体结构。已知 ,但在室温下,AgI的晶体结构如下图所示,称为六方碘化银。I-的配位数为
,但在室温下,AgI的晶体结构如下图所示,称为六方碘化银。I-的配位数为_______ ,造成AgI晶体结构不同于NaCl晶体结构的原因不可能是_______ (填标号)。
a.几何因素 b.键性因素 c.电荷因素

(5)Cu与Au的某种合金可形成面心立方最密堆积的晶体,Cu原子处于晶胞面心,该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构相似,如下图所示,该晶体储氢后的化学式为_______ 。

(1)铜副族位于周期表
(2)向
 溶液中滴加少量氨水,反应现象为
溶液中滴加少量氨水,反应现象为 的空间构型为
的空间构型为(3)
 中配位原子是S原子而非O原子,其原因是
中配位原子是S原子而非O原子,其原因是 中三种元素电负性由大到小排序为
中三种元素电负性由大到小排序为(4)在离子晶体中,当
 (阳离子)∶r(阴离子)
(阳离子)∶r(阴离子) 时,AB型化合物往往采用和NaCl晶体相同的晶体结构。已知
时,AB型化合物往往采用和NaCl晶体相同的晶体结构。已知 ,但在室温下,AgI的晶体结构如下图所示,称为六方碘化银。I-的配位数为
,但在室温下,AgI的晶体结构如下图所示,称为六方碘化银。I-的配位数为a.几何因素 b.键性因素 c.电荷因素

(5)Cu与Au的某种合金可形成面心立方最密堆积的晶体,Cu原子处于晶胞面心,该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构相似,如下图所示,该晶体储氢后的化学式为

您最近一年使用:0次
解题方法
4 . 氮元素与氢元素能形成多种化合物,在工业、农业和国防等方面用途非常广泛,例如:氨气、肼(N2H4)、叠氮酸(HN3)……等,请回答下列问题:
(1)N位于周期表中____ 区,基态N原子的价电子排布式为____ 。
(2)N2H4分子的电子式为____ ,其中N采取____ 杂化。
(3)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N 。请写出一种与N
。请写出一种与N 互为等电子体的分子的化学式
互为等电子体的分子的化学式____ ;叠氮化物易与过渡金属元素形成配合物,如:[Fe(N3)(NH3)5]SO4,在该配合物中Fe的配位数为____ ,SO 的立体构型为
的立体构型为____ 。
(4)已知Zn2+能与氨分子形成配离子[Zn(NH3)4]2+,1mol该离子含有σ键的数目为____ 。
(5)氮与铝形成的某种晶体的晶胞如图所示。
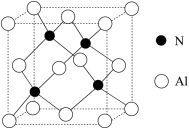
①该晶体的化学式为____ 。
②已知该晶体的密度为dg·cm−3,N和Al的半径分别为apm和bpm,阿伏加德罗常数值为NA。用含a、b、d和NA的式子表示该晶体中原子的空间利用率____ (用含a、b、d和NA的式子表示)。
(1)N位于周期表中
(2)N2H4分子的电子式为
(3)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N
 。请写出一种与N
。请写出一种与N 互为等电子体的分子的化学式
互为等电子体的分子的化学式 的立体构型为
的立体构型为(4)已知Zn2+能与氨分子形成配离子[Zn(NH3)4]2+,1mol该离子含有σ键的数目为
(5)氮与铝形成的某种晶体的晶胞如图所示。

①该晶体的化学式为
②已知该晶体的密度为dg·cm−3,N和Al的半径分别为apm和bpm,阿伏加德罗常数值为NA。用含a、b、d和NA的式子表示该晶体中原子的空间利用率
您最近一年使用:0次
解题方法
5 . 硼、氮、磷、钴、镍等元素的化合物在现代农业、科技、国防建设中有着许多独特的用途。
(1)制备氮化硼(BN)的一种方法为:BCl3(g)+NH3(g)=BN(s)+3HCl(g)。立方氮化硼(BN)硬度大、熔点为3000℃,其晶体类型为_______ 。试用价层电子对互斥理论解释BCl3的键角比NH3大的原因_______ 。
(2)磷原子在成键时,能将一个3s电子激发进入3d能级而参加成键,写出该激发态磷原子的核外电子排布式_______ 。
(3)一种Ni2+配合物的结构如图所示:

①该配合物中第二周期元素的第一电离能由大到小的顺序是_______ (填元素符号)。
②该配合物中碳原子的杂化方式为_______ 。
③该配合物中存在的化学键类型有_______ (填标号)。
A.离子键 B.σ键 C.π键 D.氢键 E.配位键
(4)钴位于周期表的_______ 区,钴与NH3易形成正八面体形的[Co(NH3)6]3+配离子,试推测[CoCl2(NH3)4]+的空间结构有_______ 种。Co可以形成六方晶系的CoO(OH),晶胞结构如图所示,设NA为阿伏加德罗常数的值,该晶体的密度为_______ g/cm3(用代数式表示)。

(1)制备氮化硼(BN)的一种方法为:BCl3(g)+NH3(g)=BN(s)+3HCl(g)。立方氮化硼(BN)硬度大、熔点为3000℃,其晶体类型为
(2)磷原子在成键时,能将一个3s电子激发进入3d能级而参加成键,写出该激发态磷原子的核外电子排布式
(3)一种Ni2+配合物的结构如图所示:

①该配合物中第二周期元素的第一电离能由大到小的顺序是
②该配合物中碳原子的杂化方式为
③该配合物中存在的化学键类型有
A.离子键 B.σ键 C.π键 D.氢键 E.配位键
(4)钴位于周期表的

您最近一年使用:0次
名校
解题方法
6 . 氮、磷、氯、溴、铁、铜等元素及其化合物在现代农业、科技和国防建设中有着许多独特的用途。LiFePO4是新型锂离子电池的电极材料,可利用FeCl3、NH4H2PO4、LiC1和苯胺( )等原料来制备。回答下列问题。
)等原料来制备。回答下列问题。
(1)铁元素在元素周期表中的位置为___________ ,基态Fe2+的价层电子排布图(轨道表达式)为___________ 。
(2)NH4H2PO4中,除氢元素外,其余三种元素第一电离能最大的是___________ (填元素符号),P原子的杂化类型为___________ 。
(3)苯胺和甲苯相对分子质量接近,但苯胺熔点明显比甲苯的高,原因是___________ 。
(4)红磷在氯气中燃烧可以得到PCl3和PCl5,其中气态PCl3分子的立体构型为___________ 。研究发现固态PCl5和PBr5的结构分别为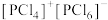 和
和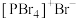 ,则它们的晶体类型为
,则它们的晶体类型为___________ 。
(5)已知NH3分子中H—N—H的键角为107.3°,则配合物[Cu(NH3)4]SO4中H—N—H的键角___________ 107.3°(填“大于”“小于”“等于”)。
(6)铁酸钇是一种典型的单相多铁性材料,其正交相晶胞结构以及各原子的投影位置如图所示。
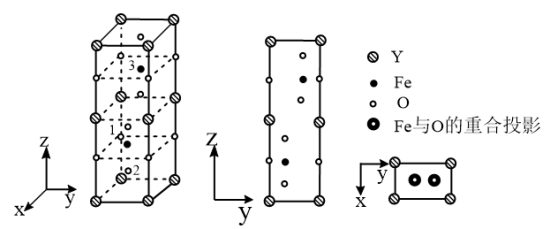
已知1号O原子空间坐标为(0,0, ),2号O原子空间坐标为(
),2号O原子空间坐标为( ,
, −m,
−m, −n),则3号Fe原子的空间坐标为
−n),则3号Fe原子的空间坐标为___________ ,若晶胞参数分别为apm、bpm和cpm,阿伏加德罗常数的值用NA表示,则该晶体的密度为___________ g·cm−3(列出表达式)。
 )等原料来制备。回答下列问题。
)等原料来制备。回答下列问题。(1)铁元素在元素周期表中的位置为
(2)NH4H2PO4中,除氢元素外,其余三种元素第一电离能最大的是
(3)苯胺和甲苯相对分子质量接近,但苯胺熔点明显比甲苯的高,原因是
(4)红磷在氯气中燃烧可以得到PCl3和PCl5,其中气态PCl3分子的立体构型为
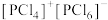 和
和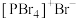 ,则它们的晶体类型为
,则它们的晶体类型为(5)已知NH3分子中H—N—H的键角为107.3°,则配合物[Cu(NH3)4]SO4中H—N—H的键角
(6)铁酸钇是一种典型的单相多铁性材料,其正交相晶胞结构以及各原子的投影位置如图所示。

已知1号O原子空间坐标为(0,0,
 ),2号O原子空间坐标为(
),2号O原子空间坐标为( ,
, −m,
−m, −n),则3号Fe原子的空间坐标为
−n),则3号Fe原子的空间坐标为
您最近一年使用:0次
名校
7 . 碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛。
(1)基态C原子的空间运动状态有______ 个,其未成对电子对应的电子云形状为_______ 。
(2)金刚石和石墨是碳元素的两种常见单质,下列关于这两种单质的叙述中正确的是_______ 。
A.金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化。
B.两种晶体中碳碳键的键长:金刚石<石墨
C.晶体中共价键的键角:金刚石>石墨
D.晶体的熔点:金刚石<石墨
E.金刚石中只存在共价键,而石墨晶体中除共价键外还存在离子键和范德华力
(3)CO2是碳的重要化合物之一,它的某一种等电子体(A离子),实验室常用来检验Fe3+离子,写出A离子的结构式_______ ;A离子中心原子的价层电子对数是_______ 对;它的另一种等电子体CS2是一种_______ 溶剂(填“极性”或“非极性”),请说出CS2的沸点高于CO2的原因是_______ 。
(4)碳酸铯与盐酸反应可得到CsCl,CsCl晶胞是中学常见晶胞。
①该晶胞类型为_______ 。
②已知该晶体中CsCl的键长为apm,阿伏加德罗常数为NA,CsCl的摩尔质量为Mg/mol,则该晶体的密度为_______ g/cm3(用含字母a的关系式表示)
(5)孔雀石[Cu2(OH)2CO3]是自然界中一种含碳元素的重要矿物质,加热分解得CuO,CuO溶于稀硫酸得蓝色溶液,再滴加乙二胺(NH2CH2CH2NH2)溶液,溶液变为紫色。
查阅资料:①Cu2+易形成配位数为4的配合离子。②H2O和乙二胺都能与过渡金属离子形成配合离子。
孔雀石[Cu2(OH)2CO3]中各非金属元素第一电离能从小到大排序为_______ 。写出Cu2+的价层电子排布式_______ 。紫色溶液中含有铜元素形成的配离子的化学式_______ ,其中配位原子在空间形成形状为_______ 。
(1)基态C原子的空间运动状态有
(2)金刚石和石墨是碳元素的两种常见单质,下列关于这两种单质的叙述中正确的是
A.金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化。
B.两种晶体中碳碳键的键长:金刚石<石墨
C.晶体中共价键的键角:金刚石>石墨
D.晶体的熔点:金刚石<石墨
E.金刚石中只存在共价键,而石墨晶体中除共价键外还存在离子键和范德华力
(3)CO2是碳的重要化合物之一,它的某一种等电子体(A离子),实验室常用来检验Fe3+离子,写出A离子的结构式
(4)碳酸铯与盐酸反应可得到CsCl,CsCl晶胞是中学常见晶胞。
①该晶胞类型为
②已知该晶体中CsCl的键长为apm,阿伏加德罗常数为NA,CsCl的摩尔质量为Mg/mol,则该晶体的密度为
(5)孔雀石[Cu2(OH)2CO3]是自然界中一种含碳元素的重要矿物质,加热分解得CuO,CuO溶于稀硫酸得蓝色溶液,再滴加乙二胺(NH2CH2CH2NH2)溶液,溶液变为紫色。
查阅资料:①Cu2+易形成配位数为4的配合离子。②H2O和乙二胺都能与过渡金属离子形成配合离子。
孔雀石[Cu2(OH)2CO3]中各非金属元素第一电离能从小到大排序为
您最近一年使用:0次
名校
8 . 氟及其化合物用途十分广泛,回答下列问题:
(1)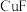 的熔点为
的熔点为 ,熔化呈液态时能导电。
,熔化呈液态时能导电。 的熔点为
的熔点为 ,能升华,熔化呈液态时不导电;
,能升华,熔化呈液态时不导电;
①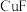 中
中 的基态价电子排布式为
的基态价电子排布式为_________ ,铜元素位于元素周期表_________ 区,已知 、
、 的第二电离能分别为
的第二电离能分别为 、
、 ,前者高于后者的原因
,前者高于后者的原因___________________________ 。
②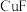 的熔点比
的熔点比 的高,原因是
的高,原因是____________________________________ 。
(2)
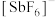 (氟锑酸,是一种超强酸),阳离子
(氟锑酸,是一种超强酸),阳离子 的空间构型为
的空间构型为_________ ,与 互为等电子体的微粒有
互为等电子体的微粒有_________ (分子、离子各写一种)。
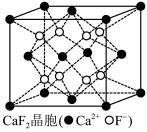
(3)工业上电解 制取单质铝,常利用冰晶石
制取单质铝,常利用冰晶石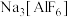 降低
降低 的熔点。通常将
的熔点。通常将 和
和 一同溶于氢氟酸来制取冰晶石,反应时放出
一同溶于氢氟酸来制取冰晶石,反应时放出 气体,写出该反应的化学方程式
气体,写出该反应的化学方程式___________________________ 。
(4)硒化锌( )是一种重要的半导体材料,其晶胞结构如图甲所示,乙图为甲图的俯视图,若A点坐标为
)是一种重要的半导体材料,其晶胞结构如图甲所示,乙图为甲图的俯视图,若A点坐标为 ,B点坐标为
,B点坐标为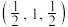 ,则D点坐标为
,则D点坐标为_________ 。
(5) 的晶胞如图所示,密度为
的晶胞如图所示,密度为 ,相邻的两个
,相邻的两个 的最近核间距为
的最近核间距为 ,则
,则 的摩尔质量为
的摩尔质量为_________ 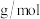 (列出代数式,设
(列出代数式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)
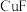 的熔点为
的熔点为 ,熔化呈液态时能导电。
,熔化呈液态时能导电。 的熔点为
的熔点为 ,能升华,熔化呈液态时不导电;
,能升华,熔化呈液态时不导电;①
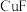 中
中 的基态价电子排布式为
的基态价电子排布式为 、
、 的第二电离能分别为
的第二电离能分别为 、
、 ,前者高于后者的原因
,前者高于后者的原因②
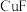 的熔点比
的熔点比 的高,原因是
的高,原因是(2)

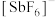 (氟锑酸,是一种超强酸),阳离子
(氟锑酸,是一种超强酸),阳离子 的空间构型为
的空间构型为 互为等电子体的微粒有
互为等电子体的微粒有(3)工业上电解
 制取单质铝,常利用冰晶石
制取单质铝,常利用冰晶石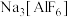 降低
降低 的熔点。通常将
的熔点。通常将 和
和 一同溶于氢氟酸来制取冰晶石,反应时放出
一同溶于氢氟酸来制取冰晶石,反应时放出 气体,写出该反应的化学方程式
气体,写出该反应的化学方程式(4)硒化锌(
 )是一种重要的半导体材料,其晶胞结构如图甲所示,乙图为甲图的俯视图,若A点坐标为
)是一种重要的半导体材料,其晶胞结构如图甲所示,乙图为甲图的俯视图,若A点坐标为 ,B点坐标为
,B点坐标为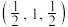 ,则D点坐标为
,则D点坐标为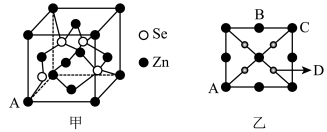
(5)
 的晶胞如图所示,密度为
的晶胞如图所示,密度为 ,相邻的两个
,相邻的两个 的最近核间距为
的最近核间距为 ,则
,则 的摩尔质量为
的摩尔质量为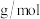 (列出代数式,设
(列出代数式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
2022-01-18更新
|
152次组卷
|
2卷引用:四川省内江市2021-2022学年高二上学期期末检测题化学试题
9 . 第VA族元素氮、磷、砷的化合物用途广泛。回答下列问题:
(1)基态磷原子的电子排布式为_____ ,基态砷原子核外有______ 个未成对电子。
(2)配离子[Cr(NH3)3(H2O)2Cl]2+中,提供孤电子对的原子有______ ,中心离子的配位数为___________ 。
(3) 中N原子的杂化轨道类型为
中N原子的杂化轨道类型为____ ,其立体构型名称为_____ ,与其互为等电子体的分子为______ (写出一种即可)。
(4)无机含氧酸分子中含一个非羟基氧是中强酸,如H3PO4为中强酸,其结构简式为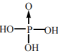 ;则同为中强酸的H3PO2的结构简式为
;则同为中强酸的H3PO2的结构简式为___________ 。
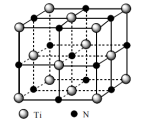
(5)某种由N与Ti形成的化合物,其晶胞结构如下图。阿伏加德罗常数的值为NA,晶胞中Ti原子与N原子的最近距离为anm,晶胞的密度为___________ g/cm3(写出表达式即可)。
(1)基态磷原子的电子排布式为
(2)配离子[Cr(NH3)3(H2O)2Cl]2+中,提供孤电子对的原子有
(3)
 中N原子的杂化轨道类型为
中N原子的杂化轨道类型为(4)无机含氧酸分子中含一个非羟基氧是中强酸,如H3PO4为中强酸,其结构简式为
 ;则同为中强酸的H3PO2的结构简式为
;则同为中强酸的H3PO2的结构简式为(5)某种由N与Ti形成的化合物,其晶胞结构如下图。阿伏加德罗常数的值为NA,晶胞中Ti原子与N原子的最近距离为anm,晶胞的密度为

您最近一年使用:0次
10 . 锰及其化合物用途非常广泛。请按要求回答下列问题。
(1) 是一种准晶体(介于晶体和非晶体之间的固体),能准确证明其不是晶体的方法的是
是一种准晶体(介于晶体和非晶体之间的固体),能准确证明其不是晶体的方法的是_______ 。
(2)基态 原子未成对电子数为
原子未成对电子数为_______ 个。
(3) 熔点(1610℃)比
熔点(1610℃)比 熔点(1650℃)低,其原因是
熔点(1650℃)低,其原因是_______ 。
(4)锰的一种配合物的化学式为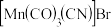 。配合物中锰元素的价态为
。配合物中锰元素的价态为_______ 。
(5)锰的含氧酸有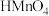 、
、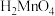 ,
,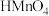 的酸性比
的酸性比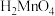 强,理由是
强,理由是_______ 。
(6)镍合金储氢的研究已取得很大进展。
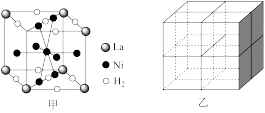
图甲是一种镍基合金储氢后的晶胞结构示意图。该合金储氢后,含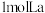 的合金可吸附
的合金可吸附 的数目为
的数目为_______ 。 是一种贮氢的金属化合物。在
是一种贮氢的金属化合物。在 晶胞中,
晶胞中, 原子占据如图乙的顶点和面心,
原子占据如图乙的顶点和面心, 处于乙图八个小立方体的体心。若晶体的密度为
处于乙图八个小立方体的体心。若晶体的密度为 ,
, 的摩尔质量为
的摩尔质量为 ,则和
,则和 和
和 原子的最短距离为
原子的最短距离为_______  (用含d、M、
(用含d、M、 的代数式表示)。
的代数式表示)。
(1)
 是一种准晶体(介于晶体和非晶体之间的固体),能准确证明其不是晶体的方法的是
是一种准晶体(介于晶体和非晶体之间的固体),能准确证明其不是晶体的方法的是(2)基态
 原子未成对电子数为
原子未成对电子数为(3)
 熔点(1610℃)比
熔点(1610℃)比 熔点(1650℃)低,其原因是
熔点(1650℃)低,其原因是(4)锰的一种配合物的化学式为
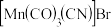 。配合物中锰元素的价态为
。配合物中锰元素的价态为(5)锰的含氧酸有
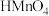 、
、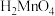 ,
,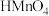 的酸性比
的酸性比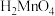 强,理由是
强,理由是(6)镍合金储氢的研究已取得很大进展。

图甲是一种镍基合金储氢后的晶胞结构示意图。该合金储氢后,含
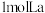 的合金可吸附
的合金可吸附 的数目为
的数目为 是一种贮氢的金属化合物。在
是一种贮氢的金属化合物。在 晶胞中,
晶胞中, 原子占据如图乙的顶点和面心,
原子占据如图乙的顶点和面心, 处于乙图八个小立方体的体心。若晶体的密度为
处于乙图八个小立方体的体心。若晶体的密度为 ,
, 的摩尔质量为
的摩尔质量为 ,则和
,则和 和
和 原子的最短距离为
原子的最短距离为 (用含d、M、
(用含d、M、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次



