解题方法
1 . 镍及其化合物在工业生产和科研领域有着重要的用途。回答下列问题:
(1)基态 原子价层电子的电子排布图(轨道表达式)为
原子价层电子的电子排布图(轨道表达式)为___________ 。
(2)醋酸镍晶体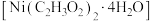 在电镀中有广泛应用,其中
在电镀中有广泛应用,其中 中O原子的杂化轨道类型为
中O原子的杂化轨道类型为___________ ,若该晶胞构型为四方双锥,则中心 原子的配位数为
原子的配位数为___________ 。
(3)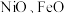 的晶体结构类型均与氯化钠的相同,已知熔点:
的晶体结构类型均与氯化钠的相同,已知熔点: ,则离子半径:
,则离子半径: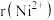
___________ (填“<”或“>”)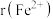 ;天然的和人工合成的氧化镍常存在各种缺陷,某缺陷氧化镍的组成为
;天然的和人工合成的氧化镍常存在各种缺陷,某缺陷氧化镍的组成为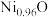 ,其中
,其中 元素只有
元素只有 和
和 两种价态,
两种价态, 与
与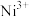 的数目之比为
的数目之比为___________ 。
(4)四羰基镍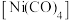 是由路德维希·蒙德所发现。
是由路德维希·蒙德所发现。 作配体时配位原子是C而不是O,其原因是
作配体时配位原子是C而不是O,其原因是___________ ; 分子内
分子内 键与
键与 键个数之比为
键个数之比为___________ 。
(5)金属镍与镧( )形成的合金是一种良好的储氢材料,其晶胞结构如图所示。若阿伏加德罗常数的值为
)形成的合金是一种良好的储氢材料,其晶胞结构如图所示。若阿伏加德罗常数的值为 ,晶胞棱长为
,晶胞棱长为 ,则该晶体的密度为
,则该晶体的密度为___________  (用含a、
(用含a、 的代数式表示)。
的代数式表示)。

(1)基态
 原子价层电子的电子排布图(轨道表达式)为
原子价层电子的电子排布图(轨道表达式)为(2)醋酸镍晶体
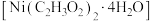 在电镀中有广泛应用,其中
在电镀中有广泛应用,其中 中O原子的杂化轨道类型为
中O原子的杂化轨道类型为 原子的配位数为
原子的配位数为(3)
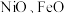 的晶体结构类型均与氯化钠的相同,已知熔点:
的晶体结构类型均与氯化钠的相同,已知熔点: ,则离子半径:
,则离子半径: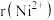
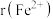 ;天然的和人工合成的氧化镍常存在各种缺陷,某缺陷氧化镍的组成为
;天然的和人工合成的氧化镍常存在各种缺陷,某缺陷氧化镍的组成为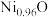 ,其中
,其中 元素只有
元素只有 和
和 两种价态,
两种价态, 与
与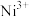 的数目之比为
的数目之比为(4)四羰基镍
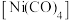 是由路德维希·蒙德所发现。
是由路德维希·蒙德所发现。 作配体时配位原子是C而不是O,其原因是
作配体时配位原子是C而不是O,其原因是 分子内
分子内 键与
键与 键个数之比为
键个数之比为(5)金属镍与镧(
 )形成的合金是一种良好的储氢材料,其晶胞结构如图所示。若阿伏加德罗常数的值为
)形成的合金是一种良好的储氢材料,其晶胞结构如图所示。若阿伏加德罗常数的值为 ,晶胞棱长为
,晶胞棱长为 ,则该晶体的密度为
,则该晶体的密度为 (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解题方法
2 . 在元素周期表中,铜副族(IB族)包括铜、银、金等元素,在生产、生活和科研中都有着广泛用途和重要的研究价值。
(1)铜副族位于周期表_______ 区,基态Cu原子的价电子排布式为 _______ 。
(2)向 溶液中滴加少量氨水,反应现象为
溶液中滴加少量氨水,反应现象为_______ 。继续滴加氨水可得到深蓝色透明溶液,写出该反应的离子方程式_______ 。 的空间构型为
的空间构型为_______ ,中心原子S的杂化方式为_______ 。
(3) 中配位原子是S原子而非O原子,其原因是
中配位原子是S原子而非O原子,其原因是_______ , 中三种元素电负性由大到小排序为
中三种元素电负性由大到小排序为_______ 。
(4)在离子晶体中,当 (阳离子)∶r(阴离子)
(阳离子)∶r(阴离子) 时,AB型化合物往往采用和NaCl晶体相同的晶体结构。已知
时,AB型化合物往往采用和NaCl晶体相同的晶体结构。已知 ,但在室温下,AgI的晶体结构如下图所示,称为六方碘化银。I-的配位数为
,但在室温下,AgI的晶体结构如下图所示,称为六方碘化银。I-的配位数为_______ ,造成AgI晶体结构不同于NaCl晶体结构的原因不可能是_______ (填标号)。
a.几何因素 b.键性因素 c.电荷因素

(5)Cu与Au的某种合金可形成面心立方最密堆积的晶体,Cu原子处于晶胞面心,该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构相似,如下图所示,该晶体储氢后的化学式为_______ 。

(1)铜副族位于周期表
(2)向
 溶液中滴加少量氨水,反应现象为
溶液中滴加少量氨水,反应现象为 的空间构型为
的空间构型为(3)
 中配位原子是S原子而非O原子,其原因是
中配位原子是S原子而非O原子,其原因是 中三种元素电负性由大到小排序为
中三种元素电负性由大到小排序为(4)在离子晶体中,当
 (阳离子)∶r(阴离子)
(阳离子)∶r(阴离子) 时,AB型化合物往往采用和NaCl晶体相同的晶体结构。已知
时,AB型化合物往往采用和NaCl晶体相同的晶体结构。已知 ,但在室温下,AgI的晶体结构如下图所示,称为六方碘化银。I-的配位数为
,但在室温下,AgI的晶体结构如下图所示,称为六方碘化银。I-的配位数为a.几何因素 b.键性因素 c.电荷因素

(5)Cu与Au的某种合金可形成面心立方最密堆积的晶体,Cu原子处于晶胞面心,该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构相似,如下图所示,该晶体储氢后的化学式为

您最近一年使用:0次
名校
解题方法
3 . 铜及其化合物在科学研究和工农业生产中有许多用途。回答下列问题:
(1)①将氨水逐滴加入硫酸铜溶液中,先生成蓝色沉淀,继续滴加氨水,沉淀溶解并得到深蓝色溶液,写出沉淀溶解的离子方程式:____ 。
②向深蓝色溶液中继续加入乙醇,会析出深蓝色的晶体[Cu(NH3)4]SO4•H2O。在该晶体中1mol[Cu(NH3)4]2+含有σ键的数目为____ 。
③[Cu(NH3)4]2+中各元素电负性由大到小的顺序为____ ,其中N原子的杂化轨道类型为____ 。
④[Cu(NH3)4]2+中NH3的键角比独立存在的分子结构中的键角____ 。(填“大”“小”或“相等”)
(2)Cu−Mn−Al合金为磁性形状记忆合金材料之一,其晶胞结构如图所示。
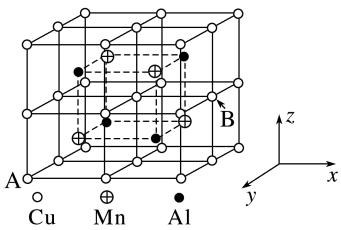
①合金的化学式为____ 。
②若A原子的坐标参数为(0,1,0),则B原子的坐标参数为____ 。
③已知该合金晶体的密度为ρg•cm-3,则最近的两个Al原子间的距离为___ nm(阿伏加德罗常数的值用NA表示)。
(1)①将氨水逐滴加入硫酸铜溶液中,先生成蓝色沉淀,继续滴加氨水,沉淀溶解并得到深蓝色溶液,写出沉淀溶解的离子方程式:
②向深蓝色溶液中继续加入乙醇,会析出深蓝色的晶体[Cu(NH3)4]SO4•H2O。在该晶体中1mol[Cu(NH3)4]2+含有σ键的数目为
③[Cu(NH3)4]2+中各元素电负性由大到小的顺序为
④[Cu(NH3)4]2+中NH3的键角比独立存在的分子结构中的键角
(2)Cu−Mn−Al合金为磁性形状记忆合金材料之一,其晶胞结构如图所示。

①合金的化学式为
②若A原子的坐标参数为(0,1,0),则B原子的坐标参数为
③已知该合金晶体的密度为ρg•cm-3,则最近的两个Al原子间的距离为
您最近一年使用:0次
解题方法
4 . 铝在合金制造和铝离子电池等方面用途非常广泛,铝离子电池常用室温下的离子液体AlCl3/[EMIM]Cl作电解质。回答下列问题:
(1)基态Al原子核外价电子排布图为________ 。Mg、Al及Si的第一电离能从大到小的顺序为______ 。
(2)铝离子电池工作时,离子液体电解质中阴离子有AlCl 、Al2Cl
、Al2Cl ,阳离子为EMIM+(
,阳离子为EMIM+( )。
)。
①AlCl 的空间构型为
的空间构型为________ ;Al2Cl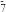 中各原子最外层均达到8电子结构,则其结构式为
中各原子最外层均达到8电子结构,则其结构式为________ 。
②EMIM+中环上所有原子共面,则其中两个氮原子的杂化方式分别是________ 、________ ;分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则
),则 中的大π键应表示为
中的大π键应表示为_________ 。
③[EMIM]+[F(HF)3]-也是一种常见的离子液体,画出[F(HF)3]-的结构式:_________ 。
(3)一种金属间化合物的晶胞结构如下图所示:

以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为(0,0,0),B点原子的分数坐标为( ,
, ,
, ),则C点原子在z轴方向上的分数坐标z=
),则C点原子在z轴方向上的分数坐标z=________ (用含c、s的代数式表示);设Mg、Cu和Al原子半径分别为rMgpm、rCupm、rAlpm,则金属原子的空间占有率为_________ %(列出计算表达式)。
(1)基态Al原子核外价电子排布图为
(2)铝离子电池工作时,离子液体电解质中阴离子有AlCl
 、Al2Cl
、Al2Cl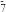 ,阳离子为EMIM+(
,阳离子为EMIM+( )。
)。①AlCl
 的空间构型为
的空间构型为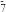 中各原子最外层均达到8电子结构,则其结构式为
中各原子最外层均达到8电子结构,则其结构式为②EMIM+中环上所有原子共面,则其中两个氮原子的杂化方式分别是
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则
),则 中的大π键应表示为
中的大π键应表示为③[EMIM]+[F(HF)3]-也是一种常见的离子液体,画出[F(HF)3]-的结构式:
(3)一种金属间化合物的晶胞结构如下图所示:

以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为(0,0,0),B点原子的分数坐标为(
 ,
, ,
, ),则C点原子在z轴方向上的分数坐标z=
),则C点原子在z轴方向上的分数坐标z=
您最近一年使用:0次
解题方法
5 . 磷及其化合物在工业生产和科研领域有重要的用途。回答下列问题:
(1)基态P原子价层电子排布图为__________________ 。
(2)研究发现固态 结构中存在
结构中存在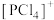 和
和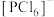 ,则
,则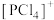 的空间构型为
的空间构型为______________ ; 属于
属于_________ (填“离子”或“分子”)晶体;研究固态 时又发现固态
时又发现固态 存在
存在 和
和 ,则固态
,则固态 结构中不存在
结构中不存在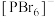 的原因是
的原因是__________________________ 。
(3)N-(膦酰甲基)亚氨基二乙酸结构如图所示。
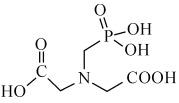
①组成元素中,属于第二周期的元素电负性由大到小的顺序为________ (填元素符号,下同)。
②组成元素中第一电离能最大的是_________ 。
③ 、
、 的组成结构相似,
的组成结构相似, 的相对分子质量大,熔沸点反而降低的原因是
的相对分子质量大,熔沸点反而降低的原因是____________________ 。
(4)磷元素与硼元素组成的一种半导体无机化合物材料,其晶胞结构如图所示,属于立方晶系。晶胞边长为a nm,阿伏加德罗常数的值为 。
。
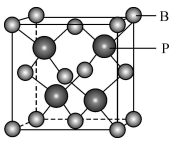
①该晶体的化学式为______________ ;
②计算该晶体的密度
_________  。
。
(1)基态P原子价层电子排布图为
(2)研究发现固态
 结构中存在
结构中存在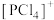 和
和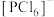 ,则
,则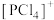 的空间构型为
的空间构型为 属于
属于 时又发现固态
时又发现固态 存在
存在 和
和 ,则固态
,则固态 结构中不存在
结构中不存在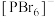 的原因是
的原因是(3)N-(膦酰甲基)亚氨基二乙酸结构如图所示。

①组成元素中,属于第二周期的元素电负性由大到小的顺序为
②组成元素中第一电离能最大的是
③
 、
、 的组成结构相似,
的组成结构相似, 的相对分子质量大,熔沸点反而降低的原因是
的相对分子质量大,熔沸点反而降低的原因是(4)磷元素与硼元素组成的一种半导体无机化合物材料,其晶胞结构如图所示,属于立方晶系。晶胞边长为a nm,阿伏加德罗常数的值为
 。
。
①该晶体的化学式为
②计算该晶体的密度

 。
。
您最近一年使用:0次
解题方法
6 . 碳族元素中的碳、硅、锗及其化合物在诸多领域有重要用途。
(1)碳族元素位于周期表_______ 区,基态锗原子外围电子的轨道表示式为_______ ,基态锗原子核外有_______ 种空间运动状态不同的电子。
(2)科学家以 、
、 等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。
等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。 和
和 结构中含氮碳环均为平面结构,则N的杂化方式是
结构中含氮碳环均为平面结构,则N的杂化方式是_______ 。
(3)金刚石(甲)、石墨(乙)、C60(丙)的结构如下图所示:
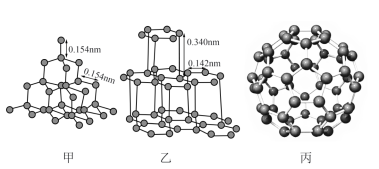
①12g金刚石和石墨中含有的σ键数目之比为_______ 。
②金刚石的熔点高于C60,但低于石墨,原因是_______ 。
③C60的晶胞呈分子密堆积,下列晶体中,与C60具有相同晶体结构的是_______ 。
A.CO2 B.冰 C.Zn D.Ag E.NaCl
(4)一种低温超导体立方晶胞结构如下图所示:
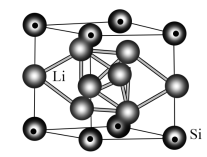
①该晶体的化学式为_______ 。
②若晶胞参数为apm,该晶体的密度ρ=_______  。(列出计算式即可,设NA表示阿伏加德罗常数的值)
。(列出计算式即可,设NA表示阿伏加德罗常数的值)
(1)碳族元素位于周期表
(2)科学家以
 、
、 等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。
等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。 和
和 结构中含氮碳环均为平面结构,则N的杂化方式是
结构中含氮碳环均为平面结构,则N的杂化方式是
(3)金刚石(甲)、石墨(乙)、C60(丙)的结构如下图所示:

①12g金刚石和石墨中含有的σ键数目之比为
②金刚石的熔点高于C60,但低于石墨,原因是
③C60的晶胞呈分子密堆积,下列晶体中,与C60具有相同晶体结构的是
A.CO2 B.冰 C.Zn D.Ag E.NaCl
(4)一种低温超导体立方晶胞结构如下图所示:

①该晶体的化学式为
②若晶胞参数为apm,该晶体的密度ρ=
 。(列出计算式即可,设NA表示阿伏加德罗常数的值)
。(列出计算式即可,设NA表示阿伏加德罗常数的值)
您最近一年使用:0次
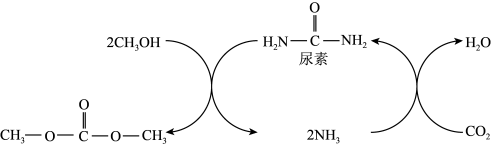
7 . 碳酸二甲酯(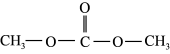 )是一种环保性能优异、用途广泛的化工原料。在催化剂作用下,由
)是一种环保性能优异、用途广泛的化工原料。在催化剂作用下,由 制备碳酸二甲酯的过程如图所示。回答下列问题:
制备碳酸二甲酯的过程如图所示。回答下列问题:
(1)尿素中N的第一电离能比O的高,原因是:
①O失去的是已经配对的电子,配对电子相互排斥,因而第一电离能较低;
②_______ 。
(2)下列有关 、
、 的叙述,正确的是_______(填标号)。
的叙述,正确的是_______(填标号)。
(3)含钛、铁、铜、锌的催化剂在制备碳酸二甲酯的过程中,催化效果较好。
①基态钛原子核外s能级和p能级的电子数之比为_______ 。
②含钛新型正极材料 具有高化学电位。
具有高化学电位。 的空间构型为
的空间构型为_______ 。
③已知:存在未成对电子的金属离子具有顺磁性。 、
、 、
、 、
、 中具有顺磁性的离子是
中具有顺磁性的离子是_______ (填离子符号);这四种金属离子各1mol中,未成对电子数最多的金属离子是_______ (填离子符号)。
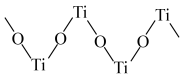
④Ti(Ⅳ)在酸溶液中可形成多种离子。其中如图所示结构的离子符号为_______ 。
(4)在 固溶体的催化体系中也能将
固溶体的催化体系中也能将 转化为碳酸二甲酯。
转化为碳酸二甲酯。 晶胞结构如图所示,
晶胞结构如图所示, 在晶胞中的配位数是
在晶胞中的配位数是_______ 。若该晶胞的密度为 ,用NA表示阿伏加德罗常数的值,则该晶胞的体积是
,用NA表示阿伏加德罗常数的值,则该晶胞的体积是_______  (列出计算式)。
(列出计算式)。
 )是一种环保性能优异、用途广泛的化工原料。在催化剂作用下,由
)是一种环保性能优异、用途广泛的化工原料。在催化剂作用下,由 制备碳酸二甲酯的过程如图所示。回答下列问题:
制备碳酸二甲酯的过程如图所示。回答下列问题:
(1)尿素中N的第一电离能比O的高,原因是:
①O失去的是已经配对的电子,配对电子相互排斥,因而第一电离能较低;
②
(2)下列有关
 、
、 的叙述,正确的是_______(填标号)。
的叙述,正确的是_______(填标号)。A. 的键角小于 的键角小于 的键角,是因为 的键角,是因为 的中心原子上孤电子对对成键电子对有较大的斥力 的中心原子上孤电子对对成键电子对有较大的斥力 |
B. 极易溶解在水中,与氨分子为极性分子和氨分子与水分子间能形成氢键有关 极易溶解在水中,与氨分子为极性分子和氨分子与水分子间能形成氢键有关 |
C. 的沸点比 的沸点比 的高,是因为N-H键能比P-H键能大 的高,是因为N-H键能比P-H键能大 |
D.1mol 中含有12molσ键 中含有12molσ键 |
①基态钛原子核外s能级和p能级的电子数之比为
②含钛新型正极材料
 具有高化学电位。
具有高化学电位。 的空间构型为
的空间构型为③已知:存在未成对电子的金属离子具有顺磁性。
 、
、 、
、 、
、 中具有顺磁性的离子是
中具有顺磁性的离子是④Ti(Ⅳ)在酸溶液中可形成多种离子。其中如图所示结构的离子符号为

(4)在
 固溶体的催化体系中也能将
固溶体的催化体系中也能将 转化为碳酸二甲酯。
转化为碳酸二甲酯。 晶胞结构如图所示,
晶胞结构如图所示, 在晶胞中的配位数是
在晶胞中的配位数是 ,用NA表示阿伏加德罗常数的值,则该晶胞的体积是
,用NA表示阿伏加德罗常数的值,则该晶胞的体积是 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
8 . 氟及其化合物用途非常广泛。回答下列问题:
(1)基态氟原子的价层电子排布图为___________ 。
(2)制备NSF3的反应为FCONSF2+2AgF2 NSF3+2AgF+COF2。
NSF3+2AgF+COF2。
①F、O、N、S的第一电离能从小到大的顺序是___________ 。
②COF2分子的空间构型为___________ 。
③NSF3、COF2的沸点依次为-27.1°C、-84.6°C,前者沸点较高的原因是___________ 。
(3)NHF2的一种制备方法是CO(NH2)2+2F2+H2O=NHF2+CO2+NH4HF2。
①CO(NH2)2中C的杂化方式是___________ 。
②CO(NH2)2的熔沸点比CH3CONH2的高,其原因是___________ 。
③下列说法正确的是___________ (填标号)。
A.NHF2、CO2均是极性分子
B.CO2与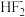 互为等电子体
互为等电子体
C.H2O与NHF2中心原子的价层电子对数相同
D.NH4HF2中存在离子键、配位键和氢键
(4)由Cs、Ag及F三种元素组成的一种超导材料的晶体结构如下图所示(Ag不是+1价):
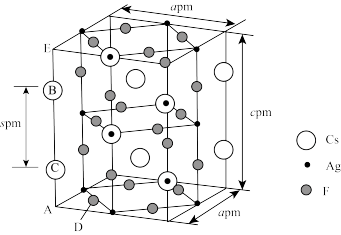
已知AC=BE,则C、D(Cs与F)间的距离为___________ pm(用含a、c、s的代数式表示,列出计算式,下同);设NA为阿伏加德罗常数的值,则晶体的密度为___________ g·cm-3。
(1)基态氟原子的价层电子排布图为
(2)制备NSF3的反应为FCONSF2+2AgF2
 NSF3+2AgF+COF2。
NSF3+2AgF+COF2。①F、O、N、S的第一电离能从小到大的顺序是
②COF2分子的空间构型为
③NSF3、COF2的沸点依次为-27.1°C、-84.6°C,前者沸点较高的原因是
(3)NHF2的一种制备方法是CO(NH2)2+2F2+H2O=NHF2+CO2+NH4HF2。
①CO(NH2)2中C的杂化方式是
②CO(NH2)2的熔沸点比CH3CONH2的高,其原因是
③下列说法正确的是
A.NHF2、CO2均是极性分子
B.CO2与
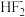 互为等电子体
互为等电子体C.H2O与NHF2中心原子的价层电子对数相同
D.NH4HF2中存在离子键、配位键和氢键
(4)由Cs、Ag及F三种元素组成的一种超导材料的晶体结构如下图所示(Ag不是+1价):

已知AC=BE,则C、D(Cs与F)间的距离为
您最近一年使用:0次
解题方法
9 . 碳是地球上组成生命的最基本元素之一 ,不仅能形成丰富多彩的有机化合物,还能形成多种无机化合物,碳及其化合物的用途广泛。根据要求回答下列问题:
(1)在基态14C原子中,核外存在_______ 对自旋相反的电子;第二周期的元素中,第一电离能介于B和C之间的是_______ (写 元素符号)。
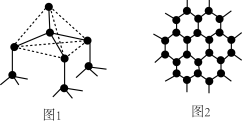
(2)下图中分别代表了碳单质的两种常见晶体,图1晶体中C原子的杂化方式为_______ ,图2晶体中,每个六元环占有_______ 个C原子。
(3)碳可以形成多种有机化合物,如图3所示是一种吡咯的结构,分子中所有原子都在一个平面上。吡咯中所有元素的电负性由大到小的顺序为_______ 。
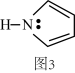
(4)碳可形成CO、CO2等多种无机化合物,在CO转化成CO2的反应过程中,下列说法正确的是_______。
(5)中外科学家团队共同合成了碳的一种新型同素异形体: T- 碳。T-碳的结构是:将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代,形成碳的一种新型三维立方晶体结构(如图4)。已知T-碳晶胞参数为apm,阿伏加德罗常数为NA,则T-碳的密度为_______ g· cm -3(列出计算式)。

(1)在基态14C原子中,核外存在
(2)下图中分别代表了碳单质的两种常见晶体,图1晶体中C原子的杂化方式为

(3)碳可以形成多种有机化合物,如图3所示是一种吡咯的结构,分子中所有原子都在一个平面上。吡咯中所有元素的电负性由大到小的顺序为

(4)碳可形成CO、CO2等多种无机化合物,在CO转化成CO2的反应过程中,下列说法正确的是_______。
| A.分子极性发生变化 | B.分子中孤对电子数不变 |
| C.原子间成键方式改变 | D.分子的熔沸点升高 |

您最近一年使用:0次
解题方法
10 . 在元素周期表中,铜副族(IB族)包括铜、银、金等元素,在生产、生活和科研中都有着广泛用途和重要的研究价值。
(1)Ag元素在元素周期表分区中属于_______ 区,基态Ag原子的价电子排布式为_______ 。
(2)硫代硫酸银(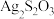 )是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠(
)是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠( )溶液生成
)溶液生成 等络阴离子。
等络阴离子。
①依据 理论推测
理论推测 的空间构型为
的空间构型为_______ ,中心原子S的杂化方式为_______ 。
②在 中配位原子是S原子而非O原子,其原因是
中配位原子是S原子而非O原子,其原因是_______ 。
(3)碘化银常用于做人工增雨剂。其中碘元素形成的最高价氧化物对应水化物有 (偏高碘酸,不稳定)和
(偏高碘酸,不稳定)和 (正高碘酸)等多种形式,它们的酸性
(正高碘酸)等多种形式,它们的酸性
_______  (填“弱于”、“等于”或“强于”)。而
(填“弱于”、“等于”或“强于”)。而 、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是
、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是_______ 。
(4)在离子晶体中,当 (阳离子)∶r(阴离子)
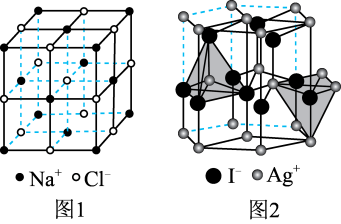
(阳离子)∶r(阴离子) 时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知
时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知 ,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为
,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为_______ ,造成AgI晶体结构不同于NaCl晶体结构的原因不可能是_______ (填标号)。
a.几何因素 b.电荷因素 c.键性因素
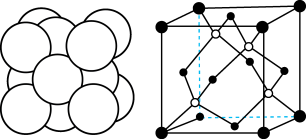
(5)Cu与Au的某种合金可形成面心立方最密堆积的晶体(密度为 ),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为
),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为_______ ;若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______ (储氢能力 )
)
(1)Ag元素在元素周期表分区中属于
(2)硫代硫酸银(
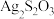 )是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠(
)是微溶于水的白色化合物,它能溶于过量的硫代硫酸钠( )溶液生成
)溶液生成 等络阴离子。
等络阴离子。①依据
 理论推测
理论推测 的空间构型为
的空间构型为②在
 中配位原子是S原子而非O原子,其原因是
中配位原子是S原子而非O原子,其原因是(3)碘化银常用于做人工增雨剂。其中碘元素形成的最高价氧化物对应水化物有
 (偏高碘酸,不稳定)和
(偏高碘酸,不稳定)和 (正高碘酸)等多种形式,它们的酸性
(正高碘酸)等多种形式,它们的酸性
 (填“弱于”、“等于”或“强于”)。而
(填“弱于”、“等于”或“强于”)。而 、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是
、HBr、HCl的水溶液酸性的排序为由强到弱,其结构原因是(4)在离子晶体中,当
 (阳离子)∶r(阴离子)
(阳离子)∶r(阴离子) 时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知
时,AB型化合物往往采用和NaCl晶体相同的晶体结构(如下图1)。已知 ,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为
,但在室温下,AgI的晶体结构如下图2所示,称为六方碘化银。I-的配位数为a.几何因素 b.电荷因素 c.键性因素

(5)Cu与Au的某种合金可形成面心立方最密堆积的晶体(密度为
 ),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为
),在该晶胞中Cu原子处于面心,用NA表示阿伏加德罗常数的值。该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的立方体空隙中,储氢后的晶胞结构与金刚石晶胞结构(如图)相似,该晶体储氢后的化学式为 )
)
您最近一年使用:0次
2022-04-25更新
|
1258次组卷
|
4卷引用:河南省南阳市2021-2022学年高二下学期期末考试化学试题
河南省南阳市2021-2022学年高二下学期期末考试化学试题内蒙古包头市2022届高三第二次模拟考试理综试卷化学试题(已下线)押全国卷理综第35题 物质结构与性质-备战2022年高考化学临考题号押题(课标全国卷)(已下线)【直抵名校】01-备战2022年高考化学名校进阶模拟卷(通用版)



