1 . VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)S单质的常见形式是S8,其环状结构如图所示,S原子采用的轨道杂化方式是_______ ;

(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为_______ ;
(3)Se的核外M层电子的排布式为_______ ;
(4)H2Se的酸性比 H2S_______ (填“强”或“弱”)。
(5)H2SeO3的K1和K2分别是2.7×10-3和2.5×10-8,H2SeO4的第一步几乎完全电离,K2是1.2×10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4的第一步电离程度大于第二步电离的原因:_______ ;
②H2SeO4比H2SeO3酸性强的原因:_______ 。
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示, 其晶胞边长为540.0pm,密度为_______ g • cm-3(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为_______ pm(列式表示)

(1)S单质的常见形式是S8,其环状结构如图所示,S原子采用的轨道杂化方式是

(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为
(3)Se的核外M层电子的排布式为
(4)H2Se的酸性比 H2S
(5)H2SeO3的K1和K2分别是2.7×10-3和2.5×10-8,H2SeO4的第一步几乎完全电离,K2是1.2×10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4的第一步电离程度大于第二步电离的原因:
②H2SeO4比H2SeO3酸性强的原因:
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示, 其晶胞边长为540.0pm,密度为

您最近一年使用:0次
名校
2 . 氮、磷、砷、铁、钛等元素及其化合物在现代农业、科技和国防建设中有着许多独特的用途。 是新型锂离子电池的电极材料,可采用
是新型锂离子电池的电极材料,可采用 、
、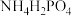 、
、 和苯胺等作为原料制备。
和苯胺等作为原料制备。
(1)基态P原子的价层电子排布图为_______ ,其基态原子核外电子共有_______ 种空间运动状态, 分子的空间结构为
分子的空间结构为_______ 。
(2)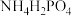 中,除磷元素外,其余三种元素电负性由大到小的顺序是
中,除磷元素外,其余三种元素电负性由大到小的顺序是_______ (填元素符号),N、P和S第一电离能由大到小的顺序是_______ (填元素符号)。
(3)苯胺和甲苯相对分子质量接近,但苯胺熔点比甲苯的高,原因是_______ 。
(4)与 同族的
同族的 可形成一种化学式为
可形成一种化学式为 的配合物,
的配合物, 的内界中含有
的内界中含有 键的数目为
键的数目为_______ (设 为阿代加德罗常数的值)。
为阿代加德罗常数的值)。
(5)钙钛矿晶体的晶胞结构如图所示。若该晶体的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶胞边长
,则晶胞边长
_______  (列出计算式,用
(列出计算式,用 表示)。
表示)。

 是新型锂离子电池的电极材料,可采用
是新型锂离子电池的电极材料,可采用 、
、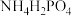 、
、 和苯胺等作为原料制备。
和苯胺等作为原料制备。(1)基态P原子的价层电子排布图为
 分子的空间结构为
分子的空间结构为(2)
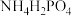 中,除磷元素外,其余三种元素电负性由大到小的顺序是
中,除磷元素外,其余三种元素电负性由大到小的顺序是(3)苯胺和甲苯相对分子质量接近,但苯胺熔点比甲苯的高,原因是
(4)与
 同族的
同族的 可形成一种化学式为
可形成一种化学式为 的配合物,
的配合物, 的内界中含有
的内界中含有 键的数目为
键的数目为 为阿代加德罗常数的值)。
为阿代加德罗常数的值)。(5)钙钛矿晶体的晶胞结构如图所示。若该晶体的密度为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶胞边长
,则晶胞边长
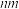 (列出计算式,用
(列出计算式,用 表示)。
表示)。
您最近一年使用:0次
解题方法
3 . ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)基态O原子电子占据最高能级的电子云轮廓图为_______ 形。
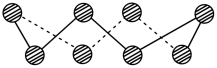
(2)S单质的常见形式为 ,其环状结构如图所示,S原子的杂化轨道类型是
,其环状结构如图所示,S原子的杂化轨道类型是_______ 。
(3)基态Se原子的核外电子排布式为_______ 。
(4)S、Se、Te三种元素电负性由大到小的顺序是_______ ,三种元素氢化物水溶液的酸性最强的是_______ (填化学式)。
(5) 分子中共价键的类型是
分子中共价键的类型是_______ ,常温下 是气体而
是气体而 是液体的原因是
是液体的原因是_______ 。
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,S周围紧邻且等距的Zn有_______ 个。晶胞棱长为a pm,密度为_______  (NA表示阿伏加德罗常数的值)。
(NA表示阿伏加德罗常数的值)。

(1)基态O原子电子占据最高能级的电子云轮廓图为
(2)S单质的常见形式为
 ,其环状结构如图所示,S原子的杂化轨道类型是
,其环状结构如图所示,S原子的杂化轨道类型是
(3)基态Se原子的核外电子排布式为
(4)S、Se、Te三种元素电负性由大到小的顺序是
(5)
 分子中共价键的类型是
分子中共价键的类型是 是气体而
是气体而 是液体的原因是
是液体的原因是(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,S周围紧邻且等距的Zn有
 (NA表示阿伏加德罗常数的值)。
(NA表示阿伏加德罗常数的值)。
您最近一年使用:0次
4 . 1797年法国化学家沃克兰从当时称为红色西伯利亚矿石中发现了铬,后期人类发现铬元素在其他方面有重要用途。“中国制造2025”是中国政府实施制造强国战略第一个十年行动纲领,铬及其化合物扮演着重要角色。
(1)氮化铬(CrN)具有极高的硬度和力学强度、优异的抗腐蚀性能和高温稳定性能,氮化铬在现代工业中发挥更重要的作用。
①请写出Cr3+的外围电子排布式___ 。
②氮化铬的晶体类型与氯化钠相同,但氮化铬熔点(1282℃)比氯化钠(801℃)的高,主要原因是___ 。
(2)Cr3+可与很多分子或离子形成配合物。
①KSCN可制备配合物[Cr(NH3)6][Cr(SCN)6],该配合物中铬元素的化合价为___ ;已知中心离子杂化时优先选择能量低的轨道参与杂化,使得配合物能量降低,物质更稳定,则该配合物中心离子杂化方式为___ ;晶体场理论认为,基态离子的d轨道存在未成对电子时,d电子发生d—d跃迁是金属阳离子在水溶液中显色的主要原因。试判断该配合物[Cr(NH3)6][Cr(SCN)6]是否有色___ (填“是”或“否”)。
②Cr3+的一种配合物结构如图,配合物中Cr3+的配位数为___ 。

(3)铬的一种氧化物的晶胞结构如图所示,其中氧离子与晶体镁堆积方式一致,铬离子在其八面体空隙中(如CrA在O1、O2、O3、O4、O5、O6构成的八面体空隙中)。

①该氧化物的化学式为____ 。
②该晶胞有____ %八面体空隙填充阳离子。
③已知氧离子半径为aÅ,晶胞的高为bÅ,NA代表阿伏加德罗常数的值,该晶体的密度为___ g•cm-3。(用含a、b和NA的代数式表示,已知Å= nm)
nm)
(1)氮化铬(CrN)具有极高的硬度和力学强度、优异的抗腐蚀性能和高温稳定性能,氮化铬在现代工业中发挥更重要的作用。
①请写出Cr3+的外围电子排布式
②氮化铬的晶体类型与氯化钠相同,但氮化铬熔点(1282℃)比氯化钠(801℃)的高,主要原因是
(2)Cr3+可与很多分子或离子形成配合物。
①KSCN可制备配合物[Cr(NH3)6][Cr(SCN)6],该配合物中铬元素的化合价为
②Cr3+的一种配合物结构如图,配合物中Cr3+的配位数为

(3)铬的一种氧化物的晶胞结构如图所示,其中氧离子与晶体镁堆积方式一致,铬离子在其八面体空隙中(如CrA在O1、O2、O3、O4、O5、O6构成的八面体空隙中)。

①该氧化物的化学式为
②该晶胞有
③已知氧离子半径为aÅ,晶胞的高为bÅ,NA代表阿伏加德罗常数的值,该晶体的密度为
 nm)
nm)
您最近一年使用:0次
名校
解题方法
5 . 铜及其化合物在科学研究和工业生产中具有许多用途。回答下列问题:
(1) 中阳离子的基态核外电子排布式为
中阳离子的基态核外电子排布式为___________ ;Cu和Ni在元素周期表中的位置相邻,Ni在元素周期表中的位置是___________ 。
(2)将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体 。乙醇分子中C原子的杂化轨道类型为
。乙醇分子中C原子的杂化轨道类型为___________ ; 能与
能与 以配位键形成
以配位键形成 ,则
,则 的空间构型是
的空间构型是___________ 。 中存在的化学键除了极性共价键外,还有
中存在的化学键除了极性共价键外,还有___________ 。 极易溶于水的原因主要有两个,一是
极易溶于水的原因主要有两个,一是___________ ,二是___________ 。
(3) 溶液中加入过量KCN溶液能生成配离子
溶液中加入过量KCN溶液能生成配离子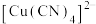 ,1mol
,1mol  中含有的
中含有的 键数目为
键数目为___________ ,与 互为等电子体的离子有
互为等电子体的离子有___________ 写出一种即可。
(4)已知ZnS的晶胞如图所示, 的配位数为
的配位数为___________ 。若晶体密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶胞参数为
,则晶胞参数为___________ (用含 、
、 的代数式表示)nm。
的代数式表示)nm。

(1)
 中阳离子的基态核外电子排布式为
中阳离子的基态核外电子排布式为(2)将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体
 。乙醇分子中C原子的杂化轨道类型为
。乙醇分子中C原子的杂化轨道类型为 能与
能与 以配位键形成
以配位键形成 ,则
,则 的空间构型是
的空间构型是 中存在的化学键除了极性共价键外,还有
中存在的化学键除了极性共价键外,还有 极易溶于水的原因主要有两个,一是
极易溶于水的原因主要有两个,一是(3)
 溶液中加入过量KCN溶液能生成配离子
溶液中加入过量KCN溶液能生成配离子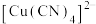 ,1mol
,1mol  中含有的
中含有的 键数目为
键数目为 互为等电子体的离子有
互为等电子体的离子有(4)已知ZnS的晶胞如图所示,
 的配位数为
的配位数为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶胞参数为
,则晶胞参数为 、
、 的代数式表示)nm。
的代数式表示)nm。
您最近一年使用:0次
名校
解题方法
6 . 氮的相关化合物在材料等方面有重要用途。回答下列问题:
(1)基态N原子的核外电子排布式为_______ ,第一电离能:I1(N)_______ I1(O)(填“大于”或“小于”)。
(2)N及其同族的P、As均可形成类似的氢化物,NH3、PH3、AsH3的沸点由高到低的顺序为_______ (填化学式)。
(3)[N5]+[AsF6]-是一种全氮阳离子形成的高能物质,其结构如图所示,其中N原子的杂化轨道类型为_______ 。

(4)科学家近期首次合成了具有极性对称性的氮化物钙钛矿材料-LaWN3,其立方晶胞结构如图所示,晶胞中La、W、N分别处于顶角、体心、面心位置,晶胞参数为a nm。

①La与N间的最短距离为_______ nm,与La紧邻的N个数为_______ 。
②在LaWN3晶胞结构的另一种表示中,W处于各顶角位置,则在新的晶胞中,La处于_______ 位置,N处于_______ 位置。
③设LaWN3的式量为Mr,阿伏加德罗常数的值为NA,则该晶体的密度为_______ g·cm-3(列出计算表达式)。
(1)基态N原子的核外电子排布式为
(2)N及其同族的P、As均可形成类似的氢化物,NH3、PH3、AsH3的沸点由高到低的顺序为
(3)[N5]+[AsF6]-是一种全氮阳离子形成的高能物质,其结构如图所示,其中N原子的杂化轨道类型为

(4)科学家近期首次合成了具有极性对称性的氮化物钙钛矿材料-LaWN3,其立方晶胞结构如图所示,晶胞中La、W、N分别处于顶角、体心、面心位置,晶胞参数为a nm。

①La与N间的最短距离为
②在LaWN3晶胞结构的另一种表示中,W处于各顶角位置,则在新的晶胞中,La处于
③设LaWN3的式量为Mr,阿伏加德罗常数的值为NA,则该晶体的密度为
您最近一年使用:0次
2022-04-22更新
|
1259次组卷
|
4卷引用:化学-2022年高考押题预测卷03(天津卷)
(已下线)化学-2022年高考押题预测卷03(天津卷)广东省广州市2022届高三下学期二模综合测试化学试题广东省茂名高州市校际联盟2021-2022学年高二5月联考化学试题江西省景德镇一中2022-2023学年高二上学期期中考试化学试题



