1 . 钛和锆为同族的元素,它们形成的化合物用途广泛。
(1)锆为第五周期元素,基态原子的价层电子排布式为_______ 。
(2)钛与EDTA(乙二胺四乙酸根离子,结构如图1)形成的配位离子如图2所示。
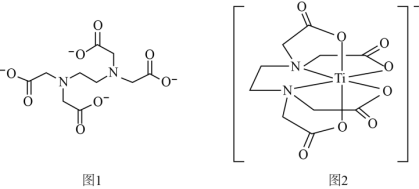
①EDTA中所含元素的电负性从大到小的顺序为_______ ;
②EDTA中键角∠NCC_______ (填“>”、“<”或“=”)∠CNC;
③钛与EDTA形成的配位离子中配位数为_______ 。
(3)常温下TiCl4为液体,ZrCl4为易升华的固体。两者熔点不同的原因是_______ 。
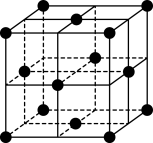
(4)ZrO2是制作全瓷牙的主要原料。ZrO2的晶体有立方晶相(如图3)、单斜晶相(如图4,微粒未画出,微粒分布与立方晶相相似,晶胞参数α=γ=900≠β,apm、bpm、cpm)等。
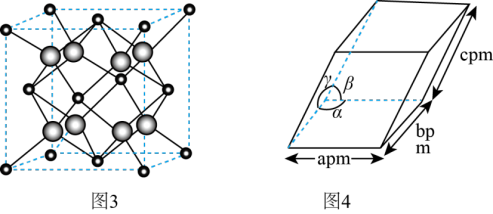
①ZrO2立方晶相中,与Zr等距离且最近的O围成的几何图形是_______ 。
②设阿伏加德罗常数的值为NA,则单斜晶相ZrO2的密度为_______ g·cm-3(列出含字母的计算表达式)。
(1)锆为第五周期元素,基态原子的价层电子排布式为
(2)钛与EDTA(乙二胺四乙酸根离子,结构如图1)形成的配位离子如图2所示。

①EDTA中所含元素的电负性从大到小的顺序为
②EDTA中键角∠NCC
③钛与EDTA形成的配位离子中配位数为
(3)常温下TiCl4为液体,ZrCl4为易升华的固体。两者熔点不同的原因是
(4)ZrO2是制作全瓷牙的主要原料。ZrO2的晶体有立方晶相(如图3)、单斜晶相(如图4,微粒未画出,微粒分布与立方晶相相似,晶胞参数α=γ=900≠β,apm、bpm、cpm)等。

①ZrO2立方晶相中,与Zr等距离且最近的O围成的几何图形是
②设阿伏加德罗常数的值为NA,则单斜晶相ZrO2的密度为
您最近一年使用:0次
名校
2 . 氯化铵是“侯氏制碱法”的副产品,在工农业生产中具有重要用途。回答下列问题:
(1)氯化铵的立方晶胞结构如图所示:

①与 等距离且最近的Cl-有
等距离且最近的Cl-有_______ 个。
②若氯化铵的密度为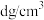 ,设
,设 为阿伏加德罗常数的值,则晶胞参数a=
为阿伏加德罗常数的值,则晶胞参数a=_______ nm(用含d、 的代数式表示)。
的代数式表示)。
(2)常温下,用 计测得某
计测得某 溶液的
溶液的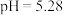 。
。
①用离子方程式表示 溶液呈酸性的原因:
溶液呈酸性的原因:____________ 。
②若溶液中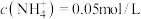 ,则水解常数
,则水解常数
_______ (提示: 和
和 的物质的量浓度几乎相等,
的物质的量浓度几乎相等,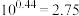 。结果保留2位有效数字)。
。结果保留2位有效数字)。
(3)为探究溶液浓度和 浓度对氯化铵水解的影响,学习小组利用
浓度对氯化铵水解的影响,学习小组利用 溶液和
溶液和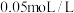 的
的 溶液,按下表配制总体积相同的系列溶液。测定
溶液,按下表配制总体积相同的系列溶液。测定 ,记录数据。
,记录数据。
①补充表中数据:a=_______ 。
②由实验I和II可知,稀释 溶液,
溶液,_______ (填“促进"或“抑制”) 水解,结合表中数据,给出判断理由:
水解,结合表中数据,给出判断理由:_______
③结合表中数据分析 增大,
增大, 水解程度
水解程度_______ (填“增大”、“减小”或“不变”)。
④画出稀释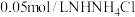 溶液时,
溶液时, 随加入水量的变化曲线图
随加入水量的变化曲线图_______ ,标注出 的变化范围。
的变化范围。
(1)氯化铵的立方晶胞结构如图所示:

①与
 等距离且最近的Cl-有
等距离且最近的Cl-有②若氯化铵的密度为
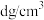 ,设
,设 为阿伏加德罗常数的值,则晶胞参数a=
为阿伏加德罗常数的值,则晶胞参数a= 的代数式表示)。
的代数式表示)。(2)常温下,用
 计测得某
计测得某 溶液的
溶液的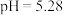 。
。①用离子方程式表示
 溶液呈酸性的原因:
溶液呈酸性的原因:②若溶液中
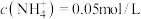 ,则水解常数
,则水解常数
 和
和 的物质的量浓度几乎相等,
的物质的量浓度几乎相等,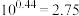 。结果保留2位有效数字)。
。结果保留2位有效数字)。(3)为探究溶液浓度和
 浓度对氯化铵水解的影响,学习小组利用
浓度对氯化铵水解的影响,学习小组利用 溶液和
溶液和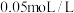 的
的 溶液,按下表配制总体积相同的系列溶液。测定
溶液,按下表配制总体积相同的系列溶液。测定 ,记录数据。
,记录数据。| 序号 | 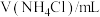 |  | 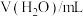 |  |
| I | 20 | 0 | 0 | 5.28 |
| II | 2 | 0 | 18 | 5.78 |
| III | 2 | a | 16 | 5.78 |
| IV | 2 | 10 | 8 | 5.78 |
②由实验I和II可知,稀释
 溶液,
溶液, 水解,结合表中数据,给出判断理由:
水解,结合表中数据,给出判断理由:③结合表中数据分析
 增大,
增大, 水解程度
水解程度④画出稀释
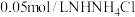 溶液时,
溶液时, 随加入水量的变化曲线图
随加入水量的变化曲线图 的变化范围。
的变化范围。
您最近一年使用:0次
2022-08-05更新
|
225次组卷
|
2卷引用:福建省福安市第一中学2023届高三上学期开学考试化学试题
名校
解题方法
3 . 前四周期元素及其化合物有丰富的理化性质及用途,回答下列问题:
(1)基态氟原子核外电子的运动状态有_______ 种。
(2)氮元素的第一电离能在同周期主族元素中从大到小排第_______ 位,N原子和H原子可以形成多种微粒,如:NH3、NH 、NH
、NH 、N2H4、N2H
、N2H4、N2H 、N2H
、N2H 等,在N2H
等,在N2H 中N原子的杂化方式为
中N原子的杂化方式为_______ 。
(3)已知金刚石中的C-C键键长为154.45pm,C60中C-C键的键长为140~145pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确_______ (填“是”或“否”),并阐述理由: _______ ;
(4)LiFePO4、LiPF6、LiAsF6和LiCl等可作为聚乙二醇锂离子电池的电极材料。电池放电时,Li+沿聚乙二醇分子中的碳氧链向正极迁移的过程如图所示(图中阴离子未画出)。

相同条件下,电极材料_______ (填“LiPF6”或“LiAsF6”)中的Li+迁移较快,原因是:_______ 。
(5)某金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为Li+,阴离子是由12个硼原子和12个氢原子所构成的离子团。阴离子在晶胞中的位置如图所示,Li+占据阴离子组成的所有正四面体空隙中心,该化合物的化学式为_______ (用最简整数比表示)。
(1)基态氟原子核外电子的运动状态有
(2)氮元素的第一电离能在同周期主族元素中从大到小排第
 、NH
、NH 、N2H4、N2H
、N2H4、N2H 、N2H
、N2H 等,在N2H
等,在N2H 中N原子的杂化方式为
中N原子的杂化方式为(3)已知金刚石中的C-C键键长为154.45pm,C60中C-C键的键长为140~145pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确
(4)LiFePO4、LiPF6、LiAsF6和LiCl等可作为聚乙二醇锂离子电池的电极材料。电池放电时,Li+沿聚乙二醇分子中的碳氧链向正极迁移的过程如图所示(图中阴离子未画出)。

相同条件下,电极材料
(5)某金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为Li+,阴离子是由12个硼原子和12个氢原子所构成的离子团。阴离子在晶胞中的位置如图所示,Li+占据阴离子组成的所有正四面体空隙中心,该化合物的化学式为

您最近一年使用:0次
名校
4 . 铜及其化合物有广泛的用途。回答下列问题:
(1)同周期元素中,与Cu最外层电子数相同的元素还有___________ 种。
(2)往 中逐滴加入氨水至沉淀恰好溶解,将该溶液冷却结晶,得到蓝色晶体。
中逐滴加入氨水至沉淀恰好溶解,将该溶液冷却结晶,得到蓝色晶体。
①该晶体中各元素电负性由大到小顺序为___________ ;
②该晶体中不存在的作用力为___________ 。
A.离子键 B.氢键 C.金属键 D.σ键 E.范德华力 F.配位键
③已知 分子中键角为107°,则上述晶体中氮氢之间的键角
分子中键角为107°,则上述晶体中氮氢之间的键角___________ 107°(填选项标号)。
A.大于 B.小于 C.等于 D.无法确定
(3)已知铜的某些化合物的熔点如表所示。三者熔点出现差异的原因是:___________ 。
(4)溴化亚铜(CuBr)常用作有机合成原料和反应催化剂,其晶胞结构如下图所示。

已知①、②号铜原子坐标分数依次为(0,0,0)、( ,
, ,0),则③号溴原子的坐标分数为
,0),则③号溴原子的坐标分数为_______ ;设CuBr的密度为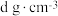 ,
, ,
, 为阿伏加德罗常数,则Cu原子与Br原子的核间距离为
为阿伏加德罗常数,则Cu原子与Br原子的核间距离为________ cm(用含a、d、 的代数式表示)。
的代数式表示)。
(1)同周期元素中,与Cu最外层电子数相同的元素还有
(2)往
 中逐滴加入氨水至沉淀恰好溶解,将该溶液冷却结晶,得到蓝色晶体。
中逐滴加入氨水至沉淀恰好溶解,将该溶液冷却结晶,得到蓝色晶体。①该晶体中各元素电负性由大到小顺序为
②该晶体中不存在的作用力为
A.离子键 B.氢键 C.金属键 D.σ键 E.范德华力 F.配位键
③已知
 分子中键角为107°,则上述晶体中氮氢之间的键角
分子中键角为107°,则上述晶体中氮氢之间的键角A.大于 B.小于 C.等于 D.无法确定
(3)已知铜的某些化合物的熔点如表所示。三者熔点出现差异的原因是:
| CuO | CuS | CuSe | |
| 熔点(℃) | 1326 | 220 | 387 |
(4)溴化亚铜(CuBr)常用作有机合成原料和反应催化剂,其晶胞结构如下图所示。

已知①、②号铜原子坐标分数依次为(0,0,0)、(
 ,
, ,0),则③号溴原子的坐标分数为
,0),则③号溴原子的坐标分数为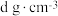 ,
, ,
, 为阿伏加德罗常数,则Cu原子与Br原子的核间距离为
为阿伏加德罗常数,则Cu原子与Br原子的核间距离为 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2022-03-05更新
|
489次组卷
|
2卷引用:福建省龙岩市2022届高三下学期第一次教学质量检测化学试题
名校
5 . 过渡金属铬、铅、镍、铁及其化合物在工业上有重要用途,回答下列问题:
(1)Cr基态原子价电子的轨道表示式___________ 。
(2)氮化铬(CrN)在超级电容器领域具有良好的应用前景,可由CrCl3·6H2O与尿素[(NH2)2CO]反应先得到配合物{Cr[OC(NH2)2]6}Cl3,然后在通有NH3和N2混合气体的反应炉内热分解制得。
①尿素中C、N、O三种元素的第一电离能由大到小的顺序为___________ 。
②{Cr[OC(NH2)2]6}3+中存在的化学键有___________ (填标号)
A.极性共价键 B.非极性共价键 C.氢键
D.配位键 E.金属键 F.离子键
(3)四卤化硅SiX4的沸点和二卤化铅PbX2的熔点如图所示。
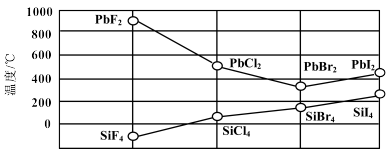
①SiX4的沸点依F、Cl、 Br、I次序升高的原因是_____ 。
②结合SiX4的沸点和PbX2的熔点的变化规律,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性___________ 、共价性___________ 。(填“增强”、“减弱”或“不变”)。
(4)丁二酮肟常与Ni2+形成图A所示的配合物,图B是硫代氧的结果:
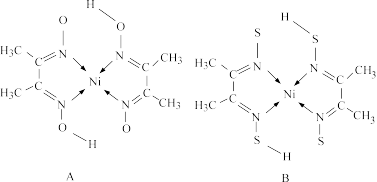
A的熔、沸点高于B的原因为___________ 。
(5)某FexNy的晶胞如图1所示。Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n) CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为_____ 。

(1)Cr基态原子价电子的轨道表示式
(2)氮化铬(CrN)在超级电容器领域具有良好的应用前景,可由CrCl3·6H2O与尿素[(NH2)2CO]反应先得到配合物{Cr[OC(NH2)2]6}Cl3,然后在通有NH3和N2混合气体的反应炉内热分解制得。
①尿素中C、N、O三种元素的第一电离能由大到小的顺序为
②{Cr[OC(NH2)2]6}3+中存在的化学键有
A.极性共价键 B.非极性共价键 C.氢键
D.配位键 E.金属键 F.离子键
(3)四卤化硅SiX4的沸点和二卤化铅PbX2的熔点如图所示。

①SiX4的沸点依F、Cl、 Br、I次序升高的原因是
②结合SiX4的沸点和PbX2的熔点的变化规律,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性
(4)丁二酮肟常与Ni2+形成图A所示的配合物,图B是硫代氧的结果:

A的熔、沸点高于B的原因为
(5)某FexNy的晶胞如图1所示。Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n) CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为

您最近一年使用:0次
解题方法
6 . I.氮(N)、磷(P)、砷(As)等第VA族元素的单质和化合物在科研与生产中有许多重要用途。回答下列问题:
(1)基态砷原子的价电子排布式为_________ ,电负性:As_________ S(填“>”“=”或“<”)。
(2) 中N原子的杂化方式是
中N原子的杂化方式是_________ 杂化。
(3) 、聚乙二醇、
、聚乙二醇、 、
、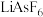 和
和 等可作锂离子聚合物电池的材料。电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图所示(图中阴离子未画出)。
等可作锂离子聚合物电池的材料。电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图所示(图中阴离子未画出)。
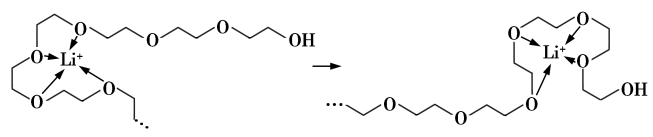
从化学键角度看,Li+迁移过程发生_________ (填“物理”或“化学”)变化。
II.铂钴合金在磁控、仪表等领域有重要用途。回答下列问题:
(4)Pt与Cl、吡啶( )能形成如图所示两种分子。
)能形成如图所示两种分子。
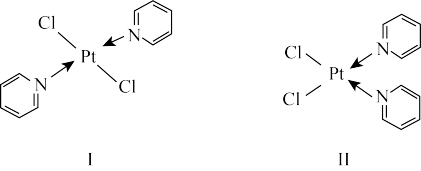
①1mol吡啶中含有σ键的数目为_________ 。
②相同条件下,化合物Ⅱ在水中溶解度比化合物Ⅰ更大的原因为_________ 。
(5)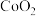 是一种磁性材料,其晶胞结构如图甲所示,俯视图如图乙所示。
是一种磁性材料,其晶胞结构如图甲所示,俯视图如图乙所示。
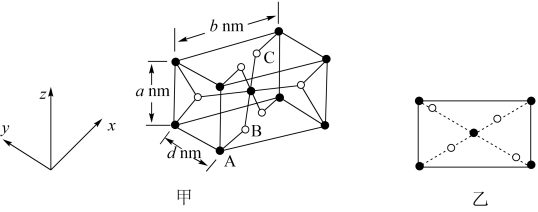
①原子坐标参数:A为(0,0,0);B为(0.31,0.31,0)。则C原子的坐标参数为_________ 。
②若阿伏加德罗常数的值为NA,则晶体密度为_________ g·cm−3(列出计算表达式)。
(1)基态砷原子的价电子排布式为
(2)
 中N原子的杂化方式是
中N原子的杂化方式是(3)
 、聚乙二醇、
、聚乙二醇、 、
、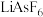 和
和 等可作锂离子聚合物电池的材料。电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图所示(图中阴离子未画出)。
等可作锂离子聚合物电池的材料。电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图所示(图中阴离子未画出)。
从化学键角度看,Li+迁移过程发生
II.铂钴合金在磁控、仪表等领域有重要用途。回答下列问题:
(4)Pt与Cl、吡啶(
 )能形成如图所示两种分子。
)能形成如图所示两种分子。
①1mol吡啶中含有σ键的数目为
②相同条件下,化合物Ⅱ在水中溶解度比化合物Ⅰ更大的原因为
(5)
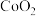 是一种磁性材料,其晶胞结构如图甲所示,俯视图如图乙所示。
是一种磁性材料,其晶胞结构如图甲所示,俯视图如图乙所示。
①原子坐标参数:A为(0,0,0);B为(0.31,0.31,0)。则C原子的坐标参数为
②若阿伏加德罗常数的值为NA,则晶体密度为
您最近一年使用:0次
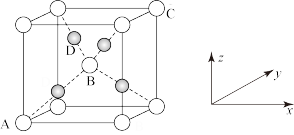
7 . 乙醛是一种化工原料,用途很广。检验乙醛中的醛基常用新制氢氧化铜悬浊液,反应方程式为: 。回答下列问题:
。回答下列问题:
(1)基态 的价电子轨道表示式为
的价电子轨道表示式为___________ ,基态氧原子的电子占据___________ 种能量不同的原子轨道。
(2)乙醛分子中C的杂化类型是___________ 。
(3)乙酸钠晶体中存在的微粒间作用力有___________(填标号)。
(4)生成的 晶胞结构如图所示,该晶胞中A原子代表
晶胞结构如图所示,该晶胞中A原子代表___________ 原子。该晶胞原子坐标参数A为(0,0,0),B为 ,C为(1,1,1),则D原子的坐标参数为
,C为(1,1,1),则D原子的坐标参数为___________ 。
 。回答下列问题:
。回答下列问题:(1)基态
 的价电子轨道表示式为
的价电子轨道表示式为(2)乙醛分子中C的杂化类型是
(3)乙酸钠晶体中存在的微粒间作用力有___________(填标号)。
| A.非极性键 | B.金属键 | C.范德华力 | D.离子键 |
 晶胞结构如图所示,该晶胞中A原子代表
晶胞结构如图所示,该晶胞中A原子代表 ,C为(1,1,1),则D原子的坐标参数为
,C为(1,1,1),则D原子的坐标参数为
您最近一年使用:0次
解题方法
8 . 铜及其化合物用途广泛。 溶液与乙二胺
溶液与乙二胺 可形成配离子
可形成配离子 (
(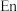 是乙二胺的简写):
是乙二胺的简写):

(1) 的价电子轨道表示式为:
的价电子轨道表示式为:_______ ;
(2)乙二胺和三甲胺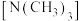 均属于胺,但乙二胺比三甲胺的沸点高的多,原因是
均属于胺,但乙二胺比三甲胺的沸点高的多,原因是_______ 。
(3)配离子 的配位数为
的配位数为_______ ,该微粒含有的微粒间的作用力类型有_______ (填字母);
A.配位键 B.极性键 C.离子键 D.非极性键 E.氢键 F.金属键
(4)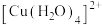 为平面正方形结构,其中的两个
为平面正方形结构,其中的两个 被
被 取代后有两种不同的结构,其中
取代后有两种不同的结构,其中 是非极性分子的结构式为
是非极性分子的结构式为_______ 。
(5)铜镍合金的立方晶胞结构如图所示,其中原子A的坐标参数为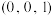 。
。

①原子B的坐标参数为_______
②)若该晶体密度为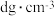 ,则铜镍原子间最短距离为
,则铜镍原子间最短距离为_______ cm。
 溶液与乙二胺
溶液与乙二胺 可形成配离子
可形成配离子 (
(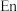 是乙二胺的简写):
是乙二胺的简写):
(1)
 的价电子轨道表示式为:
的价电子轨道表示式为:(2)乙二胺和三甲胺
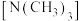 均属于胺,但乙二胺比三甲胺的沸点高的多,原因是
均属于胺,但乙二胺比三甲胺的沸点高的多,原因是(3)配离子
 的配位数为
的配位数为A.配位键 B.极性键 C.离子键 D.非极性键 E.氢键 F.金属键
(4)
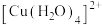 为平面正方形结构,其中的两个
为平面正方形结构,其中的两个 被
被 取代后有两种不同的结构,其中
取代后有两种不同的结构,其中 是非极性分子的结构式为
是非极性分子的结构式为(5)铜镍合金的立方晶胞结构如图所示,其中原子A的坐标参数为
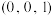 。
。
①原子B的坐标参数为
②)若该晶体密度为
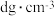 ,则铜镍原子间最短距离为
,则铜镍原子间最短距离为
您最近一年使用:0次
解题方法
9 . 硼(B)是一种用途广泛的化工原料矿物,主要用于生产硼砂、硼酸和硼的各种化合物。
(1)基态硼原子的核外电子轨道表示式:________ 。
(2)B、Be、Al三种原子按第一电离能由小到大的顺序排列为________ 。
(3)NaBH4是目前最常用的还原剂之一,主要由Na+和BH 组成。NaBH4溶于水后能够缓慢地与水反应产生氢气,NaBH4+4H2O=Na[B(OH)4]+4H2↑。
组成。NaBH4溶于水后能够缓慢地与水反应产生氢气,NaBH4+4H2O=Na[B(OH)4]+4H2↑。
①组成NaBH4的阴离子BH 中存在的微粒间作用力有
中存在的微粒间作用力有________ (填标号)。
a.σ键 b.离子键 c.π键 d.配位键
②[B(OH)4]-中,B原子的杂化轨道类型为________ 。
(4)研究发现,硼化镁迄今发现的临界温度最高的简单金属超导材料。其晶体结构与石墨类似,为分层排布(一层镁原子,一层硼原子)。如图是该晶体沿Z轴方向的投影,图中的硼原子和镁原子投影在同一平面上。

①硼化镁的化学式为________ 。
②晶体中,B原子的配位数为________ 。(即B原子周围距离最近的Mg原子的个数)
(1)基态硼原子的核外电子轨道表示式:
(2)B、Be、Al三种原子按第一电离能由小到大的顺序排列为
(3)NaBH4是目前最常用的还原剂之一,主要由Na+和BH
 组成。NaBH4溶于水后能够缓慢地与水反应产生氢气,NaBH4+4H2O=Na[B(OH)4]+4H2↑。
组成。NaBH4溶于水后能够缓慢地与水反应产生氢气,NaBH4+4H2O=Na[B(OH)4]+4H2↑。①组成NaBH4的阴离子BH
 中存在的微粒间作用力有
中存在的微粒间作用力有a.σ键 b.离子键 c.π键 d.配位键
②[B(OH)4]-中,B原子的杂化轨道类型为
(4)研究发现,硼化镁迄今发现的临界温度最高的简单金属超导材料。其晶体结构与石墨类似,为分层排布(一层镁原子,一层硼原子)。如图是该晶体沿Z轴方向的投影,图中的硼原子和镁原子投影在同一平面上。

①硼化镁的化学式为
②晶体中,B原子的配位数为
您最近一年使用:0次
名校
10 . 钛、铁、铜、钐等过渡金属有着广泛的用途。请回答下列问题:
(1)铁在元素周期表中的位置_______ ,基态铜原子的核外电子排布式为_______ 。
(2)配合物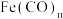 常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断
常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断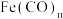 晶体属于
晶体属于_______ (填晶体类型)。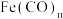 的中心原子价电子数与配体提供电子数之和为18,则n=
的中心原子价电子数与配体提供电子数之和为18,则n=_______ 。
(3) ]溶液可用于检验
]溶液可用于检验_______ (填离子符号)。 的四卤化物熔点如下表所示,
的四卤化物熔点如下表所示, 熔点高于其他三种卤化物,自
熔点高于其他三种卤化物,自 至
至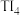 熔点依次升高,原因是
熔点依次升高,原因是_______ 。
(4)一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。
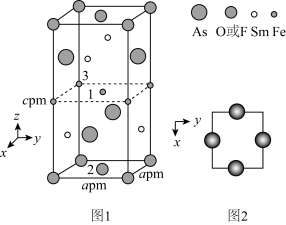
图中 和
和 共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,则该化合物的化学式表示为
共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,则该化合物的化学式表示为_____ ,通过测定密度 和晶胞参数,可以计算该物质的x值,完成它们关系表达式:
和晶胞参数,可以计算该物质的x值,完成它们关系表达式:
_______  。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(
。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为( ,
, ,
, ),则原子2和3的坐标分别为
),则原子2和3的坐标分别为______ 、_____ 。
(1)铁在元素周期表中的位置
(2)配合物
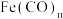 常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断
常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断 晶体属于
晶体属于 的中心原子价电子数与配体提供电子数之和为18,则n=
的中心原子价电子数与配体提供电子数之和为18,则n=(3)
 ]溶液可用于检验
]溶液可用于检验 的四卤化物熔点如下表所示,
的四卤化物熔点如下表所示, 熔点高于其他三种卤化物,自
熔点高于其他三种卤化物,自 至
至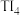 熔点依次升高,原因是
熔点依次升高,原因是| 化合物 |  |  |  |  |
| 熔点/C | 377 | -24.12 | 38.3 | 155 |
(4)一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。

图中
 和
和 共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,则该化合物的化学式表示为
共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,则该化合物的化学式表示为 和晶胞参数,可以计算该物质的x值,完成它们关系表达式:
和晶胞参数,可以计算该物质的x值,完成它们关系表达式:
 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(
。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为( ,
, ,
, ),则原子2和3的坐标分别为
),则原子2和3的坐标分别为
您最近一年使用:0次



