2022·浙江·模拟预测
解题方法
1 . 铜、钛、硼及其化合物有许多用途。回答下列问题:
(1)S、O、N三种元素的第一电离能由大到小的顺序为___________ , 中阴离子的空间构型为
中阴离子的空间构型为___________ 。
(2) 的熔点是
的熔点是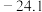 ℃,沸点是136.4℃,则固态
℃,沸点是136.4℃,则固态 属于
属于___________ 晶体。
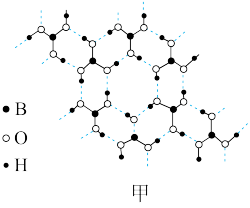
(3)基态硼原子的核外电子排布图为___________ ,硼酸的层状结构如图甲,其中B的杂化类型是___________ 。
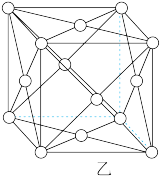
(4)铜的晶胞结构如图乙,铜原子的配位数为___________ ,若铜原子的半径为apm,则铜晶体的密度为___________  (写表达式即可)。
(写表达式即可)。
(1)S、O、N三种元素的第一电离能由大到小的顺序为
 中阴离子的空间构型为
中阴离子的空间构型为(2)
 的熔点是
的熔点是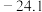 ℃,沸点是136.4℃,则固态
℃,沸点是136.4℃,则固态 属于
属于(3)基态硼原子的核外电子排布图为

(4)铜的晶胞结构如图乙,铜原子的配位数为
 (写表达式即可)。
(写表达式即可)。
您最近一年使用:0次
2 . 碳族化合物在研究和生产中有许多重要用途,请回答下列问题:
(1)已知 中硅元素为+4价,则H、Si、O、C的电负性由大到小的顺序为
中硅元素为+4价,则H、Si、O、C的电负性由大到小的顺序为_______ 。
(2)基态锗原子(Ge)价层电子的轨道表示式为_______ 。
(3)邻羟基苯甲酸的沸点比对羟基苯甲酸的沸点低;请解释其原因_______ 。
(4)氮化硅(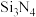 )是一种耐磨损、耐高温的结构陶瓷材料,其部分空间结构如图所示,其结构中每个原子杂化类型相同且均达到8电子稳定结构,请比较晶体结构中键角大小:N—Si—N
)是一种耐磨损、耐高温的结构陶瓷材料,其部分空间结构如图所示,其结构中每个原子杂化类型相同且均达到8电子稳定结构,请比较晶体结构中键角大小:N—Si—N_______ Si—N—Si(填“>”“<”“=”)。
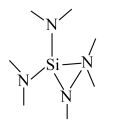
(5)某锂电池的负极材料是将锂原子嵌入到两层石墨烯层中间,其晶体结构如图。已知该晶体中最近的两个碳原子核间距离为a nm,石墨烯层间距离为b nm,则该晶体的密度为_______  (用
(用 表示阿伏加德罗常数,列式即可)。
表示阿伏加德罗常数,列式即可)。
(1)已知
 中硅元素为+4价,则H、Si、O、C的电负性由大到小的顺序为
中硅元素为+4价,则H、Si、O、C的电负性由大到小的顺序为(2)基态锗原子(Ge)价层电子的轨道表示式为
(3)邻羟基苯甲酸的沸点比对羟基苯甲酸的沸点低;请解释其原因
(4)氮化硅(
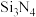 )是一种耐磨损、耐高温的结构陶瓷材料,其部分空间结构如图所示,其结构中每个原子杂化类型相同且均达到8电子稳定结构,请比较晶体结构中键角大小:N—Si—N
)是一种耐磨损、耐高温的结构陶瓷材料,其部分空间结构如图所示,其结构中每个原子杂化类型相同且均达到8电子稳定结构,请比较晶体结构中键角大小:N—Si—N
(5)某锂电池的负极材料是将锂原子嵌入到两层石墨烯层中间,其晶体结构如图。已知该晶体中最近的两个碳原子核间距离为a nm,石墨烯层间距离为b nm,则该晶体的密度为
 (用
(用 表示阿伏加德罗常数,列式即可)。
表示阿伏加德罗常数,列式即可)。
您最近一年使用:0次
名校
解题方法
3 . Ⅰ、由CO2、甲醇为原料合成绿色化学品碳酸二甲酯(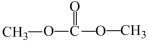 )的过程如图,请回答下列问题:
)的过程如图,请回答下列问题:
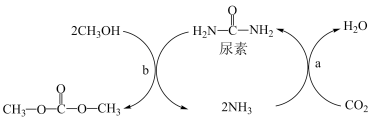
(1)下列说法不正确的是___________ (填字母)。
A.上述过程a中,从反应物到产物,C和N元素的杂化方式均保持不变
B.NH3极易溶解在水中,只因氨分子与水分子间形成了氢键
C.尿素的沸点比碳酸二甲酯的高,主要原因为前者能形成分子间氢键,而后者不能形成分子间氢键
Ⅱ、硫元素在化合物中常表现出多种化合价,它的许多化合物在研究和生产中有许多重要用途。回答下列问题:
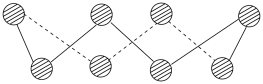
(2)S单质的常见形式为S8,其环状结构如图所示,S原子的杂化轨道类型是___________ 。
(3) 的电子式是
的电子式是___________ ,依据 理论推测
理论推测 的空间构型为
的空间构型为___________ ,常温下 是气体而
是气体而 是液体的原因是
是液体的原因是___________ 。
(4) 的键角
的键角___________  的键角(填“大于”或“小于”),理由是
的键角(填“大于”或“小于”),理由是___________ 。
(5) 在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方
在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方 晶体结构如图所示。
晶体结构如图所示。
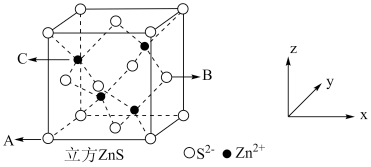
①已知A、B点的原子坐标分别为 和
和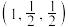 ,则C点的原子坐标为
,则C点的原子坐标为___________ ;
②若晶胞棱长为 ,密度为
,密度为___________  (
( 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
 )的过程如图,请回答下列问题:
)的过程如图,请回答下列问题:
(1)下列说法不正确的是
A.上述过程a中,从反应物到产物,C和N元素的杂化方式均保持不变
B.NH3极易溶解在水中,只因氨分子与水分子间形成了氢键
C.尿素的沸点比碳酸二甲酯的高,主要原因为前者能形成分子间氢键,而后者不能形成分子间氢键
Ⅱ、硫元素在化合物中常表现出多种化合价,它的许多化合物在研究和生产中有许多重要用途。回答下列问题:
(2)S单质的常见形式为S8,其环状结构如图所示,S原子的杂化轨道类型是

(3)
 的电子式是
的电子式是 理论推测
理论推测 的空间构型为
的空间构型为 是气体而
是气体而 是液体的原因是
是液体的原因是(4)
 的键角
的键角 的键角(填“大于”或“小于”),理由是
的键角(填“大于”或“小于”),理由是(5)
 在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方
在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方 晶体结构如图所示。
晶体结构如图所示。
①已知A、B点的原子坐标分别为
 和
和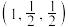 ,则C点的原子坐标为
,则C点的原子坐标为②若晶胞棱长为
 ,密度为
,密度为 (
( 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
您最近一年使用:0次
2022-09-05更新
|
351次组卷
|
6卷引用:浙江省舟山市定海第一中学2022-2023学年高三上学期9月月考化学试题
名校
解题方法
4 . 氟其化合物用途十分广泛,回答下列问题:
(1)CuF中Cu+的基态价电子排布式为___________ ,铜元素位于元素周期表___________ 区。
(2)已知Cu、Zn的第二电离能分别为1957.9kJ·mol-1、1733.3kJ·mol-1,前者高于后者的原因是___________ 。
(3)[H2F]+[SbF6]-(氟锑酸,是一种超强酸),阳离子[H2F]+的空间构型为___________ ,[H2F]+中F原子的杂化方式是___________ 。
(4)工业上电解Al2O3制取单质铝,常利用冰晶石Na3[AlF6]降低Al2O3的熔化温度。通常将Al(OH)3和Na2CO3一同溶于氢氟酸来制取冰晶石,反应时放出CO2气体,写出该反应的化学方程式___________ 。
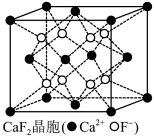
(5)CaF2的晶胞如下图所示,已知CaF2晶体的密度为ρg/cm3,相邻的两个Ca2+的最近核间距为apm,则CaF2的摩尔质量为___________ g/mol(列出代数式,设NA为阿伏加德罗常数的值)。
(1)CuF中Cu+的基态价电子排布式为
(2)已知Cu、Zn的第二电离能分别为1957.9kJ·mol-1、1733.3kJ·mol-1,前者高于后者的原因是
(3)[H2F]+[SbF6]-(氟锑酸,是一种超强酸),阳离子[H2F]+的空间构型为
(4)工业上电解Al2O3制取单质铝,常利用冰晶石Na3[AlF6]降低Al2O3的熔化温度。通常将Al(OH)3和Na2CO3一同溶于氢氟酸来制取冰晶石,反应时放出CO2气体,写出该反应的化学方程式
(5)CaF2的晶胞如下图所示,已知CaF2晶体的密度为ρg/cm3,相邻的两个Ca2+的最近核间距为apm,则CaF2的摩尔质量为

您最近一年使用:0次
2022-08-17更新
|
173次组卷
|
2卷引用:浙江省浦江中学、长兴中学、余杭高中2021-2022学年高二下学期三校联考(3月)化学试题
5 . 第VIII族元素Fe、Co、Ni性质相似,称为铁系元素,主要用于制造合金。试回答下列问题:
(1)按照电子排布,可把元素周期表中的元素划分成五个区,VIII族元素位于周期表中_______ 区;写出基态Co原子的价层电子排布式_______ ;Co3+的半径_______ Fe2+的半径(填“大 于”或“小于”),第四电离能I4(Co)<I4(Fe)的原因是_______ 。
(2)写出与Ni同周期元素中,基态原子未成对电子数与Ni相同的主族元素名称_______ 。Ni与CO在60~80℃时反应生成Ni(CO)4气体,在Ni(CO)4中与Ni形成配位键的原子是_______ ,Ni(CO)4晶体类型是_______ 。确定Ni(CO)4固体为晶体的最可靠方法是_______ 。某同学画出基态碳原子的核外电子排布图: ,该电子排布图违背了
,该电子排布图违背了_______ 。
(3)Fe3+与酚类物质的显色反应常用于其离子检验,已知Fe3+遇邻苯二酚( )和对苯二酚(
)和对苯二酚( )均显绿色。邻苯二酚的熔沸点比对苯二酚低的原因是
)均显绿色。邻苯二酚的熔沸点比对苯二酚低的原因是_______ ;已知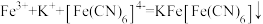 ,利用该离子方程式可以检验溶液中的Fe3+。
,利用该离子方程式可以检验溶液中的Fe3+。 中σ键、π键数目之比为
中σ键、π键数目之比为_______ 。
(4)某立方晶系的(Sb-Ni)合金用途广泛,下图为该合金的晶胞结构图:

①Ni和Sb原子数之比为_______ ;
②与Sb最邻近的Sb原子数为_______ 个。
(1)按照电子排布,可把元素周期表中的元素划分成五个区,VIII族元素位于周期表中
(2)写出与Ni同周期元素中,基态原子未成对电子数与Ni相同的主族元素名称
 ,该电子排布图违背了
,该电子排布图违背了(3)Fe3+与酚类物质的显色反应常用于其离子检验,已知Fe3+遇邻苯二酚(
 )和对苯二酚(
)和对苯二酚( )均显绿色。邻苯二酚的熔沸点比对苯二酚低的原因是
)均显绿色。邻苯二酚的熔沸点比对苯二酚低的原因是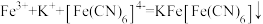 ,利用该离子方程式可以检验溶液中的Fe3+。
,利用该离子方程式可以检验溶液中的Fe3+。 中σ键、π键数目之比为
中σ键、π键数目之比为(4)某立方晶系的(Sb-Ni)合金用途广泛,下图为该合金的晶胞结构图:

①Ni和Sb原子数之比为
②与Sb最邻近的Sb原子数为
您最近一年使用:0次
解题方法
6 . 第VIII族元素Fe、Co、Ni性质相似,称为铁系元素,主要用于制造合金。请回答下列问题:
(1)第VIII族元素位于周期表中____ 区;Co3+的半径_____ Fe2+的半径(填“>”或“<”)。
(2)Ni与CO在60~80℃时反应生成Ni(CO)4气体,Ni(CO)4为____ 分子(填“极性”或“非极性”)。确定Ni(CO)4固体为晶体的最可靠方法是____ ;硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液,在[Ni(NH3)6]SO4中,阴离子的空间结构为____ 。
(3)Fe3+与酚类物质的显色反应常用于其离子检验,已知Fe3+遇邻苯二酚( )和对苯二酚(
)和对苯二酚( )均显色。二者碳原子的杂化类型为
)均显色。二者碳原子的杂化类型为____ ;邻苯二酚的沸点____ 对苯二酚的沸点(填“>”或“<”)。
(4)超细氧化镍是一种功能材料,用途十分广泛,其晶胞结构如图:
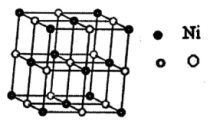
氧化镍的化学式为____ ;设晶胞边长为apm,该物质的密度表达式为____ g•cm-3。
(1)第VIII族元素位于周期表中
(2)Ni与CO在60~80℃时反应生成Ni(CO)4气体,Ni(CO)4为
(3)Fe3+与酚类物质的显色反应常用于其离子检验,已知Fe3+遇邻苯二酚(
 )和对苯二酚(
)和对苯二酚( )均显色。二者碳原子的杂化类型为
)均显色。二者碳原子的杂化类型为(4)超细氧化镍是一种功能材料,用途十分广泛,其晶胞结构如图:

氧化镍的化学式为
您最近一年使用:0次
名校
解题方法
7 . 第VA族元素氮、磷、砷的化合物用途广泛。回答下列问题:
(1)基态磷原子的价电子排布式为_______ ,基态砷原子核外有_______ 个未成对电子。
(2)实验中常用 检验
检验 ,
, 中
中 的配位数为
的配位数为_______ ,其中碳原子的杂化轨道类型为_______ 杂化。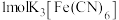 中含有
中含有 键的数目为
键的数目为_______ 。
(3)铁和氨在640℃可发生置换反应,产物之一的立方晶胞结构如图所示,写出该反应的化学方程式:_______ 。

(4)阿伏加德罗常数的值为 ,X射线衍实验测得该晶胞参数为anm,则晶胞的密度为
,X射线衍实验测得该晶胞参数为anm,则晶胞的密度为_______  (写出表达式即可)。
(写出表达式即可)。
(1)基态磷原子的价电子排布式为
(2)实验中常用
 检验
检验 ,
, 中
中 的配位数为
的配位数为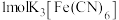 中含有
中含有 键的数目为
键的数目为(3)铁和氨在640℃可发生置换反应,产物之一的立方晶胞结构如图所示,写出该反应的化学方程式:

(4)阿伏加德罗常数的值为
 ,X射线衍实验测得该晶胞参数为anm,则晶胞的密度为
,X射线衍实验测得该晶胞参数为anm,则晶胞的密度为 (写出表达式即可)。
(写出表达式即可)。
您最近一年使用:0次
2022-03-18更新
|
364次组卷
|
3卷引用:浙江省精诚联盟2021-2022学年高二下学期3月联考化学试题
浙江省精诚联盟2021-2022学年高二下学期3月联考化学试题(已下线)浙江省温州市普通高中2023届高三下学期第二次适应性考试化学试题变式题(结构与性质)广东省梅州市大埔县虎山中学2021-2022学年高二下学期第一次段考(4月)化学试题



