1 . 某工业废渣的主要成分为NiO、CuO、 、ZnO,一种综合回收利用的工艺流程如图所示:
、ZnO,一种综合回收利用的工艺流程如图所示:

回答下列问题:
(1)写出浸渣主要成分的一种用途:_______ 。
(2)浸取液含有的配离子有 、
、 、
、 ,
, 的中心离子为
的中心离子为_______ ,配位数为_______ ; 能作配体的原因是
能作配体的原因是_______ 。
(3)“还原”得到Cu时发生反应的氧化剂和还原剂的物质的量之比为_______ ;该反应温度不宜过高,原因是_______ 。
(4)“沉锌镍”后得到的滤液中可循环利用的物质有_______ (填化学式)。
(5)“脱锌”时反应的化学方程式为_______ 。
(6)NiO为绿色固体,常用作搪瓷的着色剂,其晶胞结构如图所示:

①测定晶体结构最常用的方法是_______ (填选项字母)。
A.核磁共振氢谱 B.红外光谱 C.X射线衍射实验 D.称重法
②若晶胞中 之间的最短距离为a nm,阿伏加德罗常数的值为
之间的最短距离为a nm,阿伏加德罗常数的值为 ,则该晶体的密度为
,则该晶体的密度为_______  (用含
(用含 、a的代数式表示)。
、a的代数式表示)。
 、ZnO,一种综合回收利用的工艺流程如图所示:
、ZnO,一种综合回收利用的工艺流程如图所示:
回答下列问题:
(1)写出浸渣主要成分的一种用途:
(2)浸取液含有的配离子有
 、
、 、
、 ,
, 的中心离子为
的中心离子为 能作配体的原因是
能作配体的原因是(3)“还原”得到Cu时发生反应的氧化剂和还原剂的物质的量之比为
(4)“沉锌镍”后得到的滤液中可循环利用的物质有
(5)“脱锌”时反应的化学方程式为
(6)NiO为绿色固体,常用作搪瓷的着色剂,其晶胞结构如图所示:

①测定晶体结构最常用的方法是
A.核磁共振氢谱 B.红外光谱 C.X射线衍射实验 D.称重法
②若晶胞中
 之间的最短距离为a nm,阿伏加德罗常数的值为
之间的最短距离为a nm,阿伏加德罗常数的值为 ,则该晶体的密度为
,则该晶体的密度为 (用含
(用含 、a的代数式表示)。
、a的代数式表示)。
您最近一年使用:0次
解题方法
2 . 硼及其化合物在新材料、工农业生产等方面用途很广。请回答下列问题:
(1) 的立体构型是
的立体构型是___________
(2) 为一元酸,与足量NaOH溶液反应得到
为一元酸,与足量NaOH溶液反应得到 ,
, 和
和 中B的杂化轨道类型分别为
中B的杂化轨道类型分别为___________ 、___________ 。
(3) 被认为是有机化学上的“万能还原剂”,
被认为是有机化学上的“万能还原剂”, 的电子式为
的电子式为___________ ,其中三种元素的电负性由大到小的顺序是___________ 。
(4)自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作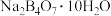 ,实际上它的结构单元是由两个
,实际上它的结构单元是由两个 和两个
和两个 缩合而成的双六元环,应该写成
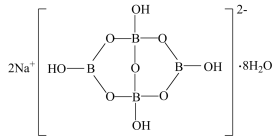
缩合而成的双六元环,应该写成 ,其结构如图1所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是
,其结构如图1所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是___________ (填选项字母)。
A.离子键 B.共价键 C.金属键
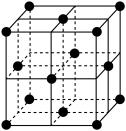
(5)某种金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为 ,每个阴离子是由12个硼原子和12个氢原子所构成的原子团。阴离子在晶胞中的位置如图2所示,其堆积方式为
,每个阴离子是由12个硼原子和12个氢原子所构成的原子团。阴离子在晶胞中的位置如图2所示,其堆积方式为___________ , 占据阴离子组成的所有最小正四面体中心,该化合物的化学式为
占据阴离子组成的所有最小正四面体中心,该化合物的化学式为___________ (用最简整数比表示)。假设晶胞边长为a pm,用 代表阿伏加德罗常数的值,则该晶胞的密度为
代表阿伏加德罗常数的值,则该晶胞的密度为___________  (用含a,
(用含a, 的代数式表示)
的代数式表示)
(1)
 的立体构型是
的立体构型是(2)
 为一元酸,与足量NaOH溶液反应得到
为一元酸,与足量NaOH溶液反应得到 ,
, 和
和 中B的杂化轨道类型分别为
中B的杂化轨道类型分别为(3)
 被认为是有机化学上的“万能还原剂”,
被认为是有机化学上的“万能还原剂”, 的电子式为
的电子式为(4)自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作
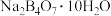 ,实际上它的结构单元是由两个
,实际上它的结构单元是由两个 和两个
和两个 缩合而成的双六元环,应该写成
缩合而成的双六元环,应该写成 ,其结构如图1所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是
,其结构如图1所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是A.离子键 B.共价键 C.金属键

(5)某种金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为
 ,每个阴离子是由12个硼原子和12个氢原子所构成的原子团。阴离子在晶胞中的位置如图2所示,其堆积方式为
,每个阴离子是由12个硼原子和12个氢原子所构成的原子团。阴离子在晶胞中的位置如图2所示,其堆积方式为 占据阴离子组成的所有最小正四面体中心,该化合物的化学式为
占据阴离子组成的所有最小正四面体中心,该化合物的化学式为 代表阿伏加德罗常数的值,则该晶胞的密度为
代表阿伏加德罗常数的值,则该晶胞的密度为 (用含a,
(用含a, 的代数式表示)
的代数式表示)
您最近一年使用:0次
3 . 科学研究表明,物质含有许多种聚集状态,下列关于物质聚集状态的描述错误的是
| A.等离子体的用途之一是可以制造等离子体显示器 |
| B.超分子具有分子识别与自组装的特征 |
| C.液晶和液态是物质的同一种聚集状态 |
| D.同一种金属元素构成的纳米材料的某些性质具有很大的差异 |
您最近一年使用:0次
2023-06-24更新
|
107次组卷
|
3卷引用:广东省广州市第六中学2021-2022学年高二下学期期中测试化学试题
名校
解题方法
4 . 磷是人体含量较多的元素之一,磷的化合物在药物生产和农药制造等方面用途非常广泛。回答下列问题:
(1)基态磷原子的核外电子排布式为_______ 。
(2)P4S3可用于制造火柴,其分子结构如图所示。
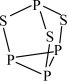
①第一电离能:磷_______ 硫(填“>”或“<”,下同);电负性:磷_______ 硫。
②P4S3分子中硫原子的杂化轨道类型为_______ 。
③每个P4S3分子中孤电子对的数目为_______ 。
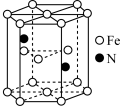
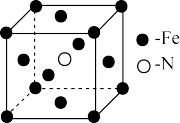
(3)某种磁性氮化铁的晶胞结构如图所示,该化合物的化学式为_______ 。
(4)磷化铝的熔点为2000℃,它与晶体硅的结构类似,磷化铝的晶胞结构如图所示。
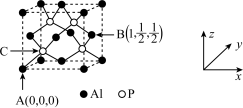
①磷化铝晶体中磷与铝微粒间的作用力为_______ 。
②图中A点和B点的原子坐标参数如图所示,则C点的原子坐标参数为_______ 。
(1)基态磷原子的核外电子排布式为
(2)P4S3可用于制造火柴,其分子结构如图所示。

①第一电离能:磷
②P4S3分子中硫原子的杂化轨道类型为
③每个P4S3分子中孤电子对的数目为
(3)某种磁性氮化铁的晶胞结构如图所示,该化合物的化学式为

(4)磷化铝的熔点为2000℃,它与晶体硅的结构类似,磷化铝的晶胞结构如图所示。

①磷化铝晶体中磷与铝微粒间的作用力为
②图中A点和B点的原子坐标参数如图所示,则C点的原子坐标参数为
您最近一年使用:0次
解题方法
5 . 锰、铬、钴、铁的单质及其化合物在科研和生产中有着重要用途。回答下列问题:
(1)基态锰原子的价电子排布式为_______ 。
(2) 和
和 均为离子化合物,
均为离子化合物, 的熔点高于
的熔点高于 熔点的原因为
熔点的原因为_______ 。
(3)化学式为 的化合物有三种结构,一种呈紫罗兰色,一种呈暗绿色,一种呈亮绿色。在三种化合物中,
的化合物有三种结构,一种呈紫罗兰色,一种呈暗绿色,一种呈亮绿色。在三种化合物中, 的配位数均为6,将它们配制成等体积等浓度的溶液,分别加入足量
的配位数均为6,将它们配制成等体积等浓度的溶液,分别加入足量 溶液,所得
溶液,所得 沉淀的物质的量之比为3∶2∶1。
沉淀的物质的量之比为3∶2∶1。
①呈暗绿色的配合物,其内界的离子符号为_______ 。
② 分子的
分子的 模型为
模型为_______ 。
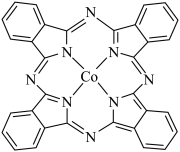
(4)如图为酞菁钴分子的平面结构,下列说法正确的是_______(填标号)。
(5)如图是一种由Y(与 同族)、Fe、Ba、O组成的晶体,晶胞棱上的球代表Ba,顶点的球代表Y,四方锥中心和八面体中心的球代表Fe,其余小球代表O。
同族)、Fe、Ba、O组成的晶体,晶胞棱上的球代表Ba,顶点的球代表Y,四方锥中心和八面体中心的球代表Fe,其余小球代表O。
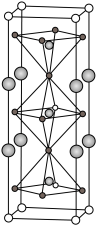
①该晶体的化学式为_______ 。
②其中Y的配位数为_______ 。
③在氧气气氛中该晶体可被部分氧化,氧原子进入晶格而使晶体呈现深紫色。新进入的氧原子在晶胞中的位置是_______ 。
(1)基态锰原子的价电子排布式为
(2)
 和
和 均为离子化合物,
均为离子化合物, 的熔点高于
的熔点高于 熔点的原因为
熔点的原因为(3)化学式为
 的化合物有三种结构,一种呈紫罗兰色,一种呈暗绿色,一种呈亮绿色。在三种化合物中,
的化合物有三种结构,一种呈紫罗兰色,一种呈暗绿色,一种呈亮绿色。在三种化合物中, 的配位数均为6,将它们配制成等体积等浓度的溶液,分别加入足量
的配位数均为6,将它们配制成等体积等浓度的溶液,分别加入足量 溶液,所得
溶液,所得 沉淀的物质的量之比为3∶2∶1。
沉淀的物质的量之比为3∶2∶1。①呈暗绿色的配合物,其内界的离子符号为
②
 分子的
分子的 模型为
模型为(4)如图为酞菁钴分子的平面结构,下列说法正确的是_______(填标号)。

A.电负性: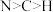 | B.4个N原子均与 形成配位键 形成配位键 |
C.分子中N的杂化轨道类型均为 | D.第一电离能: |
 同族)、Fe、Ba、O组成的晶体,晶胞棱上的球代表Ba,顶点的球代表Y,四方锥中心和八面体中心的球代表Fe,其余小球代表O。
同族)、Fe、Ba、O组成的晶体,晶胞棱上的球代表Ba,顶点的球代表Y,四方锥中心和八面体中心的球代表Fe,其余小球代表O。
①该晶体的化学式为
②其中Y的配位数为
③在氧气气氛中该晶体可被部分氧化,氧原子进入晶格而使晶体呈现深紫色。新进入的氧原子在晶胞中的位置是
您最近一年使用:0次
名校
6 . 氯化铵是“侯氏制碱法”的副产品,在工农业生产中具有重要用途。回答下列问题:
(1)氯化铵的立方晶胞结构如图所示:

①与 等距离且最近的Cl-有
等距离且最近的Cl-有_______ 个。
②若氯化铵的密度为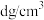 ,设
,设 为阿伏加德罗常数的值,则晶胞参数a=
为阿伏加德罗常数的值,则晶胞参数a=_______ nm(用含d、 的代数式表示)。
的代数式表示)。
(2)常温下,用 计测得某
计测得某 溶液的
溶液的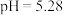 。
。
①用离子方程式表示 溶液呈酸性的原因:
溶液呈酸性的原因:____________ 。
②若溶液中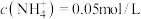 ,则水解常数
,则水解常数
_______ (提示: 和
和 的物质的量浓度几乎相等,
的物质的量浓度几乎相等,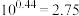 。结果保留2位有效数字)。
。结果保留2位有效数字)。
(3)为探究溶液浓度和 浓度对氯化铵水解的影响,学习小组利用
浓度对氯化铵水解的影响,学习小组利用 溶液和
溶液和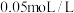 的
的 溶液,按下表配制总体积相同的系列溶液。测定
溶液,按下表配制总体积相同的系列溶液。测定 ,记录数据。
,记录数据。
①补充表中数据:a=_______ 。
②由实验I和II可知,稀释 溶液,
溶液,_______ (填“促进"或“抑制”) 水解,结合表中数据,给出判断理由:
水解,结合表中数据,给出判断理由:_______
③结合表中数据分析 增大,
增大, 水解程度
水解程度_______ (填“增大”、“减小”或“不变”)。
④画出稀释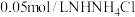 溶液时,
溶液时, 随加入水量的变化曲线图
随加入水量的变化曲线图_______ ,标注出 的变化范围。
的变化范围。
(1)氯化铵的立方晶胞结构如图所示:

①与
 等距离且最近的Cl-有
等距离且最近的Cl-有②若氯化铵的密度为
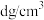 ,设
,设 为阿伏加德罗常数的值,则晶胞参数a=
为阿伏加德罗常数的值,则晶胞参数a= 的代数式表示)。
的代数式表示)。(2)常温下,用
 计测得某
计测得某 溶液的
溶液的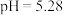 。
。①用离子方程式表示
 溶液呈酸性的原因:
溶液呈酸性的原因:②若溶液中
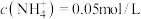 ,则水解常数
,则水解常数
 和
和 的物质的量浓度几乎相等,
的物质的量浓度几乎相等,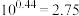 。结果保留2位有效数字)。
。结果保留2位有效数字)。(3)为探究溶液浓度和
 浓度对氯化铵水解的影响,学习小组利用
浓度对氯化铵水解的影响,学习小组利用 溶液和
溶液和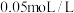 的
的 溶液,按下表配制总体积相同的系列溶液。测定
溶液,按下表配制总体积相同的系列溶液。测定 ,记录数据。
,记录数据。| 序号 | 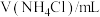 |  | 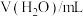 |  |
| I | 20 | 0 | 0 | 5.28 |
| II | 2 | 0 | 18 | 5.78 |
| III | 2 | a | 16 | 5.78 |
| IV | 2 | 10 | 8 | 5.78 |
②由实验I和II可知,稀释
 溶液,
溶液, 水解,结合表中数据,给出判断理由:
水解,结合表中数据,给出判断理由:③结合表中数据分析
 增大,
增大, 水解程度
水解程度④画出稀释
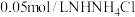 溶液时,
溶液时, 随加入水量的变化曲线图
随加入水量的变化曲线图 的变化范围。
的变化范围。
您最近一年使用:0次
2022-08-05更新
|
225次组卷
|
2卷引用:广东省2023届高三上学期开学联考化学试题
名校
7 . 第VA族元素氮、磷、砷、锑在生产、科研有着重要用途。
(1)乙腈 常用于制备含氮有机化合物,与水混溶。乙腈分子中含有的σ键与π键数目之比为
常用于制备含氮有机化合物,与水混溶。乙腈分子中含有的σ键与π键数目之比为_______ ;能与水混溶的原因是_______ 。
(2)咪唑可作为铜的防锈剂而用于印刷电路版和集成电路。咪唑分子结构如图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取_______ 杂化。
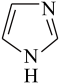
(3) 与水会形成黄色的配离子
与水会形成黄色的配离子 ,为避免颜色干扰,常在含
,为避免颜色干扰,常在含 溶液中加入
溶液中加入 形成无色的
形成无色的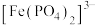 。由此推测与
。由此推测与 形成的配离子更稳定的配体是
形成的配离子更稳定的配体是_______ ,配位原子是_______ 。
(4)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为 固溶体。四方
固溶体。四方 晶胞如图所示。
晶胞如图所示。 离子在晶胞中的配位数是
离子在晶胞中的配位数是_______ ,晶胞参数为apm、apm、cpm,该晶体密度为_______  (写出表达式)。在
(写出表达式)。在 中掺杂少量ZnO后形成的催化剂,化学式可表示为
中掺杂少量ZnO后形成的催化剂,化学式可表示为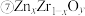 ,则y=
,则y=_______ (用x表达)。

(1)乙腈
 常用于制备含氮有机化合物,与水混溶。乙腈分子中含有的σ键与π键数目之比为
常用于制备含氮有机化合物,与水混溶。乙腈分子中含有的σ键与π键数目之比为(2)咪唑可作为铜的防锈剂而用于印刷电路版和集成电路。咪唑分子结构如图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取

(3)
 与水会形成黄色的配离子
与水会形成黄色的配离子 ,为避免颜色干扰,常在含
,为避免颜色干扰,常在含 溶液中加入
溶液中加入 形成无色的
形成无色的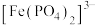 。由此推测与
。由此推测与 形成的配离子更稳定的配体是
形成的配离子更稳定的配体是(4)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为
 固溶体。四方
固溶体。四方 晶胞如图所示。
晶胞如图所示。 离子在晶胞中的配位数是
离子在晶胞中的配位数是 (写出表达式)。在
(写出表达式)。在 中掺杂少量ZnO后形成的催化剂,化学式可表示为
中掺杂少量ZnO后形成的催化剂,化学式可表示为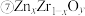 ,则y=
,则y=
您最近一年使用:0次
名校
8 . 资源化利用碳及其化合物具有重要意义。
(1)CO是高炉炼铁的重要还原剂,炼铁时发生的主要反应有:
Ⅰ.

Ⅱ.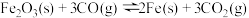
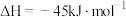
Ⅲ.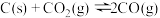
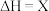 试计算,
试计算,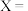
_______ ;
反应Ⅱ中,正反应的活化能_______ (填“>”、“<”或“=”)逆反应的活化能。
(2)在一定温度下,向某体积可变的恒压(P总)密闭容器中加入1molCO2与足量的碳发生反应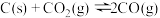 ,平衡时体系中气体体积分数与温度关系如图所示。
,平衡时体系中气体体积分数与温度关系如图所示。
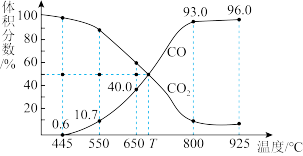
①650℃时,反应达平衡后CO2的转化率为_______ ;
②T℃时,在1L恒容密闭容器中加入3molCO2与足量的碳,10min后测得V(CO)为11.2L(标况下),则反应速率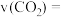
_______ ;上述反应达到平衡状态时,下列说法正确的是_______ :
a.单位时间内生成的CO2的物质的量是CO的两倍
b.容器中气体的压强不随时间而变化
c.升高温度,再次达到平衡时,C的质量减少
d.保持其它条件不变,充入惰性气体,反应速率减小,平衡移动
(3)镍及其化合物在工业生产和科研领域有重要的用途。请回答下列问题:
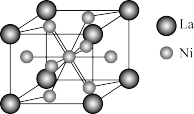
基态Ni原子价层电子的电子排布图(轨道表达式)为_______ 。金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如下图所示。若阿伏加德罗常数的值为 ,晶胞边长为apm,则该晶胞的密度为
,晶胞边长为apm,则该晶胞的密度为_______  。(
。( )
)
(1)CO是高炉炼铁的重要还原剂,炼铁时发生的主要反应有:
Ⅰ.


Ⅱ.
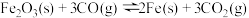
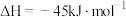
Ⅲ.
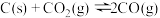
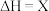 试计算,
试计算,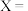
反应Ⅱ中,正反应的活化能
(2)在一定温度下,向某体积可变的恒压(P总)密闭容器中加入1molCO2与足量的碳发生反应
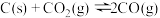 ,平衡时体系中气体体积分数与温度关系如图所示。
,平衡时体系中气体体积分数与温度关系如图所示。
①650℃时,反应达平衡后CO2的转化率为
②T℃时,在1L恒容密闭容器中加入3molCO2与足量的碳,10min后测得V(CO)为11.2L(标况下),则反应速率
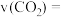
a.单位时间内生成的CO2的物质的量是CO的两倍
b.容器中气体的压强不随时间而变化
c.升高温度,再次达到平衡时,C的质量减少
d.保持其它条件不变,充入惰性气体,反应速率减小,平衡移动
(3)镍及其化合物在工业生产和科研领域有重要的用途。请回答下列问题:
基态Ni原子价层电子的电子排布图(轨道表达式)为
 ,晶胞边长为apm,则该晶胞的密度为
,晶胞边长为apm,则该晶胞的密度为 。(
。( )
)
您最近一年使用:0次
名校
解题方法
9 . 铁是地球表面最丰富的金属之一,其合金、化合物具有广泛用途。回答下列问题:
(1)画出基态 Fe 原子的简化电子排布式___________ 。Fe3+比 Fe2+稳定的原因是___________ 。
(2)实验室常用 K3[Fe(CN)6]检验 Fe2+,K3[Fe(CN)6]中 Fe3+的配位数为___________ ,其中碳原子的杂化轨道类型为___________ 杂化。
(3)已知 FeF3的熔点(1000℃)显著高于 FeCl3的熔点(306℃),原因是___________ 。
(4)铁和氨在 640℃可发生置换反应,产物之一的立方晶胞结构如图所示,写出该反应的化学方程式:___________ 。
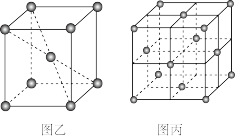
(5)在一定条件下铁形成的晶体的基本结构单元如图乙和图丙所示, 则图乙和图丙的结构中铁原子的配位数之比为___________ ,两种晶体中空间利用率较高的是___________ 。(填“图乙”或“图丙”)
(6)碳、铁之间可形成多种化合物,其中一种化合物的晶体结构如图所示:

则编号为①的原子的坐标为___________ ;设该晶体的晶胞参数为apm,阿伏加德罗常数的值为NA,则该晶体的密度为___________ g•cm-3(列出计算式即可)。
(1)画出基态 Fe 原子的简化电子排布式
(2)实验室常用 K3[Fe(CN)6]检验 Fe2+,K3[Fe(CN)6]中 Fe3+的配位数为
(3)已知 FeF3的熔点(1000℃)显著高于 FeCl3的熔点(306℃),原因是
(4)铁和氨在 640℃可发生置换反应,产物之一的立方晶胞结构如图所示,写出该反应的化学方程式:

(5)在一定条件下铁形成的晶体的基本结构单元如图乙和图丙所示, 则图乙和图丙的结构中铁原子的配位数之比为

(6)碳、铁之间可形成多种化合物,其中一种化合物的晶体结构如图所示:

则编号为①的原子的坐标为
您最近一年使用:0次
2022-04-29更新
|
391次组卷
|
3卷引用:广东省广州市育才中学2021-2022学年高二下学期期中考试化学试题
广东省广州市育才中学2021-2022学年高二下学期期中考试化学试题广东省广州市育才中学2021-2022学年高二下学期期中考试化学试题(已下线)押全国卷理综第35题 物质结构与性质-备战2022年高考化学临考题号押题(课标全国卷)
名校
解题方法
10 . 第VA族元素氮、磷、砷、锑在生产、科研有着重要用途。
(1)乙腈CH3CN常用于制备含氮有机化合物,与水混溶。乙腈分子中含有的σ键与π键数目之比为_______ ;能与水混溶的原因是_______ 。
(2)咪唑可作为铜的防锈剂而用于印刷电路版和集成电路。咪唑分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取_______ 杂化。

(3)Fe3+与水会形成黄色的配离子[Fe(OH)]2+,为避免颜色干扰,常在含Fe3+溶液中加入H3PO4形成无色的[Fe(PO4)2]3-。由此推测与Fe3+形成的配离子更稳定的配体是____ ,配位原子是____ 。
(4)砒霜有剧毒,可用石灰消毒生成 和少量
和少量 。基态33As原子的原子结构示意图是
。基态33As原子的原子结构示意图是_______ , 的空间构型为
的空间构型为_______ 。
(5)某铁、镧、锑的合金晶胞如图l所示,铁原子位于锑原子构成的正八面体的体心,晶胞的6个表面结构都如图2所示。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如图l中A点锑原子的坐标为 。已知晶胞中La的原子分数坐标有两种,分别为(0,0,0)和
。已知晶胞中La的原子分数坐标有两种,分别为(0,0,0)和_______ 。
②该合金的化学式是_______ 。
③若该晶体的密度为ρg·m-3,晶胞参数为anm,计算阿伏加德罗常数的值NA=_______ 。(用含ρ、a的计算式表示)
(1)乙腈CH3CN常用于制备含氮有机化合物,与水混溶。乙腈分子中含有的σ键与π键数目之比为
(2)咪唑可作为铜的防锈剂而用于印刷电路版和集成电路。咪唑分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取

(3)Fe3+与水会形成黄色的配离子[Fe(OH)]2+,为避免颜色干扰,常在含Fe3+溶液中加入H3PO4形成无色的[Fe(PO4)2]3-。由此推测与Fe3+形成的配离子更稳定的配体是
(4)砒霜有剧毒,可用石灰消毒生成
 和少量
和少量 。基态33As原子的原子结构示意图是
。基态33As原子的原子结构示意图是 的空间构型为
的空间构型为(5)某铁、镧、锑的合金晶胞如图l所示,铁原子位于锑原子构成的正八面体的体心,晶胞的6个表面结构都如图2所示。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如图l中A点锑原子的坐标为
 。已知晶胞中La的原子分数坐标有两种,分别为(0,0,0)和
。已知晶胞中La的原子分数坐标有两种,分别为(0,0,0)和②该合金的化学式是
③若该晶体的密度为ρg·m-3,晶胞参数为anm,计算阿伏加德罗常数的值NA=
您最近一年使用:0次



