解题方法
1 . 利用下列仪器、装置及药品能达到实验目的的是
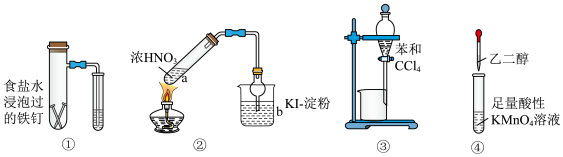
| A.图①装置可用于验证钢铁的吸氧腐蚀 | B.图②装置b中溶液变蓝能够说明浓 分解生成 分解生成 |
| C.图③装置可通过加水分离两种物质 | D.图④装置可制取乙二酸 |
您最近一年使用:0次
解题方法
2 . 一水硫酸四氨合铜(Ⅱ)的化学式为 是一种重要的染料及农药中间体。某学习小组以废铜料(含少量铁及难溶性杂质)为主要原料合成该物质,合成路线如下:
是一种重要的染料及农药中间体。某学习小组以废铜料(含少量铁及难溶性杂质)为主要原料合成该物质,合成路线如下:不正确 的是
 是一种重要的染料及农药中间体。某学习小组以废铜料(含少量铁及难溶性杂质)为主要原料合成该物质,合成路线如下:
是一种重要的染料及农药中间体。某学习小组以废铜料(含少量铁及难溶性杂质)为主要原料合成该物质,合成路线如下:
A.操作I中发生的主要反应为: |
| B.操作II中趁热过滤除去的是难溶性杂质和氢氧化铁 |
| C.操作III中洗涤可用乙醇和水的混合液,干燥可采用减压干燥方式 |
| D.设计操作IV的目的是为了提高乙醇的利用率 |
您最近一年使用:0次
解题方法
3 . 下列说法不正确的是
| A.蒸馏、萃取、重结晶和色谱法都可用于分离、提纯有机物 |
| B.核苷酸通过缩聚反应可以得到核酸,核酸属于生物大分子 |
| C.根据纤维在火焰上燃烧产生的气味,可以鉴别蚕丝与棉花 |
| D.糖类都含有醛基,对氢氧化铜等弱氧化剂表现出还原性 |
您最近一年使用:0次
4 . 重铬酸钾( )是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为
)是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为 ,还含有
,还含有 、
、 等杂质。制备流程如图所示:
等杂质。制备流程如图所示:
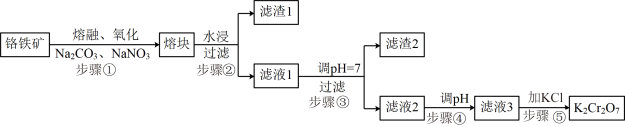
已知:步骤①高温下的主反应为: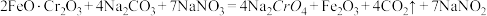
(1)滤渣1的主要成分是___________ 。
(2)步骤④调节pH时发生的离子方程式为___________ 。
(3)下列说法不正确 的是___________。
(4)步骤⑤加入KCl后,还需经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作,洗涤 粗产品时可选择___________。
粗产品时可选择___________。
(5)测定产品的纯度
 (摩尔质量:294g/mol)的定量测定:称取0.3750g样品,加水溶解配制250mL溶液,移取25mL溶液于锥形瓶中,加入适量的硫酸和足量的KI溶液,充分反应后加入几滴淀粉溶液,然后用
(摩尔质量:294g/mol)的定量测定:称取0.3750g样品,加水溶解配制250mL溶液,移取25mL溶液于锥形瓶中,加入适量的硫酸和足量的KI溶液,充分反应后加入几滴淀粉溶液,然后用
 标准液进行滴定。上述过程平行测试3次,平均消耗的
标准液进行滴定。上述过程平行测试3次,平均消耗的 溶液的体积为22.50mL。已知:
溶液的体积为22.50mL。已知: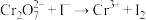 ,
, (未配平)。
(未配平)。
① 的纯度为
的纯度为___________ 。
②上述操作都正确,但实际测得的 纯度偏高,可能的原因是
纯度偏高,可能的原因是___________ 。
 )是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为
)是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为 ,还含有
,还含有 、
、 等杂质。制备流程如图所示:
等杂质。制备流程如图所示:
已知:步骤①高温下的主反应为:
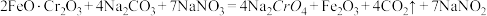
| 常见物质的溶解度 | |||
| 物质 | 0℃(g) | 40℃(g) | 80℃(g) |
| KCl | 28.0 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38.0 |
 | 4.7 | 26.3 | 73 |
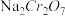 | 163 | 215 | 375 |
(1)滤渣1的主要成分是
(2)步骤④调节pH时发生的离子方程式为
(3)下列说法
| A.步骤①可在陶瓷容器中进行 |
| B.为了加快步骤②中的过滤速度,可用玻璃棒小心翻动沉淀 |
| C.步骤③的目的是使杂质离子转化为沉淀而除去 |
| D.步骤⑤加入KCl后发生的是复分解反应 |
(4)步骤⑤加入KCl后,还需经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作,洗涤
 粗产品时可选择___________。
粗产品时可选择___________。| A.冷水 | B.饱和氯化钾溶液 | C.热水 | D.冷的酒精 |
(5)测定产品的纯度
 (摩尔质量:294g/mol)的定量测定:称取0.3750g样品,加水溶解配制250mL溶液,移取25mL溶液于锥形瓶中,加入适量的硫酸和足量的KI溶液,充分反应后加入几滴淀粉溶液,然后用
(摩尔质量:294g/mol)的定量测定:称取0.3750g样品,加水溶解配制250mL溶液,移取25mL溶液于锥形瓶中,加入适量的硫酸和足量的KI溶液,充分反应后加入几滴淀粉溶液,然后用
 标准液进行滴定。上述过程平行测试3次,平均消耗的
标准液进行滴定。上述过程平行测试3次,平均消耗的 溶液的体积为22.50mL。已知:
溶液的体积为22.50mL。已知: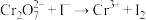 ,
, (未配平)。
(未配平)。①
 的纯度为
的纯度为②上述操作都正确,但实际测得的
 纯度偏高,可能的原因是
纯度偏高,可能的原因是
您最近一年使用:0次
5 . 海带中含有丰富的碘。从海带中提取碘的实验过程如下图所示:

下列说法正确的是

下列说法正确的是
| A.步骤③用到的主要仪器是分液漏斗 |
| B.步骤④中的双氧水可用过量氯水代替 |
| C.步骤⑤萃取后的现象是液体分层且下层为紫红色 |
| D.步骤⑥可采用减压蒸馏 |
您最近一年使用:0次
6 . 某工厂采用软锰矿(主要成分为 )与辉铋矿(主要成分为
)与辉铋矿(主要成分为 ,含有
,含有 、
、 杂质)联合焙烧法制备电池级的
杂质)联合焙烧法制备电池级的 和BiOCl,工艺流程如下:
和BiOCl,工艺流程如下:

已知:①焙烧时过量的 分解为
分解为 ,加热时
,加热时 在酸性溶液中转化为
在酸性溶液中转化为 和Mn²⁺,MnO与酸反应生成
和Mn²⁺,MnO与酸反应生成 ;
;
②金属活动性顺序:Fe>(H)>Bi>Cu;
③相关金属离子形成氢氧化物的pH范围:
④BiOCl的式量:260.5
回答下列问题:
(1)下列有关说法错误的是___________。
(2) 经热解、酸浸等步骤可制备
经热解、酸浸等步骤可制备 。
。 在空气气流中热解得到三种价态锰的氧化物,锰元素所占比例(某价态锰的元素的中锰元素质量×100%)随热解温度变化的曲线如图所示。为获得较高产率的
在空气气流中热解得到三种价态锰的氧化物,锰元素所占比例(某价态锰的元素的中锰元素质量×100%)随热解温度变化的曲线如图所示。为获得较高产率的 ,请选出正确操作并按序排列:取一定量
,请选出正确操作并按序排列:取一定量 置于热解装置中,通空气气流,
置于热解装置中,通空气气流,___________ ,充分反应后过滤、洗涤、干燥,得到 。
。

a.冷却至室温
b.加热到450℃分解一段时间
c.加热到480℃分解一段时间
d.边搅拌边加入一定量1 mol⋅L-1的 溶液
溶液
e.边搅拌边加入一定量1 mol⋅L-1的HCl溶液0
(3)BiOCl含量的测定。称取产品0.1302g于锥形瓶中,加15 mL 36%的盐酸溶解,加掩蔽剂防止杂质离子对终点判断产生干扰,调pH至1.5~1.8,加入饱和硫脲与 形成黄色络合物,再用0.0200 mol⋅L-1的EDTA滴定至终点,消耗溶液22.50 mL。已知EDTA与
形成黄色络合物,再用0.0200 mol⋅L-1的EDTA滴定至终点,消耗溶液22.50 mL。已知EDTA与 1∶1发生络合反应,所得产物的稳定性远大于硫脲与
1∶1发生络合反应,所得产物的稳定性远大于硫脲与 形成的黄色络合物。
形成的黄色络合物。
①根据滴定实验测得的数据计算,产品的质量分数为___________ 。
②临近滴定终点时的操作方法是:将旋塞稍稍转动,使半滴溶液悬于管口,___________ ,再用洗瓶以少量蒸馏水吹洗锥形瓶内壁,直到滴入最后半滴EDTA,溶液恰好由黄色变为无色,半分钟内不变色。
③下列关于滴定分析的操作,错误的是___________ 。
A.装入滴定管中的溶液无需用量筒量取
B.滴定时要适当控制滴定速度
C.滴定时应一直观察滴定管中溶液体积的变化
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.①中计算所得数据即为产品纯度
 )与辉铋矿(主要成分为
)与辉铋矿(主要成分为 ,含有
,含有 、
、 杂质)联合焙烧法制备电池级的
杂质)联合焙烧法制备电池级的 和BiOCl,工艺流程如下:
和BiOCl,工艺流程如下:
已知:①焙烧时过量的
 分解为
分解为 ,加热时
,加热时 在酸性溶液中转化为
在酸性溶液中转化为 和Mn²⁺,MnO与酸反应生成
和Mn²⁺,MnO与酸反应生成 ;
;②金属活动性顺序:Fe>(H)>Bi>Cu;
③相关金属离子形成氢氧化物的pH范围:
| 开始沉淀pH | 完全沉淀pH | |
 | 6.5 | 8.3 |
 | 1.6 | 2.8 |
 | 8.1 | 10.1 |
回答下列问题:
(1)下列有关说法错误的是___________。
A.焙烧时,只有 是还原剂 是还原剂 |
| B.为提高焙烧效率,鼓入适当过量的空气 |
C.滤渣A是 ,气体A是 ,气体A是 |
D.加入金属铋的作用是将 转化为Fe 转化为Fe |
 经热解、酸浸等步骤可制备
经热解、酸浸等步骤可制备 。
。 在空气气流中热解得到三种价态锰的氧化物,锰元素所占比例(某价态锰的元素的中锰元素质量×100%)随热解温度变化的曲线如图所示。为获得较高产率的
在空气气流中热解得到三种价态锰的氧化物,锰元素所占比例(某价态锰的元素的中锰元素质量×100%)随热解温度变化的曲线如图所示。为获得较高产率的 ,请选出正确操作并按序排列:取一定量
,请选出正确操作并按序排列:取一定量 置于热解装置中,通空气气流,
置于热解装置中,通空气气流, 。
。
a.冷却至室温
b.加热到450℃分解一段时间
c.加热到480℃分解一段时间
d.边搅拌边加入一定量1 mol⋅L-1的
 溶液
溶液e.边搅拌边加入一定量1 mol⋅L-1的HCl溶液0
(3)BiOCl含量的测定。称取产品0.1302g于锥形瓶中,加15 mL 36%的盐酸溶解,加掩蔽剂防止杂质离子对终点判断产生干扰,调pH至1.5~1.8,加入饱和硫脲与
 形成黄色络合物,再用0.0200 mol⋅L-1的EDTA滴定至终点,消耗溶液22.50 mL。已知EDTA与
形成黄色络合物,再用0.0200 mol⋅L-1的EDTA滴定至终点,消耗溶液22.50 mL。已知EDTA与 1∶1发生络合反应,所得产物的稳定性远大于硫脲与
1∶1发生络合反应,所得产物的稳定性远大于硫脲与 形成的黄色络合物。
形成的黄色络合物。①根据滴定实验测得的数据计算,产品的质量分数为
②临近滴定终点时的操作方法是:将旋塞稍稍转动,使半滴溶液悬于管口,
③下列关于滴定分析的操作,错误的是
A.装入滴定管中的溶液无需用量筒量取
B.滴定时要适当控制滴定速度
C.滴定时应一直观察滴定管中溶液体积的变化
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.①中计算所得数据即为产品纯度
您最近一年使用:0次
解题方法
7 . 三氯乙醛( )是无色油状液体,是制取农药的常用原料。某小组探究制备三氯乙醛的实验装置如图所示(夹持、加热装置均略去)。
)是无色油状液体,是制取农药的常用原料。某小组探究制备三氯乙醛的实验装置如图所示(夹持、加热装置均略去)。
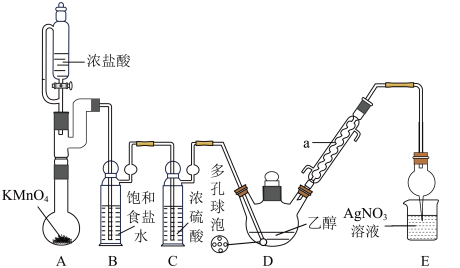
已知:①制备原理: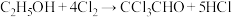 ,(保持70℃左右)
,(保持70℃左右)
②有关物质的性质:
请回答:
(1)仪器a的名称为_______ 。若发现D中导管口处气泡速率过快,合理的解决方法是_______ 。
(2)下列说法不正确的是_______。
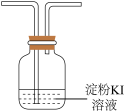
(3)若撤去装置C会导致 产率降低,原因是
产率降低,原因是_______ 。
(4)粗产品纯度的测定:称取5.00g粗产品溶于水配成100mL溶液,量取10.00mL于锥形瓶中,加入25.00mL 碘标准溶液,再加入适量
碘标准溶液,再加入适量 溶液。反应完全后加适量盐酸调节溶液的pH,立即用
溶液。反应完全后加适量盐酸调节溶液的pH,立即用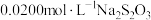 溶液滴定至淡黄色,加入淀粉指示剂,继续滴定至终点。重复上述操作3次,平均消耗
溶液滴定至淡黄色,加入淀粉指示剂,继续滴定至终点。重复上述操作3次,平均消耗 溶液20.00mL。(测定原理:
溶液20.00mL。(测定原理: 、
、 、
、 )
)
①选出正确的滴定操作并排序:检查是否漏水→蒸馏水洗涤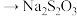 标准溶液润洗滴定管→
标准溶液润洗滴定管→_______ →到达滴定终点,停止滴定,记录读数。
a.调整管中液面至“0”或“0”刻度以下,记录读数
b.调整管中液面,用胶头滴管滴加标准液恰好到“0”刻度
c.锥形瓶放于滴定管下,边滴边摇动锥形瓶,眼睛注视锥形瓶内颜色变化
d.装入标准液至“0”刻度以上2~3mL,固定好滴定管
e.锥形瓶放于滴定管下,边滴边摇动锥形瓶,眼睛注视滴定管内液面变化
f.如图操作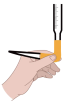 ,排出滴定管尖嘴部分的气泡
,排出滴定管尖嘴部分的气泡
g.如图操作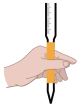 ,排出滴定管尖嘴部分的气泡
,排出滴定管尖嘴部分的气泡
②产品的纯度是_______ %(计算结果保留2位小数)
 )是无色油状液体,是制取农药的常用原料。某小组探究制备三氯乙醛的实验装置如图所示(夹持、加热装置均略去)。
)是无色油状液体,是制取农药的常用原料。某小组探究制备三氯乙醛的实验装置如图所示(夹持、加热装置均略去)。
已知:①制备原理:
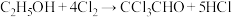 ,(保持70℃左右)
,(保持70℃左右)②有关物质的性质:
| 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | 密度/ | |
| 乙醇 | 46 | -117 | 78.5 | 与水互溶 | 0.789 |
| 三氯乙醛 | 147.5 | -57.5 | 97.8 | 溶于水、乙醇 | 1.51 |
(1)仪器a的名称为
(2)下列说法不正确的是_______。

| A.本实验较合理的加热方式是水浴加热 |
| B.多孔球泡可以增大反应物接触面积,提高反应速率 |
| C.为证明D中产生HCl,需要在D和E之间增加装置(如图) |
| D.反应后的混合物可采用分液操作进一步分离、提纯三氯乙醛 |
 产率降低,原因是
产率降低,原因是(4)粗产品纯度的测定:称取5.00g粗产品溶于水配成100mL溶液,量取10.00mL于锥形瓶中,加入25.00mL
 碘标准溶液,再加入适量
碘标准溶液,再加入适量 溶液。反应完全后加适量盐酸调节溶液的pH,立即用
溶液。反应完全后加适量盐酸调节溶液的pH,立即用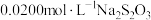 溶液滴定至淡黄色,加入淀粉指示剂,继续滴定至终点。重复上述操作3次,平均消耗
溶液滴定至淡黄色,加入淀粉指示剂,继续滴定至终点。重复上述操作3次,平均消耗 溶液20.00mL。(测定原理:
溶液20.00mL。(测定原理: 、
、 、
、 )
)①选出正确的滴定操作并排序:检查是否漏水→蒸馏水洗涤
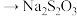 标准溶液润洗滴定管→
标准溶液润洗滴定管→a.调整管中液面至“0”或“0”刻度以下,记录读数
b.调整管中液面,用胶头滴管滴加标准液恰好到“0”刻度
c.锥形瓶放于滴定管下,边滴边摇动锥形瓶,眼睛注视锥形瓶内颜色变化
d.装入标准液至“0”刻度以上2~3mL,固定好滴定管
e.锥形瓶放于滴定管下,边滴边摇动锥形瓶,眼睛注视滴定管内液面变化
f.如图操作
 ,排出滴定管尖嘴部分的气泡
,排出滴定管尖嘴部分的气泡g.如图操作
 ,排出滴定管尖嘴部分的气泡
,排出滴定管尖嘴部分的气泡②产品的纯度是
您最近一年使用:0次
名校
解题方法
8 . 醋酸亚铬水合物([Cr(CH3COO)2)]2·2H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在。实验室以Zn、盐酸、CrCl3溶液、CH3COONa溶液为原料,制备醋酸亚铬水合物的装置如图所示:
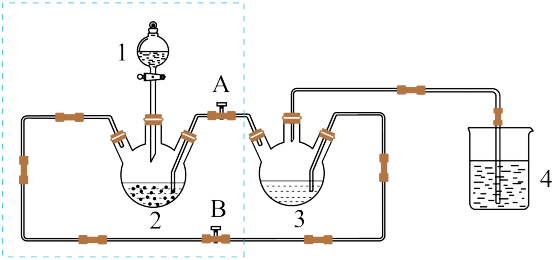
已知:醋酸亚铬水合物不溶于冷水和醚,易溶于盐酸。
Zn(s) + 2HCl(aq) = ZnCl2(aq) + H2(g)
2CrCl3(aq) + Zn(s)= 2CrCl2 (aq) + ZnCl2(aq)
2Cr2+(aq) + 4CH3COO-(aq) + 2H2O(l) = [Cr(CH3COO)2]2·2H2O (s)
请回答:
(1)检查虚线框内装置气密性的方法是_______ 。
(2)醋酸钠溶液应放在装置_______ 中(填写装置编号,下同);盐酸应放在装置_______ 中。
(3)将生成的CrCl2溶液与CH3COONa溶液混合时的操作是_______ 阀门A、_______ 阀门B (填“打开”或“关闭”)。
(4)本实验中锌粒须过量,其原因是_______ 。
(5)为洗涤[Cr(CH3COO)2)]2·2H2O产品,下列方法中最适合的是_______。

已知:醋酸亚铬水合物不溶于冷水和醚,易溶于盐酸。
Zn(s) + 2HCl(aq) = ZnCl2(aq) + H2(g)
2CrCl3(aq) + Zn(s)= 2CrCl2 (aq) + ZnCl2(aq)
2Cr2+(aq) + 4CH3COO-(aq) + 2H2O(l) = [Cr(CH3COO)2]2·2H2O (s)
请回答:
(1)检查虚线框内装置气密性的方法是
(2)醋酸钠溶液应放在装置
(3)将生成的CrCl2溶液与CH3COONa溶液混合时的操作是
(4)本实验中锌粒须过量,其原因是
(5)为洗涤[Cr(CH3COO)2)]2·2H2O产品,下列方法中最适合的是_______。
| A.先用盐酸洗,后用冷水洗 | B.先用冷水洗,后用盐酸洗 |
| C.先用冷水洗,后用乙醚洗 | D.先用盐酸洗涤,后用乙醚洗 |
您最近一年使用:0次
名校
9 . 高压氢还原法可直接从溶液中提取金属粉末,以硫化铜精矿(含Zn、Fe元素的杂质)为主要原料制备铜粉的工艺流程如下:

下列有关说法不正确 的是

下列有关说法
| A.浸取液中金属阳离子为Fe2+、Zn2+、Cu2+ |
| B.矿石粉碎、适当提高硫酸浓度和浸取温度、使用高压O2,均有利于提高浸取速率 |
| C.若固体X含有S,则浸取时硫化铜的反应方程式为:2CuS+O2+4H+=2Cu2++2S+2H2O |
| D.还原时,提高溶液中H+浓度,不利于Cu的生成 |
您最近一年使用:0次
解题方法
10 . 以菱镁矿(主要成分为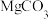 ,含少量
,含少量 、
、 和
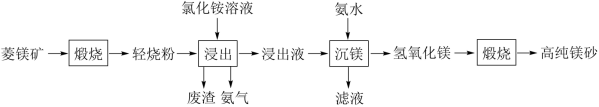
和 )为原料制备高纯镁砂的工艺流程如下:
)为原料制备高纯镁砂的工艺流程如下:
下列说法不正确 的是
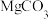 ,含少量
,含少量 、
、 和
和 )为原料制备高纯镁砂的工艺流程如下:
)为原料制备高纯镁砂的工艺流程如下:
下列说法
| A.煅烧时将菱镁矿粉碎,有利于加快反应速率 |
B.浸出镁的反应为 |
C.浸出时产生废渣的主要成分是 、 、 和 和 |
| D.将反应温度调控在高温条件下进行浸出和沉镁操作,均有利于提高镁元素的转化率 |
您最近一年使用:0次
2022-09-29更新
|
618次组卷
|
4卷引用:浙江省嘉兴市2022-2023学年高三上学期9月检测化学试题
浙江省嘉兴市2022-2023学年高三上学期9月检测化学试题(已下线)仿真卷02-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)第5讲 铝、镁及其重要化合物湖南省汉寿县第二中学 2022-2023学年高三上学期期中考试化学试题



