解题方法
1 . “海水提碘”的实验中,提取后;可用“反萃取法”萃取、富集碘单质,试剂常用 ,实验步骤,已知:
,实验步骤,已知: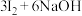 (浓)
(浓)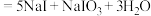 ;酸性条件下
;酸性条件下 和
和 发生归中反应。下面说法错误的是
发生归中反应。下面说法错误的是
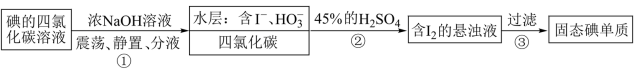
| A.步骤①不可以用酒精作萃取剂 |
| B.分液时有机层从分液漏斗下口放出 |
C.步骤②中发生反应的离子方程式为 |
| D.步骤⑤操作中需要的玻璃仪器为漏斗、烧杯和玻璃棒 |
您最近半年使用:0次
2 . 化学源于生活,她与我们生活息息相关。
Ⅰ.我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如下图所示(部分物质已略去)。
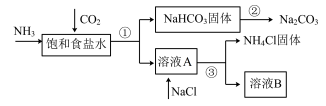
(1)①~③所涉及的操作方法中,包含过滤的是_______ (填序号)。
(2)根据上图,将化学方程式补充完整:
_______ 
_______ 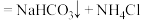
(3)煅烧 固体的化学方程式是
固体的化学方程式是_______ 。
(4)关于上述过程,下列说法中正确的是_______ (填字母)。
a. 不可循环使用
不可循环使用
b.副产物 可用作肥料
可用作肥料
c.反应过程中应先通入极易溶于水的 ,使溶液显碱性,然后再通入
,使溶液显碱性,然后再通入 气体
气体
Ⅱ.氧化还原反应是一类重要的化学反应,广泛应用于生产和生活中。
(5)氢化钠( )在野外被用作生氢剂,其原理是
)在野外被用作生氢剂,其原理是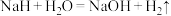 ,该反应中氧化剂是
,该反应中氧化剂是_______ ,还原剂是_______ ;被氧化与被还原元素的物质的量之比为:_______ 。
(6)某离子反应中涉及 、
、 、
、 、
、 、
、 、
、 六种微粒。其中
六种微粒。其中 、
、 的物质的量随时间变化的曲线如图所示。下列判断不正确的是
的物质的量随时间变化的曲线如图所示。下列判断不正确的是_______ 。
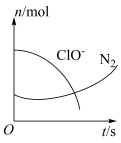
a.该反应的氧化剂是
b.消耗 还原剂,转移
还原剂,转移 电子
电子
c.氧化剂与还原剂的物质的量之比为
d.当生成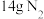 时,消耗的
时,消耗的 为
为
e.氧化性: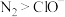
(7)高铁酸钠( ),易溶于水,是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂。工业上制备高铁酸钠有多种方法。在次氯酸钠溶液中加入氢氧化钠和硫酸铁可制备高铁酸钠,此法被称为次氯酸盐氧化法。高铁酸钠(
),易溶于水,是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂。工业上制备高铁酸钠有多种方法。在次氯酸钠溶液中加入氢氧化钠和硫酸铁可制备高铁酸钠,此法被称为次氯酸盐氧化法。高铁酸钠( )中铁元素的价态为
)中铁元素的价态为_______ ;写出制备高铁酸钠的离子方程式_______ 。
Ⅰ.我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如下图所示(部分物质已略去)。

(1)①~③所涉及的操作方法中,包含过滤的是
(2)根据上图,将化学方程式补充完整:


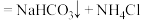
(3)煅烧
 固体的化学方程式是
固体的化学方程式是(4)关于上述过程,下列说法中正确的是
a.
 不可循环使用
不可循环使用b.副产物
 可用作肥料
可用作肥料c.反应过程中应先通入极易溶于水的
 ,使溶液显碱性,然后再通入
,使溶液显碱性,然后再通入 气体
气体Ⅱ.氧化还原反应是一类重要的化学反应,广泛应用于生产和生活中。
(5)氢化钠(
 )在野外被用作生氢剂,其原理是
)在野外被用作生氢剂,其原理是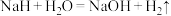 ,该反应中氧化剂是
,该反应中氧化剂是(6)某离子反应中涉及
 、
、 、
、 、
、 、
、 、
、 六种微粒。其中
六种微粒。其中 、
、 的物质的量随时间变化的曲线如图所示。下列判断不正确的是
的物质的量随时间变化的曲线如图所示。下列判断不正确的是
a.该反应的氧化剂是

b.消耗
 还原剂,转移
还原剂,转移 电子
电子c.氧化剂与还原剂的物质的量之比为

d.当生成
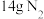 时,消耗的
时,消耗的 为
为
e.氧化性:
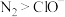
(7)高铁酸钠(
 ),易溶于水,是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂。工业上制备高铁酸钠有多种方法。在次氯酸钠溶液中加入氢氧化钠和硫酸铁可制备高铁酸钠,此法被称为次氯酸盐氧化法。高铁酸钠(
),易溶于水,是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂。工业上制备高铁酸钠有多种方法。在次氯酸钠溶液中加入氢氧化钠和硫酸铁可制备高铁酸钠,此法被称为次氯酸盐氧化法。高铁酸钠( )中铁元素的价态为
)中铁元素的价态为
您最近半年使用:0次
名校
3 . Li2CO3是制备锂离子电极材料LiFePO4的重要原料。以盐湖卤水(主要含有NaCl、MgCl2、LiCl和Na2B4O7等)为原料提取Li2CO3并制备LiFePO4的工艺流程如图所示:

已知:“日晒蒸发喷雾干燥”后固体含NaCl、LiCl、MgCl2•6H2O等。
(1)硼酸在水中的溶解度随温度的变化关系如图所示:
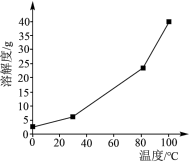
已知:H3BO3+H2O⇌[B(OH)4]-+H+。6.2gH3BO3最多与______ mL2.5mol/LNaOH溶液完全反应。“酸化脱硼”中采用______ (填“加热”或“冷却”),其目的是______ 。
(2)“水浸”后的溶液中溶质的主要成分是______ 。
(3)“蒸发分解”生成Li2CO3的化学方程式为______ 。
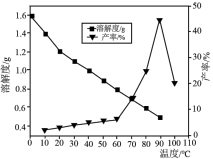
(4)已知不同温度下蒸发分解得到Li2CO3的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是______ ,制得的Li2CO3沉淀需要进行洗涤,具体操作为______ 。
(5)制备LiFePO4时同时生成CO2,其中FePO4与C6H12O6物质的量之比为24:1,该化学反应方程式为______ 。

已知:“日晒蒸发喷雾干燥”后固体含NaCl、LiCl、MgCl2•6H2O等。
(1)硼酸在水中的溶解度随温度的变化关系如图所示:

已知:H3BO3+H2O⇌[B(OH)4]-+H+。6.2gH3BO3最多与
(2)“水浸”后的溶液中溶质的主要成分是
(3)“蒸发分解”生成Li2CO3的化学方程式为
(4)已知不同温度下蒸发分解得到Li2CO3的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是

(5)制备LiFePO4时同时生成CO2,其中FePO4与C6H12O6物质的量之比为24:1,该化学反应方程式为
您最近半年使用:0次
解题方法
4 . 玻璃棒是化学实验中的常用仪器。下列有关玻璃棒的使用不合理的是
A. | B. |
C. | D.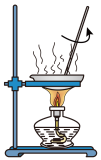 |
您最近半年使用:0次
名校
5 . 从干海带中提取碘的实验流程如下,下列有关说法

| A.氧化过程可以用过氧化氢代替氯水 |
B.试剂X可以选择使用NaOH,发生反应为:3I2 + 6OH- = 5I- + IO +3H2O +3H2O |
| C.萃取时可使用无水乙醇代替CCl4以节约成本 |
| D.操作I需要使用到普通漏斗、烧杯和玻璃棒 |
您最近半年使用:0次
解题方法
6 . 下列实验操作规范的是
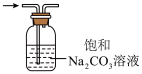 | 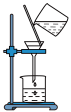 |  |  |
| A.除去CO2中的HCl | B.过滤 | C.收集CO2 | D.溶液滴加 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
7 . 在实验室分离NaCl和 固体时不需要用到的操作是
固体时不需要用到的操作是
A.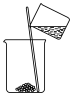 | B.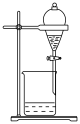 |
C. | D.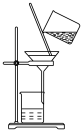 |
您最近半年使用:0次
2024-03-22更新
|
150次组卷
|
2卷引用:贵州省贵阳市2024届高三下学期适应性测试(一)化学试题
名校
解题方法
8 .  是生活中常用的消毒剂。工业制备方法之一为
是生活中常用的消毒剂。工业制备方法之一为
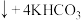 ,下列叙述正确的是
,下列叙述正确的是
 是生活中常用的消毒剂。工业制备方法之一为
是生活中常用的消毒剂。工业制备方法之一为
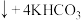 ,下列叙述正确的是
,下列叙述正确的是A. 是该反应的催化剂 是该反应的催化剂 |
| B.氧化剂、还原剂的物质的量之比为2∶1 |
C.锰酸钾在水中的电离方程式: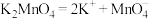 |
D.实验结束,可以采用“过滤”操作分离出 |
您最近半年使用:0次
2024-03-22更新
|
85次组卷
|
2卷引用:辽宁省朝阳市建平县实验中学2023-2024学年高一上学期2月期末化学试题
解题方法
9 . 下列由废铜屑制取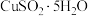 的实验原理与装置不能达到实验目的的是
的实验原理与装置不能达到实验目的的是
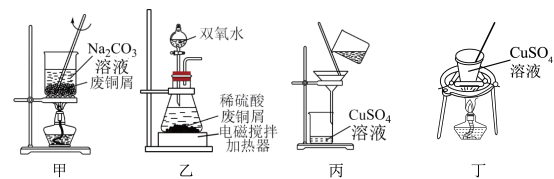
 的实验原理与装置不能达到实验目的的是
的实验原理与装置不能达到实验目的的是
| A.用装置甲除去废铜屑表面的油污 |
| B.用装置乙在加热的条件下溶解废铜屑 |
C.用装置丙过滤得到 溶液 溶液 |
D.用装置丁蒸发结晶获得 |
您最近半年使用:0次
10 . 以银锰精矿(主要含Ag2S、MnS、FeS2)和氧化锰矿(主要含MnO2)为原料联合提取精银、Mn及MnO2的一种流程示意图如下。

已知:酸性条件下,MnO2的氧化性强于Fe3+。
(1)“浸锰”是在H2SO4溶液中使矿石中的锰元素浸出的过程,能同时去除FeS2,且有利于后续银的浸出,矿石中的银以Ag2S的形式残留于浸锰渣中。
①“浸锰”过程中,MnS发生反应的离子方程式是_______ 。
②在H2SO4溶液中,银锰精矿中的FeS2和氧化锰矿中的MnO2发生反应,则浸锰液中主要的金属阳离子有_______ 。
(2)“浸银”时,使用过量FeCl3、HCl、CaCl2的混合液作为浸出剂,将Ag2S中的银以 形式浸出。
形式浸出。
①将“浸银”反应的离子方程式补充完整:_______ 。
_______Fe3++Ag2S+_______⇌_______+_______[AgCl2]-+S
②浸出剂中H+的作用:_______ 。
(3)“电解精炼”时,将粗银粉进行“固态化”处理,制成“粗银电极”,下图为电解精炼银的示意图,回答下列问题:
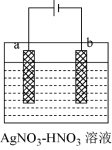
①_______ 极为“粗银电极”(填“a”或“b”)。
②若b极有少量红棕色气体产生,则生成该气体的电极反应式为_______ ;当电路中通过0.025NA电子时,b极质量增加2.16g,则b极产生的气体在标况下的体积为_______ mL(保留三位有效数字)。

已知:酸性条件下,MnO2的氧化性强于Fe3+。
(1)“浸锰”是在H2SO4溶液中使矿石中的锰元素浸出的过程,能同时去除FeS2,且有利于后续银的浸出,矿石中的银以Ag2S的形式残留于浸锰渣中。
①“浸锰”过程中,MnS发生反应的离子方程式是
②在H2SO4溶液中,银锰精矿中的FeS2和氧化锰矿中的MnO2发生反应,则浸锰液中主要的金属阳离子有
(2)“浸银”时,使用过量FeCl3、HCl、CaCl2的混合液作为浸出剂,将Ag2S中的银以
 形式浸出。
形式浸出。①将“浸银”反应的离子方程式补充完整:
_______Fe3++Ag2S+_______⇌_______+_______[AgCl2]-+S
②浸出剂中H+的作用:
(3)“电解精炼”时,将粗银粉进行“固态化”处理,制成“粗银电极”,下图为电解精炼银的示意图,回答下列问题:

①
②若b极有少量红棕色气体产生,则生成该气体的电极反应式为
您最近半年使用:0次



