解题方法
1 . 某小组同学探究久置FeSO4固体变质的情况,并测定其中铁元素的质量分数。将0.6gFeSO4固体用蒸馏水溶解,配成20mL待测液,进行实验。
资料:KSCN中S元素的化合价为﹣2价;酸性条件下,MnO 的还原产物为Mn2+。
的还原产物为Mn2+。
(1)实验一:
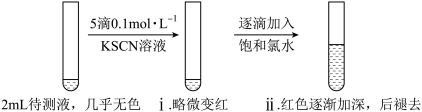
①i中溶液略微变红,说明待测液中存在_______ 。
②ii中溶液颜色逐渐加深的原因是_______ (用离子方程式表示)。
③由实验一推测FeSO4固体变质的情况是_______ (填字母序号)。
a.未变质 b.部分变质 c.完全变质
(2)实验二:探究ii中“红色褪去”的原因。
针对“红色褪去”的现象,小组同学猜想可能的原因是_______ ,并通过如下实验证实了猜想。将褪色后的溶液分两份分别进行实验:
请补全②中的现象:_______ 。
(3)实验三:测定久置FeSO4固体中铁元素的含量,设计实验方案如图:

①可选作A的物质是_______ (填字母序号)。
a.Zn b.Cu c.Fe d.KI
②若消耗0.1mol/LKMnO4溶液3.6mL,则久置FeSO4固体中铁元素的质量分数是_______ 。
资料:KSCN中S元素的化合价为﹣2价;酸性条件下,MnO
 的还原产物为Mn2+。
的还原产物为Mn2+。(1)实验一:

①i中溶液略微变红,说明待测液中存在
②ii中溶液颜色逐渐加深的原因是
③由实验一推测FeSO4固体变质的情况是
a.未变质 b.部分变质 c.完全变质
(2)实验二:探究ii中“红色褪去”的原因。
针对“红色褪去”的现象,小组同学猜想可能的原因是
| 序号 | 操作 | 现象 |
| ① | 滴加NaOH溶液 | 产生红褐色沉淀 |
| ② | 滴加FeCl3溶液 | _______ |
(3)实验三:测定久置FeSO4固体中铁元素的含量,设计实验方案如图:

①可选作A的物质是
a.Zn b.Cu c.Fe d.KI
②若消耗0.1mol/LKMnO4溶液3.6mL,则久置FeSO4固体中铁元素的质量分数是
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
2 . 若胆矾中含有少量Cu(NO3)2·3H2O,测定其中CuSO4·5H2O的含量,实验步骤如下:称量胆矾样品的质量为m1,加水溶解,滴加足量BaCl2溶液,充分反应后过滤,将滤渣烘干、冷却,称得其质量为m2.样品中CuSO4·5H2O的质量分数为_______ (列出算式可能用到的化学式量:CuSO4 160、CuSO4·5H2O 250、Cu(NO3)2·3H2O 242、BaSO4 233)。
您最近一年使用:0次
名校
解题方法
3 . 炼铁的矿石主要有赤铁矿、磁铁矿和菱铁矿等。在测定磁铁矿中铁的含量前,通常要对矿石进行预处理。对矿样进行预处理后,用重铬酸钾标准溶液可测定铁矿石的含铁量,现有两种对矿样进行预处理的方法如下:

已知:
I.Sn、Hg、Ti在溶液中可存在的形式有 (无色)、
(无色)、 (无色)、
(无色)、 、
、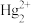 、
、 (紫色)、
(紫色)、 (无色),
(无色), 能与
能与 反应,且
反应,且 也能与
也能与 反应,氯化汞溶于水,氯化亚汞是白色难溶固体;
反应,氯化汞溶于水,氯化亚汞是白色难溶固体;
II.钨酸钠 可作指示剂,若+6价钨被还原为+5价钨,溶液由无色变为蓝色;
可作指示剂,若+6价钨被还原为+5价钨,溶液由无色变为蓝色;
III. 和
和 均具有还原性,氧化性:
均具有还原性,氧化性: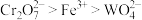 ;
;
IV.二苯胺硫磺钠本身无色,被氧化后呈现紫红色
请回答下列问题:
(1)反应②后得到的悬浊液中固体物质为_______ (写化学式)。
(2)过程①发生反应的离子方程式为_______ 。
(3)反应③中含铁元素的离子发生的反应:_______ ;反应(3)中溶液变蓝,说明_______ 。
(4)矿样预处理后,加入 混酸溶液,以二苯胺硫磺钠为指示剂,用重铬酸钾标准溶液可测定铁矿石的含铁量,当
混酸溶液,以二苯胺硫磺钠为指示剂,用重铬酸钾标准溶液可测定铁矿石的含铁量,当_______ 现象,说明达到了滴定终点。
(5)现称取 矿样进行实验,最终消耗
矿样进行实验,最终消耗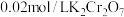 标准溶液
标准溶液 ,则矿样中含铁的质量分数为
,则矿样中含铁的质量分数为_______ 。

已知:
I.Sn、Hg、Ti在溶液中可存在的形式有
 (无色)、
(无色)、 (无色)、
(无色)、 、
、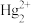 、
、 (紫色)、
(紫色)、 (无色),
(无色), 能与
能与 反应,且
反应,且 也能与
也能与 反应,氯化汞溶于水,氯化亚汞是白色难溶固体;
反应,氯化汞溶于水,氯化亚汞是白色难溶固体;II.钨酸钠
 可作指示剂,若+6价钨被还原为+5价钨,溶液由无色变为蓝色;
可作指示剂,若+6价钨被还原为+5价钨,溶液由无色变为蓝色;III.
 和
和 均具有还原性,氧化性:
均具有还原性,氧化性: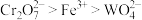 ;
;IV.二苯胺硫磺钠本身无色,被氧化后呈现紫红色
请回答下列问题:
(1)反应②后得到的悬浊液中固体物质为
(2)过程①发生反应的离子方程式为
(3)反应③中含铁元素的离子发生的反应:
(4)矿样预处理后,加入
 混酸溶液,以二苯胺硫磺钠为指示剂,用重铬酸钾标准溶液可测定铁矿石的含铁量,当
混酸溶液,以二苯胺硫磺钠为指示剂,用重铬酸钾标准溶液可测定铁矿石的含铁量,当(5)现称取
 矿样进行实验,最终消耗
矿样进行实验,最终消耗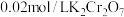 标准溶液
标准溶液 ,则矿样中含铁的质量分数为
,则矿样中含铁的质量分数为
您最近一年使用:0次
2022-11-10更新
|
172次组卷
|
2卷引用:山东省菏泽市2022-2023学年高三上学期期中联考化学(A卷)试题
名校
解题方法
4 . 过氧化钙(CaO2)广泛应用于水产养殖、污水处理,是优良的供氧剂。
为了测定CaO2的含量,具体的操作:把样品中的过氧化钙转化为碳酸钙,通过测定碳酸钙沉淀的质量,根据钙元素守恒,求得过氧化钙的质量,具体流程如图:

(1)在流程中过氧化钙(CaO2)与水反应的离子反应方程式_______ 。
(2)滴加的Na2CO3溶液要过量的原因是_______ 。
(3)检验沉淀已经洗涤干净的方法是:_______ 。
(4)若供氧剂的质量m=5g,碳酸钙质量n=6g,请通过计算得出供氧剂中的过氧化钙含量的质量分数为_______ %。
(5)若CaCO3沉淀过滤后不洗涤,则过氧化钙的含量将_______ (填“偏大”、“偏小”或“无影响”)。
为了测定CaO2的含量,具体的操作:把样品中的过氧化钙转化为碳酸钙,通过测定碳酸钙沉淀的质量,根据钙元素守恒,求得过氧化钙的质量,具体流程如图:

(1)在流程中过氧化钙(CaO2)与水反应的离子反应方程式
(2)滴加的Na2CO3溶液要过量的原因是
(3)检验沉淀已经洗涤干净的方法是:
(4)若供氧剂的质量m=5g,碳酸钙质量n=6g,请通过计算得出供氧剂中的过氧化钙含量的质量分数为
(5)若CaCO3沉淀过滤后不洗涤,则过氧化钙的含量将
您最近一年使用:0次
5 . 以废旧铅酸电池中的含铅废料( 等)为原料制备
等)为原料制备 ,实现铅的再生利用。流程示意图如下:
,实现铅的再生利用。流程示意图如下:
ii.
(1)溶浸
 均转化为
均转化为 。
。
①上述流程中能提高含铅废料中铅的浸出率的措施有_______ 。
② 转化为
转化为 的反应有:
的反应有: 、
、_______ 。
(2)结晶
①所得 中含有少量
中含有少量 ,原因是
,原因是_______ (用方程式表示)。
②向母液中补加一定量盐酸,可继续浸取含铅废料。重复操作的结果如下:
循环3次后, 纯度急剧降低,此时向母液中加入
纯度急剧降低,此时向母液中加入_____ (填试剂),过滤,滤液可再次参与循环。
(3)脱氯
 在某浓度
在某浓度 溶液中的溶解度曲线如下图所示。
溶液中的溶解度曲线如下图所示。_______ 。
(4)测定废料中铅的含量
将 含铅废料与足量盐酸、
含铅废料与足量盐酸、 溶液充分反应,得到
溶液充分反应,得到 溶液。取
溶液。取 溶液加水稀释,再加几滴二甲酚橙作指示剂,用
溶液加水稀释,再加几滴二甲酚橙作指示剂,用 的乙二胺四乙酸二钠盐(用
的乙二胺四乙酸二钠盐(用 表示)进行滴定,滴定终点时消耗
表示)进行滴定,滴定终点时消耗 溶液
溶液 。计算废料中铅的质量分数
。计算废料中铅的质量分数_______ 。
资料:滴定原理为:
 等)为原料制备
等)为原料制备 ,实现铅的再生利用。流程示意图如下:
,实现铅的再生利用。流程示意图如下:

ii.

(1)溶浸
 均转化为
均转化为 。
。①上述流程中能提高含铅废料中铅的浸出率的措施有
②
 转化为
转化为 的反应有:
的反应有: 、
、(2)结晶
①所得
 中含有少量
中含有少量 ,原因是
,原因是②向母液中补加一定量盐酸,可继续浸取含铅废料。重复操作的结果如下:
| 循环次数 | 0 | 1 | 2 | 3 | 4 |
| 铅回收率/% | 85.4 | 93.5 | 95.8 | 97.1 | 98.2 |
 纯度/% 纯度/% | 99.4 | 99.3 | 99.2 | 99.1 | 96.1 |
 纯度急剧降低,此时向母液中加入
纯度急剧降低,此时向母液中加入(3)脱氯
 在某浓度
在某浓度 溶液中的溶解度曲线如下图所示。
溶液中的溶解度曲线如下图所示。
(4)测定废料中铅的含量
将
 含铅废料与足量盐酸、
含铅废料与足量盐酸、 溶液充分反应,得到
溶液充分反应,得到 溶液。取
溶液。取 溶液加水稀释,再加几滴二甲酚橙作指示剂,用
溶液加水稀释,再加几滴二甲酚橙作指示剂,用 的乙二胺四乙酸二钠盐(用
的乙二胺四乙酸二钠盐(用 表示)进行滴定,滴定终点时消耗
表示)进行滴定,滴定终点时消耗 溶液
溶液 。计算废料中铅的质量分数
。计算废料中铅的质量分数资料:滴定原理为:

您最近一年使用:0次
2023-01-08更新
|
355次组卷
|
4卷引用:北京市朝阳区2022-2023学年高三上学期期末考试化学试题
解题方法
6 . 煤焦油、煤和海砂中氯离子含量高会破坏金属的钝化膜,导致铁制设备和钢管等被腐蚀。
(1)铁接触氧气和水后会发生电化学腐蚀,其负极的电极反应式为_______ 。
(2)测定煤中氯离子含量的两种方法。
方法一:在高温下,通入水蒸气将煤样中无机盐转化为HCl,再滴定氯离子。
方法二:取a g煤样,处理后得到含氯离子的样品溶液,加入 溶液,以
溶液,以 作指示剂,用
作指示剂,用 溶液滴定过量的
溶液滴定过量的 溶液,共消耗KSCN溶液
溶液,共消耗KSCN溶液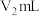 。
。
已知: 能与KSCN反应生成AgSCN沉淀。
能与KSCN反应生成AgSCN沉淀。
①结合化学用语,从化学平衡的角度解释方法一中无机盐中 生成HCl的原因
生成HCl的原因_______ 。
②方法二中,滴定终点的现象为_______ 。
③利用方法二,测得煤样中氯元素的质量分数为_______ 。
(3)快速检测法测定海砂中氯离子含量的过程如下。
i.配制固定组分的铬酸银( )浑浊液;
)浑浊液;
ii.将待测海砂样品与i中浑浊液混合,溶液的颜色会随着氯离子含量的变化而变化。
已知: ;
; ;
; 溶液为黄色,
溶液为黄色, 固体为砖红色。
固体为砖红色。
① 时,沉淀仍然为砖红色的原因是
时,沉淀仍然为砖红色的原因是_______ 。
②写出砖红色沉淀变为白色的离子方程式_______ 。
(1)铁接触氧气和水后会发生电化学腐蚀,其负极的电极反应式为
(2)测定煤中氯离子含量的两种方法。
方法一:在高温下,通入水蒸气将煤样中无机盐转化为HCl,再滴定氯离子。
方法二:取a g煤样,处理后得到含氯离子的样品溶液,加入
 溶液,以
溶液,以 作指示剂,用
作指示剂,用 溶液滴定过量的
溶液滴定过量的 溶液,共消耗KSCN溶液
溶液,共消耗KSCN溶液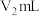 。
。已知:
 能与KSCN反应生成AgSCN沉淀。
能与KSCN反应生成AgSCN沉淀。①结合化学用语,从化学平衡的角度解释方法一中无机盐中
 生成HCl的原因
生成HCl的原因②方法二中,滴定终点的现象为
③利用方法二,测得煤样中氯元素的质量分数为
(3)快速检测法测定海砂中氯离子含量的过程如下。
i.配制固定组分的铬酸银(
 )浑浊液;
)浑浊液;ii.将待测海砂样品与i中浑浊液混合,溶液的颜色会随着氯离子含量的变化而变化。
| 氯离子含量x |  |  |  |
| ii中现象 | 沉淀仍然为砖红色 | 砖红色沉淀部分变为白色,溶液逐渐转变为黄色 | 砖红色沉淀完全变为白色,溶液完全转变为黄色 |
 ;
; ;
; 溶液为黄色,
溶液为黄色, 固体为砖红色。
固体为砖红色。①
 时,沉淀仍然为砖红色的原因是
时,沉淀仍然为砖红色的原因是②写出砖红色沉淀变为白色的离子方程式
您最近一年使用:0次
名校
7 . 钛是航空、军工、电力等领域的重要原材料。地壳中的含钛矿石之一是金红石( ),其是冶炼钛的重要原料。生产钛的工艺流程如图:
),其是冶炼钛的重要原料。生产钛的工艺流程如图:

已知:①常温下,钛既不与常见非金属单质反应,也不与强酸反应;
②加热时,钛可以和常见的非金属单质反应。
(1)在反应I中:
①下列有关CO的说法正确的是_______ (填标号)。
A.属于酸性氧化物 B.摩尔质量为28 C.为可燃性气体 D.具有还原性
②反应I的化学方程式为_______ ,该反应中氧化剂与还原剂的质量之比为_______ 。
③每转移0.2mol电子,同时生成CO的体积为_______ (标准状况下)。
(2)在反应II中:
①氩气的作用为_______ 。
②该反应的基本反应类型为_______ 。
(3)为了测定反应II制得的金属钛(杂质仅含Mg)中的钛元素含量。常温下,取mg反应II制得的金属钛置于烧杯中,往烧杯中逐滴滴入物质的量浓度为 的稀硫酸,当不再出现气泡时,共消耗VmL稀硫酸:
的稀硫酸,当不再出现气泡时,共消耗VmL稀硫酸:
①上述反应的离子方程式为_______ 。
②金属钛的质量分数为_______ (用含m、c、V的代数式表示)。
 ),其是冶炼钛的重要原料。生产钛的工艺流程如图:
),其是冶炼钛的重要原料。生产钛的工艺流程如图:
已知:①常温下,钛既不与常见非金属单质反应,也不与强酸反应;
②加热时,钛可以和常见的非金属单质反应。
(1)在反应I中:
①下列有关CO的说法正确的是
A.属于酸性氧化物 B.摩尔质量为28 C.为可燃性气体 D.具有还原性
②反应I的化学方程式为
③每转移0.2mol电子,同时生成CO的体积为
(2)在反应II中:
①氩气的作用为
②该反应的基本反应类型为
(3)为了测定反应II制得的金属钛(杂质仅含Mg)中的钛元素含量。常温下,取mg反应II制得的金属钛置于烧杯中,往烧杯中逐滴滴入物质的量浓度为
 的稀硫酸,当不再出现气泡时,共消耗VmL稀硫酸:
的稀硫酸,当不再出现气泡时,共消耗VmL稀硫酸:①上述反应的离子方程式为
②金属钛的质量分数为
您最近一年使用:0次
2023-01-11更新
|
288次组卷
|
7卷引用:甘肃省庆阳市2022-2023学年高一上学期期末考试化学试题
名校
解题方法
8 . 某铁矿石的有效成分是Fe2O3,用如图所示装置测该铁矿石有效成分的含量(杂质不参与反应),称取2.00g铁矿石于硬质玻璃管A中,充分反应后测得干燥管B增重1.32g,C增重0.10g,下列相关说法中错误的是


| A.应先通一段时间CO,称量干燥管B后,再加热硬质玻璃管A |
| B.干燥管C的作用是防止空气中的水蒸气和CO2进入干燥管B |
| C.在硬质玻璃管A中发生的反应中,Fe2O3为氧化剂 |
| D.铁矿石有效成分的质量分数为86.0% |
您最近一年使用:0次
2022-10-01更新
|
378次组卷
|
2卷引用:广东省2022-2023学年高三上学期9月份大联考化学试题
2022高一·上海·专题练习
解题方法
9 . 为了测定固体磷铵化肥铵态氮的百分含量,实验室用下列实验装置进行实验:
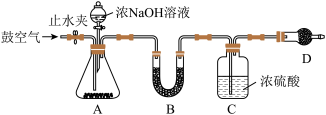
在A中加入m g磷铵样品,关闭止水夹,向A中加入浓NaOH溶液,反应前后C中浓硫酸增重n g,回答下列问题:
(1)B中应加入__________ (填物质名称),其作用是________________________ 。D的作用是_______________________________________ 。
(2)反应停止后打开止水夹,向反应装置中鼓入一定量的空气,其作用是__________________________ 。
(3)该磷铵化肥中铵态氮的质量分数是_________ (用含m、n的关系式表示)

在A中加入m g磷铵样品,关闭止水夹,向A中加入浓NaOH溶液,反应前后C中浓硫酸增重n g,回答下列问题:
(1)B中应加入
(2)反应停止后打开止水夹,向反应装置中鼓入一定量的空气,其作用是
(3)该磷铵化肥中铵态氮的质量分数是
您最近一年使用:0次
名校
解题方法
10 . 我国科学家用粗氢氧化高钴[Co(OH)3]制备硫酸钴晶体(CoSO4∙7H2O),其工艺流程如下。

已知:ⅰ.还原浸出液中的阳离子有:Co2+、H+、Fe2+和Ca2+等
iⅱ.部分物质的溶度积常数如下(25℃)
ⅲ.CoSO4∙7H2O溶解度随温度升高而明显增大
(1)氢氧化高钴溶于硫酸的化学方程式是_____________ 。
(2)浸出Co2+时,理论上氧化剂和还原剂物质的量之比为_____________ 。
(3)写出“氧化沉铁”的离子方程式_____________ ;
25℃时,浊液中铁离子浓度为_____________ mol/L(此时pH为4)。
(4)结合平衡移动原理解释“氟化沉钙”步骤加入过量NaF的原因_____________ 。
(5)P507萃取后,经反萃取得到硫酸钴溶液,将硫酸钴溶液经_____________ 操作,得到硫酸钴晶体。
(6)用滴定法测定硫酸钴晶体中的钴含量,其原理和操作如下。
在溶液中,用铁氰化钾将Co(Ⅱ)氧化为Co(Ⅲ),过量的铁氰化钾以Co(Ⅱ)标准液返滴定。反应的方程式为: 。
。
已知:铁氰化钾标准液浓度为c mol/L,Co(Ⅱ)标准液质量浓度为ρg/L。
取mg硫酸钴晶体,加水配成200mL溶液,取20mL待测液进行滴定,消耗V1mL铁氰化钾标准液、V2mL Co(Ⅱ)标准液。
计算样品中钴含量ω=_____________ (以钴的质量分数ω计)。

已知:ⅰ.还原浸出液中的阳离子有:Co2+、H+、Fe2+和Ca2+等
iⅱ.部分物质的溶度积常数如下(25℃)
物质 | Ksp |
CaF2 |
|
Fe(OH)3 |
|
(1)氢氧化高钴溶于硫酸的化学方程式是
(2)浸出Co2+时,理论上氧化剂和还原剂物质的量之比为
(3)写出“氧化沉铁”的离子方程式
25℃时,浊液中铁离子浓度为
(4)结合平衡移动原理解释“氟化沉钙”步骤加入过量NaF的原因
(5)P507萃取后,经反萃取得到硫酸钴溶液,将硫酸钴溶液经
(6)用滴定法测定硫酸钴晶体中的钴含量,其原理和操作如下。
在溶液中,用铁氰化钾将Co(Ⅱ)氧化为Co(Ⅲ),过量的铁氰化钾以Co(Ⅱ)标准液返滴定。反应的方程式为:
 。
。已知:铁氰化钾标准液浓度为c mol/L,Co(Ⅱ)标准液质量浓度为ρg/L。
取mg硫酸钴晶体,加水配成200mL溶液,取20mL待测液进行滴定,消耗V1mL铁氰化钾标准液、V2mL Co(Ⅱ)标准液。
计算样品中钴含量ω=
您最近一年使用:0次
2023-01-05更新
|
297次组卷
|
2卷引用:北京市石景山区2022-2023学年高三上学期期末考试化学试题





