新疆维吾尔自治区喀什区第二中学2020-2021学年高二上学期期末考试化学试题
新疆
高二
期末
2021-02-12
399次
整体难度:
适中
考查范围:
常见无机物及其应用、化学反应原理
新疆维吾尔自治区喀什区第二中学2020-2021学年高二上学期期末考试化学试题
新疆
高二
期末
2021-02-12
399次
整体难度:
适中
考查范围:
常见无机物及其应用、化学反应原理
一、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
1. 化学与生活密切相关,下列说法错误的是
| A.热的碳酸钠溶液可用于去除餐具的油污 |
| B.NH4Cl溶液可用作焊接钢铁时的除锈剂 |
| C.明矾可用作净水剂 |
| D.一次性干电池的工作原理是电能转化为化学能 |
【知识点】 明矾的净水作用及原理解读 盐类水解在生活、生产中的应用解读 一次电池
您最近一年使用:0次
单选题
|
容易(0.94)
名校
您最近一年使用:0次
2021-01-19更新
|
261次组卷
|
2卷引用:新疆维吾尔自治区喀什区第二中学2020-2021学年高二上学期期末考试化学试题
单选题
|
适中(0.65)
名校
3. 关于吸热反应的说法,错误的是
| A.需要加热的反应不一定是吸热反应 |
| B.多数分解反应是吸热反应 |
| C.吸热反应一定不能自发进行 |
| D.盐类的水解反应一定是吸热反应 |
【知识点】 吸热反应和放热反应解读 化学反应进行方向的判据
您最近一年使用:0次
2018-02-21更新
|
265次组卷
|
4卷引用:山东省滨州市2017-2018学年高二年级上学期期末考试化学试题
山东省滨州市2017-2018学年高二年级上学期期末考试化学试题新疆维吾尔自治区喀什区第二中学2020-2021学年高二上学期期末考试化学试题(已下线)期中03-2020-2021学年高一化学章末集训必刷卷(人教版2019必修第二册)山东省滨州市沾化区实验高级中学2022-2023学年高三上学期开学考试化学试题
单选题
|
适中(0.65)
名校
您最近一年使用:0次
单选题
|
适中(0.65)
真题
名校
5. 合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g) CO2(g)+H2(g)△H<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
CO2(g)+H2(g)△H<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
 CO2(g)+H2(g)△H<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
CO2(g)+H2(g)△H<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )| A.增加压强 | B.降低温度 | C.增大CO的浓度 | D.更换催化剂 |
【知识点】 化学平衡的移动及其影响因素
您最近一年使用:0次
2019-01-30更新
|
2454次组卷
|
61卷引用:2011-2012学年海南省海南中学高二1班下学期期末考试化学试卷
(已下线)2011-2012学年海南省海南中学高二1班下学期期末考试化学试卷(已下线)2012-2013学年河南安阳一中高二月考(奥数班)化学试卷(已下线)2012-2013学年江苏泰州二中高二上学期期中考试化学(选修)试卷(已下线)2012-2013学年河南省平顶山市高二上学期期末考试化学试卷(已下线)2012-2013学年江苏省启东市高二上学期期末考试化学试卷(已下线)2014届吉林省吉林市高三开学摸底考试化学试卷(已下线)2013-2014学年云南省玉溪一中高二上学期期中考试化学试卷(已下线)2014届吉林省吉林市普通高中高三上学期摸底测试化学试卷2012年普通高等学校招生全国统一考试化学(大纲全国)(已下线)2014届江西省九江一中上学期期中考试高二化学试卷(已下线)2014-2015学年吉林省汪清县第六中学高二上学期期中考试化学试卷2014—2015山东省泰安市高二上学期期末统考高二化学试卷2014-2015学年福建省晋江市季延中学高二下学期期中考试化学试卷2015-2016学年陕西省西安一中高二上10月月考化学试卷2015-2016学年湖南省株洲十八中高二上学期期中(理)化学试卷2016届黑龙江省哈尔滨三中高三上学期第二次检测化学试卷2016-2017学年河北冀州市中学高二上开学调研化学卷湖北省宜昌市葛洲坝中学2017-2018学年高二上学期期中考试化学试题江苏省启东中学2017-2018学年高一(创新班)上学期期中考试化学试题甘肃省兰州新舟中学2017-2018学年高二上学期第二次月考化学试题福建省泉州市泉港区第一中学2017-2018学年高二上学期期中考试化学试题贵州省遵义航天高级中学2017-2018学年高二上学期第三次月考理综(理)化学试题安徽省当涂一中2017-2018学年高二上学期12月月考化学试题2018-2019学年鲁科版高中化学选修四:模块综合检测题(二)福建省永安市第三中学2018届高三9月月考化学试题吉林省长春汽车经济开发区第三中学2018-2019学年高二上学期10月月考化学试题【全国百强校】吉林省延边市第二中学2018-2019学年高二上学期期中考试化学试题浙江省杭州市西湖高级中学2017-2018学年高二12月月考化学试题陕西省渭南市渭南中学2018-2019学年高二上学期第三次月考化学试题山东省沂水外国语2018-2019学年高二上学期第三次月考化学试卷吉林省蛟河市一中2018-2019学年高一下学期第三次测试化学试题云南省景谷一中2018-2019学年高二下学期期末考试化学试题黑龙江省伊春市第二中学2018届高三上学期期中考试化学试题河北省武邑中学2019-2020学年高二上学期第一次月考化学试题步步为赢 高二化学寒假作业:综合检测(一)陕西省渭南三贤中学2019-2020学年高二上学期期中考试化学试题广东省惠州市2018-2019学年高二上学期期末考试化学(理科)试题安徽省芜湖市城南实验中学2019-2020学年高二上学期期中考试化学试题云南省河口县第一中学2019-2020学年高二上学期12月月考化学试题陕西省咸阳市2017~2018学年高二上学期期末考试化学试题西藏自治区拉萨市那曲第二高级中学2018-2019学年高二上学期期末考试化学试题福建省师范大学附属中学2019-2020学年高二上学期期末考试化学试题河南省驻马店市正阳县高级中学2019-2020学年高二上学期第二次月考化学试题湖南省怀化市辰溪县辰溪县第一中学2019-2020学年高二12月月考化学试题黑龙江省伊春市伊美区第二中学2019-2020学年高二上学期开学考试化学试题(已下线)2.3.2+影响化学平衡状态的因素-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)广东省揭阳市第三中学2020-2021学年高二上学期期中考化学试题湖北省咸宁市通城二中2020-2021学年度高二上学期期中考试化学试题新疆维吾尔自治区喀什区第二中学2020-2021学年高二上学期期末考试化学试题(已下线)考点32 化学反应条件的控制-备战2022年高考化学一轮复习考点帮(浙江专用)云南省红河县一中2021-2022学年高二上学期期中考试化学试题云南省保山市昌宁县2021-2022学年高二下学期期中考试化学试题黑龙江省鸡西市第四中学2022-2023学年高二上学期第一次月考化学试题(已下线)2.2.1 化学平衡状态——同步学习必备知识黑龙江省饶河县高级中学2022-2023学年高二上学期第一次月考化学试题湖南省长沙市明德中学2022-2023学年高二上学期期中考试化学试题福建省福州市福建师范大学附属中学2021-2022学年高二上学期期末考试化学试题作业(十五) 化学反应条件的优化--工业合成氨(已下线)BBWYhjhx1104.pdf湖南省张家界市民族中学2023-2024学年高二上学期第一次月考化学试题海南省琼海市嘉积中学2023-2024学年高二上学期期末考试化学试题A卷
单选题
|
适中(0.65)
名校
6. 常温时,下列关于电解质溶液的叙述正确的是
| A.稀释pH=10的氨水,溶液中所有离子的浓度均降低 |
| B.pH均为5的盐酸和氯化铵溶液中,水的电离程度相同 |
| C.35℃时0.1mol·L-1的Na2CO3溶液碱性比25℃时强,说明该水解反应吸热 |
| D.分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗NaOH的物质的量多 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
您最近一年使用:0次
2019-01-13更新
|
126次组卷
|
11卷引用:2012-2013吉林省吉林一中高二下学期期中考试化学试卷
(已下线)2012-2013吉林省吉林一中高二下学期期中考试化学试卷黑龙江省齐齐哈尔市2017-2018学年高二上学期期末考试化学试题吉林省辉南县中学2017-2018学年高二上学期期末考试化学试题河北省黄骅中学2018-2019学年高二上学期第二次月考化学试题黑龙江省双鸭山市第一中学2019-2020学年高二上学期期末考试化学试题江西省南昌市第十中学2019-2020学年高二上学期期末考试化学试题(已下线)【南昌新东方】2019 南昌市三校(一中、十中、铁一中)高二上 期末辽宁省凌源市第二高级中学2019-2020学年高二下学期第二次网测化学试题湖南省衡阳市衡东县欧阳遇实验中学2019-2020学年高二第三次月考化学试题新疆维吾尔自治区喀什区第二中学2020-2021学年高二上学期期末考试化学试题陕西省渭南市尚德中学2022-2023学年高二上学期第一次质量检测化学试题
单选题
|
较易(0.85)
名校
解题方法
8. 2018年4月12日,我国海军首次在南海进行海上阅兵。为了保护舰艇(主要是铁合金材料),在舰体表面镶嵌金属块(R)。下有关说法不正确的是
| A.这种保护舰体的方法叫做牺牲阳极的阴极保护法 |
| B.金属块R可能是锌 |
| C.海水呈弱碱性,舰艇在海水中易发生析氢腐蚀 |
| D.正极反应式为O2 + 2H2O + 4e− = 4OH− |
【知识点】 金属的化学腐蚀与电化学腐蚀解读 金属的防护解读
您最近一年使用:0次
2020-01-21更新
|
133次组卷
|
2卷引用:福建省师范大学附属中学2019-2020学年高二上学期期末考试化学试题
单选题
|
适中(0.65)
名校
解题方法
9. 在恒温、恒容密闭容器中发生反应:A(s) +2B(g) C(g)+D(g),当下列物理量不再发生变化时,表明该反应已达到平衡状态的是( )
C(g)+D(g),当下列物理量不再发生变化时,表明该反应已达到平衡状态的是( )
①混合气体的压强 ②混合气体的密度 ③各气态物质的物质的量浓度 ④气体的总物质的量 ⑤混合气体的平均相对分子质量
 C(g)+D(g),当下列物理量不再发生变化时,表明该反应已达到平衡状态的是( )
C(g)+D(g),当下列物理量不再发生变化时,表明该反应已达到平衡状态的是( )①混合气体的压强 ②混合气体的密度 ③各气态物质的物质的量浓度 ④气体的总物质的量 ⑤混合气体的平均相对分子质量
| A.②③⑤ | B.①②③ | C.①②③⑤ | D.①③④⑤ |
【知识点】 化学平衡状态本质及特征解读 化学平衡状态的判断方法解读
您最近一年使用:0次
2020-01-18更新
|
152次组卷
|
3卷引用:江西省南昌市第十中学2019-2020学年高二上学期期末考试化学试题
单选题
|
适中(0.65)
名校
10. 关于下列装置说法正确的是


| A.装置①中,盐桥中的Cl-移向ZnSO4溶液 |
| B.装置②工作一段时间后,b极附近溶液的pH增大 |
| C.用装置③精炼铜时,c极为粗铜 |
| D.装置④中电子由Zn流向Fe,装置中有Fe2+生成 |
您最近一年使用:0次
2019-01-18更新
|
289次组卷
|
5卷引用:2011届江西省八所重点中学联合考试高三(理综)化学部分
单选题
|
适中(0.65)
名校
11. 下列反应中符合下图图象的是
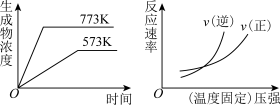

A.N2(g)+3H2(g) 2NH3(g);△H=-Q1kJ·mol-1(Q1>0) 2NH3(g);△H=-Q1kJ·mol-1(Q1>0) |
B.2SO3(g) 2SO2(g)+O2(g);△H=+Q2kJ·mol-1(Q2>0) 2SO2(g)+O2(g);△H=+Q2kJ·mol-1(Q2>0) |
C.4NH3(g)+5O2(g) 4NO(g)+6H2O(g);△H=-Q3kJ·mol-1(Q3>0) 4NO(g)+6H2O(g);△H=-Q3kJ·mol-1(Q3>0) |
D.H2(g)+CO(g) C(s)+H2O(g);△H=+Q4kJ·mol-1(Q4>0) C(s)+H2O(g);△H=+Q4kJ·mol-1(Q4>0) |
【知识点】 产物的物质的量与温度、压强的图像关系分析解读
您最近一年使用:0次
2021-01-19更新
|
128次组卷
|
21卷引用:2010年浙江省慈溪中学高二第二学期期中考试(普通班)化学试题
(已下线)2010年浙江省慈溪中学高二第二学期期中考试(普通班)化学试题(已下线)2014年化学高考题型专练六 盖斯定律应用与热化学方程式的书写练习卷2014-2015学年福建省清流一中高二上学期月考化学理试卷2014-2015学年福建省四地六校高二上学期第三次月考化学试卷2014-2015湖南省益阳市箴言中学高二1月月考化学试卷2016届甘肃省天水市秦安一中高三上学期期末化学试卷2015-2016学年福建省长泰县第一中学高二上学期期末化学试卷2016-2017学年四川省成都开发区实验中学高二10月月考化学卷2016-2017学年山东省菏泽市高二上学期期末学分认定考试B卷化学试卷广东省惠州市2017-2018学年高二上学期期末教学质量检测(理)化学试题广西河池市高级中学2017-2018学年高二上学期期末考试化学试题山西省原平市范亭中学2018-2019学年高二上学期期中考试化学试题黑龙江省齐齐哈尔市第八中学2018-2019学年高二上学期期末考试化学试题2020届高三化学选修4二轮专题练——化学平衡移动的图像分析 【精编25题】山西省实验中学2020届高三化学复习针对性试题集(三)黑龙江省牡丹江市穆棱市第一中学2019-2020学年高二上学期期末考试化学试题新疆维吾尔自治区喀什区第二中学2020-2021学年高二上学期期末考试化学试题湖北省宜昌市人文艺术高中2020-2021学年高二上学期期中考试化学试题河北省衡水市武强中学2020-2021学年高二上学期第一次月考化学试题海南省琼海市嘉积中学2022-2023学年高一下学期7月期末考试化学试题甘肃省兰州市教育局第四片区联考2023-2024学年高二上学期期中考试化学试题
单选题
|
适中(0.65)
真题
名校
12. 向体积为Va的0.05mol·L-1CH3COOH溶液中加入体积为Vb的0.05mol·L-1KOH溶液,下列关系错误的是
| A.Va>Vb时:c(CH3COOH) +c(CH3COO-)>c(K+) |
| B.Va=Vb时:c(CH3COOH) +c(H+)=c(OH-) |
| C.Va<Vb时:c(CH3COO-)> (K+)>c(OH-)> c(H+) |
| D.Va与Vb任意比时:c(K+)+ c(H+) = c(OH-)+ c(CH3COO-) |
您最近一年使用:0次
2016-12-09更新
|
930次组卷
|
29卷引用:2009年普通高等学校招生统一考试理综试题化学部分(安徽卷)
2009年普通高等学校招生统一考试理综试题化学部分(安徽卷)(已下线)2010年宁波市八校高二下学期期末联考化学试题(已下线)09-10年湖北恩施高二下学期期末测试化学卷(已下线)2010年湖北省黄冈中学高二上学期期中考试试题化学(已下线)2010—2011学年浙江省杭州师范大学附属中学高二下学期期中考试化学试卷(已下线)2010-2011学年辽宁省师大附中高二下学期期中考试化学试卷(已下线)2010-2011年福建省福州八中高二下学期期末考试化学试卷(已下线)2011-2012年江西省吉安一中高二上学期期中考试化学(理)试题(已下线)2011-2012学年山东省莘县实验高中高二上学期期中考试化学试卷(已下线)2011-2012学年天津市蓟县一中高二第二次月考化学试卷(已下线)2011-2012学年广东省三校高二下学期联考化学试卷2014-2015内蒙古赤峰市宁城县高二上学期期末考试化学试卷2014-2015河北枣强中学高二上学期期末考试化学试卷2015-2016学年吉林省吉林一中高二上期中考试化学试卷2015-2016学年江西省鹰潭市高二上学期期末质检化学试卷黑龙江省齐齐哈尔市2017-2018学年高二上学期期末考试化学试题吉林省辉南县中学2017-2018学年高二上学期期末考试化学试题(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化第4讲 守恒思想在化学中的应用——守恒法解题技巧【押题专练】云南省玉溪一中2018-2019学年高二上学期期末考试化学试题宁夏回族自治区银川市长庆高级中学2019-2020学年高二上学期第二次月考化学试题江西省南昌市第十中学2019-2020学年高二上学期期末考试化学试题(已下线)【南昌新东方】2019 南昌市三校(一中、十中、铁一中)高二上 期末江西省南昌市八一中学、洪都中学等七校2020-2021学年高二上学期期末联考化学试题新疆维吾尔自治区喀什区第二中学2020-2021学年高二上学期期末考试化学试题云南省保山第九中学2019-2020学年高二下学期期末考试化学试题(已下线)3.3.4 溶液中的粒子浓度(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)福建省福州第三中学2020-2021学年高二上学期期末考化学试题江西省宜春市万载中学2021-2022学年高二上学期第三次月考化学试题江西省丰城市第九中学2021-2022学年高二上学期第一次月考化学试题
单选题
|
适中(0.65)
名校
解题方法
13. 等体积、等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,分别滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是
| A.V3>V2>V1 | B.V3=V2=V1 | C.V3>V2=V1 | D.V1=V2>V3 |
【知识点】 酸碱混合时的定性判断及计算解读
您最近一年使用:0次
2022-03-03更新
|
1054次组卷
|
23卷引用:2010年福建省福州八中高二第二学期期末考试化学试题
(已下线)2010年福建省福州八中高二第二学期期末考试化学试题(已下线)2010-2011年福建省福州八中高二下学期期末考试化学试卷(已下线)2012-2013学年湖北荆门高二上学期期末教学质量检测化学试卷2015-2016学年重庆市第一中学高二上期中测试化学试卷吉林省延边第二中学2017-2018学年高二上学期第二次月考化学试题黑龙江省哈尔滨师范大学青冈实验中学校2018-2019学年高二上学期10月考试化学试题河北省唐山市开滦第二中学2018-2019学年高二下学期期末考试化学试题河南省鲁山县第一高级中学2019-2020学年高二上学期9月月考化学试题甘肃省静宁县第一中学2019-2020学年高二上学期第一次月考化学试题宁夏吴忠中学2019-2020学年高二上学期期中考试化学试题吉林省吉林市第五十五中学2019-2020学年高二上学期期末考试化学试题2020年人教版高二化学选修4第三章《水溶液中的离子平衡》练习4—1河北省新乐市第一中学2019-2020学年高二上学期第二次月考化学试题上海市金山中学2018-2019学年高二下学期期末等级考试化学试题人教版(2019)高二化学选择性必修1第三章 水溶液中的离子反应与平衡 易错疑难集训(二)河南省项城市第三高级中学2020-2021学年高二上学期第三次考试化学试题新疆维吾尔自治区喀什区第二中学2020-2021学年高二上学期期末考试化学试题青海省西宁市普通高中五校2020-2021学年高二上学期期末联考化学试题选择性必修1(SJ)专题3易错疑难集训(一)吉林省长春市第二中学2021-2022学年高二上学期第一次月考化学试题新疆哈密市第八中学2021-2022学年高二上学期期末考试化学试题陕西省汉中中学2021-2022学年高二上学期第四次月考化学试题山西省阳高县第一中学校2022-2023学年高二上学期十一月线上检测化学试题
单选题
|
适中(0.65)
名校
解题方法
14. 下列有关说法中正确的是
| A.Ksp(AB2)<Ksp(CD),说明AB2 的溶解度小于CD 的溶解度 |
| B.在ZnS的沉淀溶解平衡体系中加入蒸馏水,ZnS的Ksp增大 |
| C.AgCl 分别在同浓度的CaCl2溶液和NaCl 溶液中溶解度不同 |
| D.在CaCO3的沉淀溶解平衡体系中加入稀盐酸,沉淀溶解平衡不移动 |
【知识点】 难溶电解质的溶解平衡 沉淀溶解平衡的应用
您最近一年使用:0次
2020-02-17更新
|
84次组卷
|
2卷引用:河北省沧州市泊头市第一中学2019-2020学年高二上学期第三次月考化学试题
单选题
|
适中(0.65)
名校
解题方法
15. 室温时, 在水中的沉淀溶解平衡曲线如图所示。已知
在水中的沉淀溶解平衡曲线如图所示。已知 的溶度积(室温)
的溶度积(室温)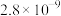 ,下列说法中不正确的是
,下列说法中不正确的是

 在水中的沉淀溶解平衡曲线如图所示。已知
在水中的沉淀溶解平衡曲线如图所示。已知 的溶度积(室温)
的溶度积(室温)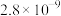 ,下列说法中不正确的是
,下列说法中不正确的是
A. 的数值为 的数值为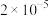 | B. 点时有 点时有 生成 生成 |
C.加入蒸馏水可使溶液由 点变成 点变成 点 点 | D. 点与 点与 点对应的溶度积相等 点对应的溶度积相等 |
【知识点】 难溶电解质的溶解平衡
您最近一年使用:0次
2022-11-18更新
|
691次组卷
|
38卷引用:2010年浙江江山实验中学高二年级5月月考化学试卷
(已下线)2010年浙江江山实验中学高二年级5月月考化学试卷(已下线)2012届浙江省余姚中学高三上学期期中考试化学试卷(已下线)2013届陕西省宝鸡市高三第三次模拟理综化学试卷2014-2015陕西省西安市庆安高级中学高二上学期期末化学试卷2014-2015陕西省西安市七十中高二上学期期末考试化学试卷2015-2016学年广西南宁市二十六中高二下学期期中化学试卷2016-2017学年广西陆川中学高二上9月月考化学卷2016-2017学年辽宁省沈阳铁路中学高二上期中化学试卷2016-2017学年山东省菏泽市高二上学期期末学分认定考试B卷化学试卷2018版化学(苏教版)高考总复习专题八课时跟踪训练--难溶电解质的沉淀溶解平衡黑龙江省牡丹江市第一高级中学2018届高三上学期期中考试化学试题江西省临川实验学校2017-2018学年高二上学期期末质量检测化学试题安徽省滁州市民办高中2017-2018学年高二下学期第一次联考化学试题河北省承德市隆化县存瑞中学2018-2019学年高二上学期第二次质检化学试题广州省广州市石化中学2018-2019学年高二上学期期末考试化学试题山东省德州市陵城区第一中学2019-2020学年高二12月月考化学试题黑龙江省双鸭山市第一中学2020届高三12月月考化学试题江西省新余市分宜中学2019-2020学年高二上学期第二次段考化学试题(已下线)考点13 沉淀溶解平衡-2020年高考化学命题预测与模拟试题分类精编湖南省株洲市第二中学2019-2020学年高二上学期入学考试化学试题山西省朔州市怀仁市第一中学校云东校区2019-2020学年高二下学期期末考试化学试题(已下线)3.4.1 沉淀溶解平衡原理(重点练)-2020-2021学年高二化学十分钟同步课堂专练(苏教版选修4)山西省长治市第二中学校2020-2021学年高二上学期第二次月考化学试题新疆维吾尔自治区喀什区第二中学2020-2021学年高二上学期期末考试化学试题安徽省合肥六校联盟2020-2021学年高二上学期期末联考化学试题陕西省黄陵中学2020-2021学年高二上学期期末考试化学试题河北省石家庄市辛集市第一中学2020-2021学年高二月考第四次考试(一)化学试题(已下线)专题07 电解质溶液—2022年高考化学二轮复习讲练测(全国版)-测试(已下线)卷09 水溶液中的离子平衡-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)第33练 沉淀溶解平衡-2023年高考化学一轮复习小题多维练(全国通用)江西省抚州市崇仁县第二中学2021-2022学年高二上学期第二次月考化学试题黑龙江省牡丹江市第二中学2022-2023学年高二上学期期中考试化学试题河北省隆化存瑞中学2022-2023学年高二上学期期中考试化学试题江西省抚州市金溪一中等三校2022-2023年高二上学期第二次联考化学试题辽宁省鞍山市普通高中2022-2023学年高二上学期第三次月考化学试题(已下线)第15讲 沉淀溶解平衡-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)(已下线)考点巩固卷09 水溶液中的离子反应与平衡(4大考点62题)-2024年高考化学一轮复习考点通关卷(新高考通用)天津市第四十七中学2023-2024学年高二上学期12月月考化学试题
单选题
|
适中(0.65)
名校
解题方法
16. LiFePO4电池具有稳定性高、对环境友好等优点,可用于电动汽车。该电池放电时电极反应式为:正极:FePO4 +Li++e−=LiFePO4,负极:Li-e− = Li+,下列说法中正确的是( )
| A.可加入硫酸以提高电解液的导电性 |
| B.充电时动力电池上标注“-”的电极应与外接电源的负极相连 |
| C.充电时阳极反应式:Li++e−=Li |
| D.放电时电池内部Li+向负极移动 |
您最近一年使用:0次
2020-10-25更新
|
149次组卷
|
3卷引用:福建省三明市泰宁第一中学2020-2021学年高二上学期学分认定暨第一次阶段考试化学试题
二、填空题 添加题型下试题
填空题
|
适中(0.65)
名校
17. 合成氨工业中,每生产2molNH3,放出 92.4kJ 热量。
(1)写出合成氨反应的热化学方程式为_______ 。
(2)已知:

1molN-H 键断裂吸收的能量等于_______ kJ。
(3)甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
已知:CHOH(g)=HCHO(g)+H2(g)△H=+84kJ⋅ mol−1
2H2 (g)+O2(g)=2H2O(g)△H=−484kJ⋅ mol−1
工业上常以甲醇为原料制取甲醛,请写出 CH3OH(g)与 O2(g)反应生成 HCHO(g)和 H2O(g)的热化学 方程式:_______
(1)写出合成氨反应的热化学方程式为
(2)已知:

1molN-H 键断裂吸收的能量等于
(3)甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
已知:CHOH(g)=HCHO(g)+H2(g)△H=+84kJ⋅ mol−1
2H2 (g)+O2(g)=2H2O(g)△H=−484kJ⋅ mol−1
工业上常以甲醇为原料制取甲醛,请写出 CH3OH(g)与 O2(g)反应生成 HCHO(g)和 H2O(g)的热化学 方程式:
您最近一年使用:0次
填空题
|
适中(0.65)
名校
18. T℃时,在一个体积为 2L 的容器中,A 气体与 B 气体反应生成 C 气体,反应过程中 A、B、C 的变化如图所示。
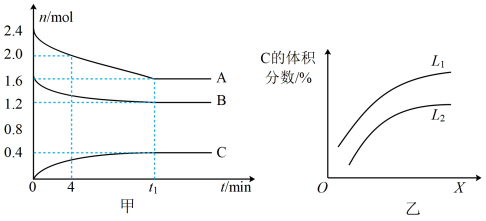
(1)根据甲图,写出反应的化学方程式_______ 。
(2)0~4min 时,A的平均反应速率为_______ 。
(3)已知:K(300℃)>K(350℃),该反应是_______ (填“吸热”或“放热”)反应。
(4)如乙图是上述反应平衡混合气中C的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中 X 代表的是_______ (填“温度”或“压强”)。判断 L1_______ L2(填“>” 或“<”),理由是_______ 。

(1)根据甲图,写出反应的化学方程式
(2)0~4min 时,A的平均反应速率为
(3)已知:K(300℃)>K(350℃),该反应是
(4)如乙图是上述反应平衡混合气中C的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中 X 代表的是
您最近一年使用:0次
三、解答题 添加题型下试题
解答题-实验探究题
|
较易(0.85)
名校
解题方法
19. 某学生用0.2 mol·L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.酸式滴定管准确量取25.00mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞试液
B.用标准氢氧化钠溶液润洗滴定管2~3次
C.把盛有标准氢氧化钠溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2~3mL处
E.调节液面至“0”或“0”刻度以下,记下读数
F.把锥形瓶放在滴定管的下面,用标准氢氧化钠溶液滴定至终点并记下滴定管的读数
回答下列问题:
(1)正确的操作顺序是:B、_______________ 、F(填序号)
(2)滴定结果如下:
根据以上数据可以计算出盐酸的物质的量浓度为_______________ mol·L-1. (计算结果小数点后保留两位有效数字)
(3)达到滴定终点的标志是________________________________
(4)以下操作造成测定结果偏高的原因可能是___________________ 。
A. 取待测液时,未用待测夜润洗酸式滴定管
B. 滴定前读数时,俯视滴定管的刻度,其它操作均正确
C. 滴定管滴定前无气泡,滴定后有气泡
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
A.酸式滴定管准确量取25.00mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞试液
B.用标准氢氧化钠溶液润洗滴定管2~3次
C.把盛有标准氢氧化钠溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2~3mL处
E.调节液面至“0”或“0”刻度以下,记下读数
F.把锥形瓶放在滴定管的下面,用标准氢氧化钠溶液滴定至终点并记下滴定管的读数
回答下列问题:
(1)正确的操作顺序是:B、
(2)滴定结果如下:
| NaOH起始读数 | NaOH终点读数 | |
| 第一次 | 0.10mL | 18.60mL |
| 第二次 | 20.20mL | 38.80mL |
(3)达到滴定终点的标志是
(4)以下操作造成测定结果偏高的原因可能是
A. 取待测液时,未用待测夜润洗酸式滴定管
B. 滴定前读数时,俯视滴定管的刻度,其它操作均正确
C. 滴定管滴定前无气泡,滴定后有气泡
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
您最近一年使用:0次
2020-03-04更新
|
83次组卷
|
2卷引用:甘肃省岷县第一中学2019-2020学年高二上学期期末考试化学试题
四、填空题 添加题型下试题
填空题
|
适中(0.65)
名校
解题方法
20. 水溶液存在离子平衡,回答下列问题:
(1)Na2SO3水溶液呈_______ (填“酸”、“中”、“碱”)性,原因是(用离子方程式):_______ 。
(2)已知T℃时,纯水中c(OH-)为10-6mol·L-1,则
①该温度时0.1mol·L-1NaOH溶液pH为_______ 。
②该温度下,将pH=2的H2SO4溶液与pH=9的NaOH溶液按体积比1:9混合(忽略溶液体积变化),所得混合溶液的pH为_______ 。
(3)常温下,在25mL的氢氧化钠溶液中逐滴加入0.2mol·L-1醋酸溶液,滴定曲线如图所示。

①在B点,溶液中n(CH3COO-)为_______ 。
②在D点,c(CH3COO-)_______ c(Na+)(填“<”“>”或“=”)。
(4)常温下,在0.1mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液,充分搅拌有浅蓝色氢氧化铜沉淀生成,当溶液的pH为8时,c(Cu2+)=_______ 。(已知常温时Cu(OH)的Ksp=2.2×10-20)
(1)Na2SO3水溶液呈
(2)已知T℃时,纯水中c(OH-)为10-6mol·L-1,则
①该温度时0.1mol·L-1NaOH溶液pH为
②该温度下,将pH=2的H2SO4溶液与pH=9的NaOH溶液按体积比1:9混合(忽略溶液体积变化),所得混合溶液的pH为
(3)常温下,在25mL的氢氧化钠溶液中逐滴加入0.2mol·L-1醋酸溶液,滴定曲线如图所示。

①在B点,溶液中n(CH3COO-)为
②在D点,c(CH3COO-)
(4)常温下,在0.1mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液,充分搅拌有浅蓝色氢氧化铜沉淀生成,当溶液的pH为8时,c(Cu2+)=
您最近一年使用:0次
填空题
|
适中(0.65)
名校
21. 在我们的日常生活中,电化学技术与我们密切相关。根据所学电化学知识,回答下列问题:
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是_______ 。
A. CH4(g)+O2(g)=CO2(g)+H2O(g)
B. NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
C. 2H2O(l)=2H2(g)+O2(g)
(2)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与下图中电解池相连,其中,a为电解液,X和Y是两块电极板,则:

①若X和Y均为惰性电极,a为NaCl 溶液,则电解时的化学反应方程式为_______ 。
③若X、Y分别为铁和铜,a为 H2SO4溶液,则电解池的总反应式为:_______ 。
(4)现有一种新型的高能电池-钠硫电池(熔融的钠、硫为两极,以Na+导电的β—Al2O3陶瓷作固体电解质),反应式为:2Na+xS Na2Sx,
Na2Sx,

上述电解都是用该电池作电源(如图),该电池的正极反应为:_______ 。
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
A. CH4(g)+O2(g)=CO2(g)+H2O(g)

B. NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)

C. 2H2O(l)=2H2(g)+O2(g)
(2)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与下图中电解池相连,其中,a为电解液,X和Y是两块电极板,则:

①若X和Y均为惰性电极,a为NaCl 溶液,则电解时的化学反应方程式为
③若X、Y分别为铁和铜,a为 H2SO4溶液,则电解池的总反应式为:
(4)现有一种新型的高能电池-钠硫电池(熔融的钠、硫为两极,以Na+导电的β—Al2O3陶瓷作固体电解质),反应式为:2Na+xS
 Na2Sx,
Na2Sx,
上述电解都是用该电池作电源(如图),该电池的正极反应为:
您最近一年使用:0次
填空题
|
适中(0.65)
名校
22. 已知常温下部分弱电解质的电离平衡常数如下表:
(1)常温下,pH 相同的三种溶液①NaF 溶液 ②NaClO 溶液 ③Na2CO3 溶液,其物质的量溶度由大到小的顺序是_______ (填序号)
(2)25°C 时,pH=4 的 NH4Cl 溶液中各离子浓度的大小关系为_______ 。
(3)0.1 mol/L 的 NaClO 溶液和 0.1 mol/L 的 NaHCO3 溶液中,c(ClO- )_______ c(HCO )(填“>,<,=”)
)(填“>,<,=”)
(4)向 NaClO 溶液中通入少量的 CO2,所发生的离子方程式为_______ 。
| 化学式 | HF | HClO | H2CO3 | NH3∙H2O |
| 电离常数 | 6.8×10-4 | 4.7×10-8 | K1 =4.3×10-7 K2 =5.6×10-11 | Kb =1.7×10-5 |
(1)常温下,pH 相同的三种溶液①NaF 溶液 ②NaClO 溶液 ③Na2CO3 溶液,其物质的量溶度由大到小的顺序是
(2)25°C 时,pH=4 的 NH4Cl 溶液中各离子浓度的大小关系为
(3)0.1 mol/L 的 NaClO 溶液和 0.1 mol/L 的 NaHCO3 溶液中,c(ClO- )
 )(填“>,<,=”)
)(填“>,<,=”)(4)向 NaClO 溶液中通入少量的 CO2,所发生的离子方程式为
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:常见无机物及其应用、化学反应原理
试卷题型(共 22题)
题型
数量
单选题
16
填空题
5
解答题
1
试卷难度
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 明矾的净水作用及原理 盐类水解在生活、生产中的应用 一次电池 | |
| 2 | 0.94 | 影响水电离的因素 | |
| 3 | 0.65 | 吸热反应和放热反应 化学反应进行方向的判据 | |
| 4 | 0.65 | 铜的电解精炼 | |
| 5 | 0.65 | 化学平衡的移动及其影响因素 | |
| 6 | 0.65 | 水溶液中水的电离程度及的计算 一元强酸与一元弱酸的比较 弱电解质在水溶液中的电离平衡 温度对盐类水解的影响 | |
| 7 | 0.65 | 电解后溶液的复原 | |
| 8 | 0.85 | 金属的化学腐蚀与电化学腐蚀 金属的防护 | |
| 9 | 0.65 | 化学平衡状态本质及特征 化学平衡状态的判断方法 | |
| 10 | 0.65 | 原电池 铜的电解精炼 | |
| 11 | 0.65 | 产物的物质的量与温度、压强的图像关系分析 | |
| 12 | 0.65 | 弱电解质的电离平衡 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |
| 13 | 0.65 | 酸碱混合时的定性判断及计算 | |
| 14 | 0.65 | 难溶电解质的溶解平衡 沉淀溶解平衡的应用 | |
| 15 | 0.65 | 难溶电解质的溶解平衡 | |
| 16 | 0.65 | 二次电池 新型电池 | |
| 二、填空题 | |||
| 17 | 0.65 | 盖斯定律与热化学方程式 根据△H=反应物的键能之和-生成物的键能之和进行计算 | |
| 18 | 0.65 | 化学反应速率计算 化学平衡的移动及其影响因素 化学平衡常数的影响因素及应用 与物质百分含量变化有关图像的分析 | |
| 20 | 0.65 | 溶液pH的计算 盐类水解规律 溶度积 | |
| 21 | 0.65 | 原电池概念及组成 原电池电极反应式书写 电解池电极反应式及化学方程式的书写与判断 | |
| 22 | 0.65 | 电离平衡常数及影响因素 盐溶液中离子浓度大小的比较 影响盐类水解的内因 | |
| 三、解答题 | |||
| 19 | 0.85 | 酸碱中和滴定实验基本操作及步骤 酸碱中和滴定的误差分析 酸碱中和滴定的综合考查 | 实验探究题 |



