1 . 一定温度下,将 和
和 各
各 充入
充入 密闭容器中,发生反应
密闭容器中,发生反应 ,2分钟后达到平衡状态,测得
,2分钟后达到平衡状态,测得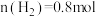 。求:
。求:
(1)2分钟内 的平均反应速率为
的平均反应速率为______ 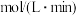 。
。
(2) 的平衡转化率为
的平衡转化率为______ 。
(3)该温度下反应的平衡常数为______ 。
 和
和 各
各 充入
充入 密闭容器中,发生反应
密闭容器中,发生反应 ,2分钟后达到平衡状态,测得
,2分钟后达到平衡状态,测得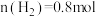 。求:
。求:(1)2分钟内
 的平均反应速率为
的平均反应速率为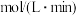 。
。(2)
 的平衡转化率为
的平衡转化率为(3)该温度下反应的平衡常数为
您最近半年使用:0次
2 . 绿色能源是当今重要的研究热点,2022年3月12日,中科院大连化物所的 制汽油科研项目成功了,这是一项重大成功,直接影响的是国计民生。寻找新的能源成为了科学研究的热点。
制汽油科研项目成功了,这是一项重大成功,直接影响的是国计民生。寻找新的能源成为了科学研究的热点。
Ⅰ. 甲烷化反应为:
甲烷化反应为: ,该反应又称Sabatier反应。
,该反应又称Sabatier反应。
(1)相关的化学键键能数据如下表所示:
Sabatier反应的
__________  。
。
(2)若要同时提高反应的速率和甲烷的平衡转化率,可以采取的措施有:__________ (写一点即可)。
(3)在体积为 的恒温密闭容器中,投入
的恒温密闭容器中,投入 、
、 进行上述反应,达到平衡后,若
进行上述反应,达到平衡后,若 的转化率为20%,则该反应的平衡常数为
的转化率为20%,则该反应的平衡常数为
__________ 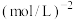 (写计算式)。
(写计算式)。
(4) 转化为
转化为 也可通过电化学反应实现,其原理如图所示:
也可通过电化学反应实现,其原理如图所示:
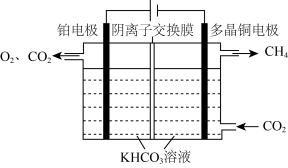
电解过程中,阴极室和阳极室的 溶液浓度基本保持不变,阴极的电极反应式为
溶液浓度基本保持不变,阴极的电极反应式为__________ ;若生成 理论上阳极室生成混合气体的体积为
理论上阳极室生成混合气体的体积为__________ L(标准状况,忽略气体的溶解)。
(5) 是共价化合物,分子中所有的原子都达到稳定结构,
是共价化合物,分子中所有的原子都达到稳定结构, 此分子中含有
此分子中含有__________ mol共用电子对,试写出其分子的结构式:__________ 。
 制汽油科研项目成功了,这是一项重大成功,直接影响的是国计民生。寻找新的能源成为了科学研究的热点。
制汽油科研项目成功了,这是一项重大成功,直接影响的是国计民生。寻找新的能源成为了科学研究的热点。Ⅰ.
 甲烷化反应为:
甲烷化反应为: ,该反应又称Sabatier反应。
,该反应又称Sabatier反应。(1)相关的化学键键能数据如下表所示:
化学键 | H—H | H—O | C—H | C=O |
| 436 | 463 | 413 | 803 |

 。
。(2)若要同时提高反应的速率和甲烷的平衡转化率,可以采取的措施有:
(3)在体积为
 的恒温密闭容器中,投入
的恒温密闭容器中,投入 、
、 进行上述反应,达到平衡后,若
进行上述反应,达到平衡后,若 的转化率为20%,则该反应的平衡常数为
的转化率为20%,则该反应的平衡常数为
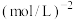 (写计算式)。
(写计算式)。(4)
 转化为
转化为 也可通过电化学反应实现,其原理如图所示:
也可通过电化学反应实现,其原理如图所示:
电解过程中,阴极室和阳极室的
 溶液浓度基本保持不变,阴极的电极反应式为
溶液浓度基本保持不变,阴极的电极反应式为 理论上阳极室生成混合气体的体积为
理论上阳极室生成混合气体的体积为(5)
 是共价化合物,分子中所有的原子都达到稳定结构,
是共价化合物,分子中所有的原子都达到稳定结构, 此分子中含有
此分子中含有
您最近半年使用:0次
名校
解题方法
3 . 二氧化碳的捕集和转化是科学研究中的热点问题,我国科研人员提出了由 和
和 转化为
转化为 和
和 的反应历程,其示意图如图。
的反应历程,其示意图如图。
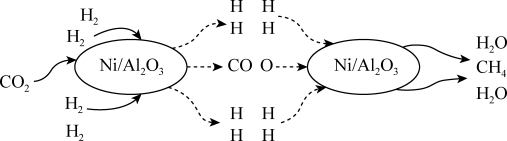
(1)根据信息可知该可逆反应的化学方程式为 ,催化剂
,催化剂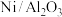
___________ (填“能”或“不能”) 提高平衡转化率。
提高平衡转化率。
(2)200℃下,在一密闭容器中充入一定量的 与
与 发生反应
发生反应 。一段时间后反应达平衡若其他条件不变,温度从200℃升至400℃,反应重新达到平衡时,
。一段时间后反应达平衡若其他条件不变,温度从200℃升至400℃,反应重新达到平衡时, 的体积分数增加。下列说法正确的是
的体积分数增加。下列说法正确的是___________ (填字母)。
a.该反应的 b.200℃下,减小
b.200℃下,减小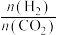 的值,
的值, 的平衡转化率升高
的平衡转化率升高
c.平衡常数大小:K(400℃)>K(200℃) d.反应达到平衡时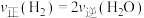
(3)一定条件下,反应体系中 平衡转化率
平衡转化率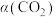 与L和X的关系如图所示,L和X表示温度或压强。
与L和X的关系如图所示,L和X表示温度或压强。
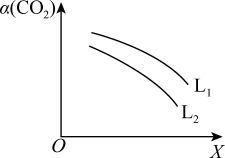
①L表示的物理量是___________ 。
②
___________  (填“<”或“>”),判断理由是
(填“<”或“>”),判断理由是___________ 。
(4)向1L恒容密闭容器中加入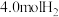 ,
,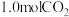 ,控制条件(催化剂、温度为
,控制条件(催化剂、温度为 )使之发生上述反应,测得容器内气体的压强随时间的变化如图所示:
)使之发生上述反应,测得容器内气体的压强随时间的变化如图所示:
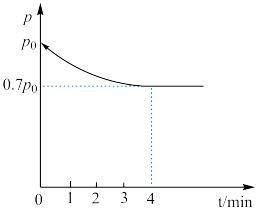
①求4min内 的反应速率
的反应速率
___________ 。
②此温度下,该反应的化学平衡常数
___________ 。
(5)下列情况,不能用勒夏特列原理解释的是___________ (填字母)。
a. 、
、 、HI平衡混合气体加压后颜色变深
、HI平衡混合气体加压后颜色变深
b.夏天,打开冰镇啤酒瓶,立即冒出大量泡沫
c.生活中,用饱和碳酸钠溶液洗去锅碗瓢盆上的油污,且热溶液的效果更好
d.在醋酸溶液中,加入一些醋酸钠固体使溶液的pH增大
 和
和 转化为
转化为 和
和 的反应历程,其示意图如图。
的反应历程,其示意图如图。
(1)根据信息可知该可逆反应的化学方程式为
 ,催化剂
,催化剂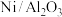
 提高平衡转化率。
提高平衡转化率。(2)200℃下,在一密闭容器中充入一定量的
 与
与 发生反应
发生反应 。一段时间后反应达平衡若其他条件不变,温度从200℃升至400℃,反应重新达到平衡时,
。一段时间后反应达平衡若其他条件不变,温度从200℃升至400℃,反应重新达到平衡时, 的体积分数增加。下列说法正确的是
的体积分数增加。下列说法正确的是a.该反应的
 b.200℃下,减小
b.200℃下,减小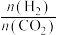 的值,
的值, 的平衡转化率升高
的平衡转化率升高c.平衡常数大小:K(400℃)>K(200℃) d.反应达到平衡时
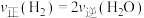
(3)一定条件下,反应体系中
 平衡转化率
平衡转化率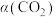 与L和X的关系如图所示,L和X表示温度或压强。
与L和X的关系如图所示,L和X表示温度或压强。
①L表示的物理量是
②

 (填“<”或“>”),判断理由是
(填“<”或“>”),判断理由是(4)向1L恒容密闭容器中加入
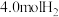 ,
,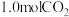 ,控制条件(催化剂、温度为
,控制条件(催化剂、温度为 )使之发生上述反应,测得容器内气体的压强随时间的变化如图所示:
)使之发生上述反应,测得容器内气体的压强随时间的变化如图所示:
①求4min内
 的反应速率
的反应速率②此温度下,该反应的化学平衡常数

(5)下列情况,不能用勒夏特列原理解释的是
a.
 、
、 、HI平衡混合气体加压后颜色变深
、HI平衡混合气体加压后颜色变深b.夏天,打开冰镇啤酒瓶,立即冒出大量泡沫
c.生活中,用饱和碳酸钠溶液洗去锅碗瓢盆上的油污,且热溶液的效果更好
d.在醋酸溶液中,加入一些醋酸钠固体使溶液的pH增大
您最近半年使用:0次
4 . 酚类化合物在医疗、环保、工业等方面有着广泛的用途。
(1)苯酚可用于外科器械消毒、皮肤杀菌与止痒,可通过磺化法制备。该工艺具体流程如下:
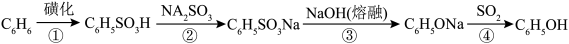
反应③的化学方程式为___________ 。
(2)石油加工、造纸等企业易产生含有苯酚的工业废水,可通过O3-H2O2氧化法进行处理,其原理为C6H5OH+H2O2+O3→CO2+H2O(非可逆反应,反应未配平)。在T1℃和T2℃时,分别向含有苯酚的水样中加入等量的30%H2O2溶液,再以相同的流速向水样中通入O3,测得水样中苯酚的含量随时间变化的曲线如图所示。
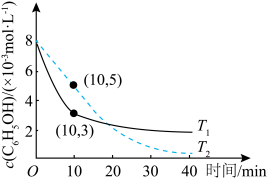
①在T1℃时,0~10min内,C6H5OH的平均反应速率为___________ 。
②请判断T1和T2的大小:T1___________ (填“>”“<”或“=”)T2,T1℃时对工业废水中苯酚的去除率低于T2℃时的原因可能是___________ (写一种即可)。
(3)利用FeCl3溶液与苯酚的显色反应,可定性检测工业废水中的苯酚,其反应原理为Fe3++6C6H5OH [Fe(C6H5O)6]3-(紫色)+6H+。反应到达平衡时,下列说法正确的有___________(填标号)。
[Fe(C6H5O)6]3-(紫色)+6H+。反应到达平衡时,下列说法正确的有___________(填标号)。
(4)邻苯二酚钠类配体(L)与金属离子(M)形成的配合物可应用于医药、水处理等领域。其溶液中存在平衡:
M+L ML K1
ML K1
ML+L ML2 K2
ML2 K2
某研究小组配制了M与L起始浓度比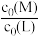 不同的系列溶液,其中L的起始浓度c0(L)=0.02mol/L。
不同的系列溶液,其中L的起始浓度c0(L)=0.02mol/L。
测得平衡时L、ML、ML2的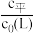 与
与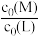 的变化关系如图所示。
的变化关系如图所示。
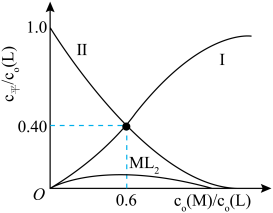
①表示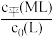 与
与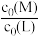 变化关系的曲线为
变化关系的曲线为___________ (填“Ⅰ”或“Ⅱ”)。
②当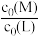 =0.6时,c平(ML2)=
=0.6时,c平(ML2)=___________ ,K1=___________ 。
(1)苯酚可用于外科器械消毒、皮肤杀菌与止痒,可通过磺化法制备。该工艺具体流程如下:
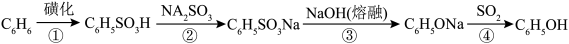
反应③的化学方程式为
(2)石油加工、造纸等企业易产生含有苯酚的工业废水,可通过O3-H2O2氧化法进行处理,其原理为C6H5OH+H2O2+O3→CO2+H2O(非可逆反应,反应未配平)。在T1℃和T2℃时,分别向含有苯酚的水样中加入等量的30%H2O2溶液,再以相同的流速向水样中通入O3,测得水样中苯酚的含量随时间变化的曲线如图所示。

①在T1℃时,0~10min内,C6H5OH的平均反应速率为
②请判断T1和T2的大小:T1
(3)利用FeCl3溶液与苯酚的显色反应,可定性检测工业废水中的苯酚,其反应原理为Fe3++6C6H5OH
 [Fe(C6H5O)6]3-(紫色)+6H+。反应到达平衡时,下列说法正确的有___________(填标号)。
[Fe(C6H5O)6]3-(紫色)+6H+。反应到达平衡时,下列说法正确的有___________(填标号)。| A.加水稀释,溶液pH减小 |
B.滴入几滴浓盐酸,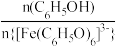 增大 增大 |
| C.加入少量NaOH固体,反应平衡常数增大 |
| D.加入少量Cu粉,溶液紫色变浅 |
(4)邻苯二酚钠类配体(L)与金属离子(M)形成的配合物可应用于医药、水处理等领域。其溶液中存在平衡:
M+L
 ML K1
ML K1ML+L
 ML2 K2
ML2 K2某研究小组配制了M与L起始浓度比
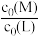 不同的系列溶液,其中L的起始浓度c0(L)=0.02mol/L。
不同的系列溶液,其中L的起始浓度c0(L)=0.02mol/L。测得平衡时L、ML、ML2的
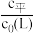 与
与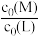 的变化关系如图所示。
的变化关系如图所示。
①表示
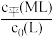 与
与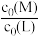 变化关系的曲线为
变化关系的曲线为②当
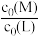 =0.6时,c平(ML2)=
=0.6时,c平(ML2)=
您最近半年使用:0次
5 . Ⅰ.恒温恒容下,将2mol气体A和2mol气体B通入体积为2L的密闭容器中,发生如下反应:2A(g)+B(g)  xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mol/L。
xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mol/L。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为_________ 。
(2)x=__________ 。
(3)下列各项可作为该反应达到平衡状态的标志是________(填字母)。
Ⅱ.在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g)△H=-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
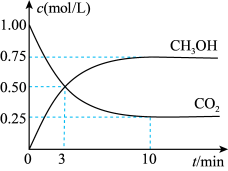
(4)氢气的转化率=________ 。
(5)下列措施能使平衡体系中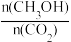 增大的是_______(填字母)。
增大的是_______(填字母)。
Ⅲ.恒温下,在容积为2L的恒容密闭容器A中通入1mol N2与1molH2的混合气体,发生如下反应:N2(g)+3H2(g) 2NH3(g) △H<0,一段时间后,达到平衡,若平衡时氢气的物质的量为0.4mol。
2NH3(g) △H<0,一段时间后,达到平衡,若平衡时氢气的物质的量为0.4mol。
(6)若在此温度下,向另一容积为1L的恒容密闭容器B中按物质的量分别为2mol、1mol、1mol充入N2、H2、NH3,此时,该反应是否处于平衡状态_______ (填“是”或“否"),此时若没有达平衡,反应向_____ (填“正反应”或“逆反应”)方向进行。
 xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mol/L。
xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2molB,并测得C的浓度为1.2mol/L。(1)从开始反应至达到平衡状态,生成C的平均反应速率为
(2)x=
(3)下列各项可作为该反应达到平衡状态的标志是________(填字母)。
| A.压强不再变化 |
| B.气体密度不再变化 |
| C.气体平均相对分子质量不再变化 |
| D.A的消耗速率与B的消耗速率之比为2:1 |
Ⅱ.在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)△H=-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g)△H=-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(4)氢气的转化率=
(5)下列措施能使平衡体系中
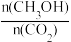 增大的是_______(填字母)。
增大的是_______(填字母)。| A.将H2O(g)从体系中分离出去 | B.充入He,使体系压强增大 |
| C.升高温度 | D.再充入1molH2 |
Ⅲ.恒温下,在容积为2L的恒容密闭容器A中通入1mol N2与1molH2的混合气体,发生如下反应:N2(g)+3H2(g)
 2NH3(g) △H<0,一段时间后,达到平衡,若平衡时氢气的物质的量为0.4mol。
2NH3(g) △H<0,一段时间后,达到平衡,若平衡时氢气的物质的量为0.4mol。(6)若在此温度下,向另一容积为1L的恒容密闭容器B中按物质的量分别为2mol、1mol、1mol充入N2、H2、NH3,此时,该反应是否处于平衡状态
您最近半年使用:0次
名校
解题方法
6 . 回答下列问题:
(1)常温常压下,已知 的燃烧热为
的燃烧热为 。写出表示
。写出表示 燃烧热的热化学方程式
燃烧热的热化学方程式_____________ ;
(2)科技工作者运用DFT计算研究在甲醇钯基催化剂表面上制氢的反应历程如图所示。其中吸附在钯催化剂表面上的物种用*标注。
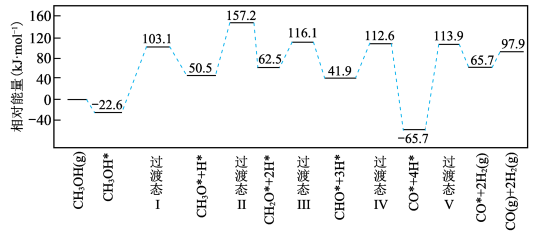
该历程中最大能垒活化能______  ,该步骤的化学方程式为
,该步骤的化学方程式为________ 。
(3)一定条件下,利用甲烷可将 还原为
还原为 。在一密闭容器中充入
。在一密闭容器中充入 、
、 气体各
气体各 ,发生反应
,发生反应
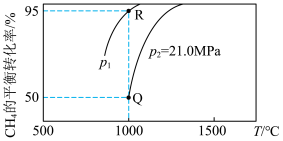
 。测得
。测得 的平衡转化率随温度、压强的变化曲线如图所示,
的平衡转化率随温度、压强的变化曲线如图所示,
______ 0(填“>”“<”或“=”),
_____  (填“>”“<”或“=”);
(填“>”“<”或“=”); 点的压强平衡常数
点的压强平衡常数
_______  (用平衡分压代替平衡浓度计算,气体的分压=气体总压强
(用平衡分压代替平衡浓度计算,气体的分压=气体总压强 该气体的物质的量分数)。
该气体的物质的量分数)。
(4)利用强氧化剂可以对烟气进行脱硫脱硝。在某工厂中,用 溶液作氧化剂,控制
溶液作氧化剂,控制 ,将烟气中
,将烟气中 和
和 转化为高价含氧酸根离子。测得溶液在不同温度时,脱除率如下表:
转化为高价含氧酸根离子。测得溶液在不同温度时,脱除率如下表:
请写出 脱除原理的离子方程式
脱除原理的离子方程式___________ ;温度高于50℃时,脱除率逐渐降低,原因是___________ 。
(1)常温常压下,已知
 的燃烧热为
的燃烧热为 。写出表示
。写出表示 燃烧热的热化学方程式
燃烧热的热化学方程式(2)科技工作者运用DFT计算研究在甲醇钯基催化剂表面上制氢的反应历程如图所示。其中吸附在钯催化剂表面上的物种用*标注。

该历程中最大能垒活化能
 ,该步骤的化学方程式为
,该步骤的化学方程式为(3)一定条件下,利用甲烷可将
 还原为
还原为 。在一密闭容器中充入
。在一密闭容器中充入 、
、 气体各
气体各 ,发生反应
,发生反应
 。测得
。测得 的平衡转化率随温度、压强的变化曲线如图所示,
的平衡转化率随温度、压强的变化曲线如图所示,

 (填“>”“<”或“=”);
(填“>”“<”或“=”); 点的压强平衡常数
点的压强平衡常数
 (用平衡分压代替平衡浓度计算,气体的分压=气体总压强
(用平衡分压代替平衡浓度计算,气体的分压=气体总压强 该气体的物质的量分数)。
该气体的物质的量分数)。
(4)利用强氧化剂可以对烟气进行脱硫脱硝。在某工厂中,用
 溶液作氧化剂,控制
溶液作氧化剂,控制 ,将烟气中
,将烟气中 和
和 转化为高价含氧酸根离子。测得溶液在不同温度时,脱除率如下表:
转化为高价含氧酸根离子。测得溶液在不同温度时,脱除率如下表:| 温度/℃ | 10 | 20 | 40 | 50 | 60 | 80 | |
| 脱除率% |  | 91.6 | 97.5 | 98.9 | 99.9 | 99.1 | 97.2 |
| NO | 76.5 | 77.2 | 78.9 | 80.1 | 79.9 | 78.8 | |
 脱除原理的离子方程式
脱除原理的离子方程式
您最近半年使用:0次
7 . 工业合成NH3的反应,解决了世界约三分之一人的粮食问题。回答下列问题:
(1)氮气与氢气反应合成氨的能量变化如图所示,则热化学方程式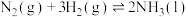

___________  。
。
(2)500℃时,向容积为2 L的密闭容器中通入1 mol N2和3 mol H2,模拟合成氨的反应 ,容器内的压强随时间的变化如下表所示:
,容器内的压强随时间的变化如下表所示:
①达到平衡时N2的转化率为___________ ,列举一条既能提高反应速率又能提高原料转化率的措施___________ 。
②该反应的平衡常数
___________ (用分压表示,分压=总压×物质的量分数)。
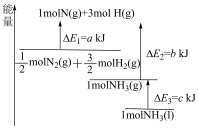
③随着反应的进行合成氨的正反应速率与NH3的体积分数的关系如图所示,若升高温度再次达到平衡时,可能的点为___________ (填字母)。
(3)常温常压下电解法合成氨的原理如图所示:
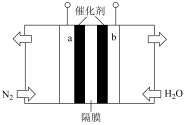
①a极连接的是电源的___________ 极,写出a电极上发生的电极反应式___________ 。
②阳极产物的化学式为___________ 。
③经检测氨的产量降低,原因是阴极表面发生了副反应,生成一种气体,写出该气体的化学式___________ 。
(1)氮气与氢气反应合成氨的能量变化如图所示,则热化学方程式
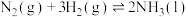

 。
。
(2)500℃时,向容积为2 L的密闭容器中通入1 mol N2和3 mol H2,模拟合成氨的反应
 ,容器内的压强随时间的变化如下表所示:
,容器内的压强随时间的变化如下表所示:| 时间/min | 0 | 10 | 20 | 30 | 40 | +∞ |
| 压强/MPa | 20 | 17 | 15 | 13.2 | 11 | 11 |
②该反应的平衡常数

③随着反应的进行合成氨的正反应速率与NH3的体积分数的关系如图所示,若升高温度再次达到平衡时,可能的点为

(3)常温常压下电解法合成氨的原理如图所示:

①a极连接的是电源的
②阳极产物的化学式为
③经检测氨的产量降低,原因是阴极表面发生了副反应,生成一种气体,写出该气体的化学式
您最近半年使用:0次
8 . 碘微溶于水,若水中含I﹣,碘溶解度增大,因为存在平衡: 。某同学设计如下实验测定该反应的平衡常数,并从某废碘液(Ⅰ2、
。某同学设计如下实验测定该反应的平衡常数,并从某废碘液(Ⅰ2、 、
、 和淀粉)回收Ⅰ2。回答下列问题:
和淀粉)回收Ⅰ2。回答下列问题:
(1)反应 平衡常数测定,步骤如下:
平衡常数测定,步骤如下:
I.将一定质量的单质Ⅰ2完全溶于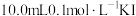 溶液中(假定溶液体积不变),加入10mLCCl4,振荡,静置后分液;
溶液中(假定溶液体积不变),加入10mLCCl4,振荡,静置后分液;
Ⅱ.实验测得上层溶液中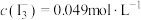 ;
;
Ⅲ.滴定下层溶液至终点时,消耗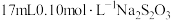 溶液
溶液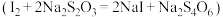 。
。
已知: 、
、 不溶于CCl4;一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即
不溶于CCl4;一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即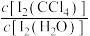 是一个常数(用KD表示,称为分配系数),且室温条件下KD=85。
是一个常数(用KD表示,称为分配系数),且室温条件下KD=85。
①分液时,使用的玻璃仪器有___________ 。
②该条件下反应 的平衡常数K=
的平衡常数K=___________ (保留三位有效数字)。
(2)某废碘液(含有Ⅰ2、 、
、 和淀粉)回收Ⅰ2的实验过程如下:
和淀粉)回收Ⅰ2的实验过程如下:
i.还原:取100mL废碘液,加入Na2S2O3将Ⅰ2、Ⅰ3还原为 ;
;
ii.浓缩:加热浓缩到原体积的50%;
iii.氧化:向浓缩液中加入稍过量的研细的FeCl3固体,充分搅拌,静置;
iv.过滤:得粗碘和碘水;
v.升华:粗碘中含有FeCl3等杂质,用升华法提纯得精碘。
①还原时判断Ⅰ2、 全部还原为
全部还原为 的实验现象是
的实验现象是___________ 。
②还原和浓缩的顺序不能交换,可能原因是___________ 。
③氧化时发生反应的离子方程式为___________ 。
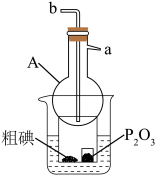
④升华法提纯粗碘的装置如图所示(加热装置已省略)。使用仪器A进行回流水冷却,仪器A的名称是___________ ,进水口为___________ (填“a”或“b”),小烧杯中放置P2O5的作用是___________ 。
⑤碘水可用乙醚一四氯化碳的混合溶剂萃取进一步回收碘,萃取剂总体积为10mL时四氯化碳与乙醚不同比例下的实验对比结果如下表:
由此得出的结论是___________ 。
 。某同学设计如下实验测定该反应的平衡常数,并从某废碘液(Ⅰ2、
。某同学设计如下实验测定该反应的平衡常数,并从某废碘液(Ⅰ2、 、
、 和淀粉)回收Ⅰ2。回答下列问题:
和淀粉)回收Ⅰ2。回答下列问题:(1)反应
 平衡常数测定,步骤如下:
平衡常数测定,步骤如下:I.将一定质量的单质Ⅰ2完全溶于
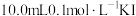 溶液中(假定溶液体积不变),加入10mLCCl4,振荡,静置后分液;
溶液中(假定溶液体积不变),加入10mLCCl4,振荡,静置后分液;Ⅱ.实验测得上层溶液中
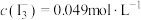 ;
;Ⅲ.滴定下层溶液至终点时,消耗
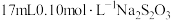 溶液
溶液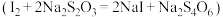 。
。已知:
 、
、 不溶于CCl4;一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即
不溶于CCl4;一定温度下碘单质在四氯化碳和水混合液体中,碘单质的浓度比值即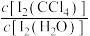 是一个常数(用KD表示,称为分配系数),且室温条件下KD=85。
是一个常数(用KD表示,称为分配系数),且室温条件下KD=85。①分液时,使用的玻璃仪器有
②该条件下反应
 的平衡常数K=
的平衡常数K=(2)某废碘液(含有Ⅰ2、
 、
、 和淀粉)回收Ⅰ2的实验过程如下:
和淀粉)回收Ⅰ2的实验过程如下:i.还原:取100mL废碘液,加入Na2S2O3将Ⅰ2、Ⅰ3还原为
 ;
;ii.浓缩:加热浓缩到原体积的50%;
iii.氧化:向浓缩液中加入稍过量的研细的FeCl3固体,充分搅拌,静置;
iv.过滤:得粗碘和碘水;
v.升华:粗碘中含有FeCl3等杂质,用升华法提纯得精碘。
①还原时判断Ⅰ2、
 全部还原为
全部还原为 的实验现象是
的实验现象是②还原和浓缩的顺序不能交换,可能原因是
③氧化时发生反应的离子方程式为
④升华法提纯粗碘的装置如图所示(加热装置已省略)。使用仪器A进行回流水冷却,仪器A的名称是

⑤碘水可用乙醚一四氯化碳的混合溶剂萃取进一步回收碘,萃取剂总体积为10mL时四氯化碳与乙醚不同比例下的实验对比结果如下表:
| 比例 | 1:0 | 1:1 | 1:2 | 1:3 | 1:4 | 1:5 |
| 萃取后碘水 | 红 | 浅黄红 | 浅黄 | 浅黄红 | 较浅黄色 | 接近无色 |
您最近半年使用:0次
解题方法
9 . 我国力争于2030年前做到碳达峰,CO2和CH4催化重整制备合成气(主要成分为CO、H2)是CO2利用的研究热点之一,其中部分反应如下:
反应Ⅰ积碳反应:CH4(g) C(s)+2H2(g) ΔH1=+74.8kJ/mol
C(s)+2H2(g) ΔH1=+74.8kJ/mol
反应Ⅱ消碳反应:C(s)+CO2(g) 2CO(g) ΔH2=+172kJ/mol
2CO(g) ΔH2=+172kJ/mol
回答下列问题:
(1)催化重整反应CO2(g)+CH4(g) 2CO(g)+2H2(g) ΔH=
2CO(g)+2H2(g) ΔH=_________ 。
(2)催化重整反应中催化剂的活性会因积碳而降低,消碳反应则使积碳量减少。
①投料比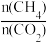
___________ (填“增大”或“减小”)有助于减少积碳。
②使用不同催化剂时,反应Ⅰ、Ⅱ活化能如下表所示:
由表中数据判断,使用催化剂___________ (填“X”或“Y”)催化重整反应速率较快。
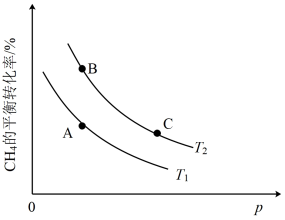
(3)一定条件下,催化重整反应CO2(g)+CH4(g) 2CO(g)+2H2(g)中CH4的平衡转化率与温度、压强的关系如图所示(不考虑副反应),则T1
2CO(g)+2H2(g)中CH4的平衡转化率与温度、压强的关系如图所示(不考虑副反应),则T1___________ T2(填“大于,小于或等于”);A、B、C三点对应的平衡常数KA、KB、KC的大小关系为___________ 。
(4)恒温下,往2L密闭容器中加入2molCH4、2molCO2进行该催化重整反应。
①2min后测得CO2的转化率为40%,则2min内平均反应速率v(CH4)=___________ mol·L-1·min-1。
②下列叙述能说明该反应达到平衡状态的是___________ (填序号)。
A.容器中混合气体的密度保持不变
B.容器中混合气体的压强保持不变
C.v正(CO2)=2v逆(CO)
D.断裂2mol C-H键的同时断裂1mol H-H键
(5)在恒温、体系总压恒定为P0kPa下,往密闭容器中加入2molCH4、2molCO2进行该催化重整反应,达到平衡状态时,CO2的转化率为50%。已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数Kp,则该温度下的平衡常数Kp=___________ (kPa)2(用含P0的代数式表示)。
反应Ⅰ积碳反应:CH4(g)
 C(s)+2H2(g) ΔH1=+74.8kJ/mol
C(s)+2H2(g) ΔH1=+74.8kJ/mol 反应Ⅱ消碳反应:C(s)+CO2(g)
 2CO(g) ΔH2=+172kJ/mol
2CO(g) ΔH2=+172kJ/mol回答下列问题:
(1)催化重整反应CO2(g)+CH4(g)
 2CO(g)+2H2(g) ΔH=
2CO(g)+2H2(g) ΔH=(2)催化重整反应中催化剂的活性会因积碳而降低,消碳反应则使积碳量减少。
①投料比
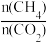
②使用不同催化剂时,反应Ⅰ、Ⅱ活化能如下表所示:
反应 | Ⅰ | Ⅱ |
催化剂X 活化能/kJ/mol | 33 | 91 |
催化剂Y活化能/kJ/mol | 43 | 72 |
(3)一定条件下,催化重整反应CO2(g)+CH4(g)
 2CO(g)+2H2(g)中CH4的平衡转化率与温度、压强的关系如图所示(不考虑副反应),则T1
2CO(g)+2H2(g)中CH4的平衡转化率与温度、压强的关系如图所示(不考虑副反应),则T1
(4)恒温下,往2L密闭容器中加入2molCH4、2molCO2进行该催化重整反应。
①2min后测得CO2的转化率为40%,则2min内平均反应速率v(CH4)=
②下列叙述能说明该反应达到平衡状态的是
A.容器中混合气体的密度保持不变
B.容器中混合气体的压强保持不变
C.v正(CO2)=2v逆(CO)
D.断裂2mol C-H键的同时断裂1mol H-H键
(5)在恒温、体系总压恒定为P0kPa下,往密闭容器中加入2molCH4、2molCO2进行该催化重整反应,达到平衡状态时,CO2的转化率为50%。已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数Kp,则该温度下的平衡常数Kp=
您最近半年使用:0次
10 . 甲醇直接脱氢制无水甲醛是具有工业化前景的新工艺。回答下列问题:
(1)在标准压强(100kPa)、298K下,一些物质的热力学数据如下表,标准摩尔生成焓是指由稳定的单质合成1mol该物质的反应焓变;
甲醇脱氢制甲醛的反应方程式为:

___________ ,该反应高温能自发进行的原因是___________ 。
(2)已知Arrhenius经验公式为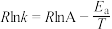 (
( 为活化能,k为速率常数,R、A为常数)。一定条件下,催化剂1作用下甲醇脱氢制甲醛反应的Arrhenius经验公式的实验数据如图中曲线a所示。
为活化能,k为速率常数,R、A为常数)。一定条件下,催化剂1作用下甲醇脱氢制甲醛反应的Arrhenius经验公式的实验数据如图中曲线a所示。
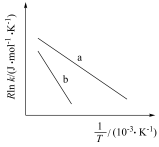
①升高温度,速率常数k___________ (填“增大”“减小”或“不变”);
②催化剂Ⅱ作用下,实验数据如图中b线所示,则催化效果:催化剂Ⅰ___________ 催化剂Ⅱ(填“>”成“<”)。
(3)催化剂1作用下,恒容密闭容器中充入一定量的 发生反应
发生反应 ,达到平衡时,容器总压、
,达到平衡时,容器总压、 的体积分数随温度的变化曲线如图所示。
的体积分数随温度的变化曲线如图所示。
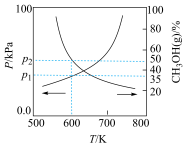
①随着温度的升高,压强不断增大的原因是___________ 。
②600K达到平衡时,
___________ kPa(用含“p”的式子表示,下同), 的转化率为
的转化率为___________ ,
___________ 。
(1)在标准压强(100kPa)、298K下,一些物质的热力学数据如下表,标准摩尔生成焓是指由稳定的单质合成1mol该物质的反应焓变;
| 物质 |  | HCHO |  |
标准摩尔生成焓(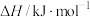 ) ) | 0 | -115.8 | -201 |
熵(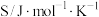 ) ) | 130.7 | 218.7 | 239.9 |


(2)已知Arrhenius经验公式为
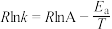 (
( 为活化能,k为速率常数,R、A为常数)。一定条件下,催化剂1作用下甲醇脱氢制甲醛反应的Arrhenius经验公式的实验数据如图中曲线a所示。
为活化能,k为速率常数,R、A为常数)。一定条件下,催化剂1作用下甲醇脱氢制甲醛反应的Arrhenius经验公式的实验数据如图中曲线a所示。
①升高温度,速率常数k
②催化剂Ⅱ作用下,实验数据如图中b线所示,则催化效果:催化剂Ⅰ
(3)催化剂1作用下,恒容密闭容器中充入一定量的
 发生反应
发生反应 ,达到平衡时,容器总压、
,达到平衡时,容器总压、 的体积分数随温度的变化曲线如图所示。
的体积分数随温度的变化曲线如图所示。
①随着温度的升高,压强不断增大的原因是
②600K达到平衡时,

 的转化率为
的转化率为
您最近半年使用:0次




