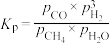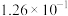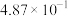(1)某科研团队利用Ni-CaO-Fe3O4三元催化剂在850℃下“超干重整”CH4和CO2。
已知:反应I:CH4(g)+CO2(g)
 2CO(g)+2H2(g)ΔH=+247kJ/mol
2CO(g)+2H2(g)ΔH=+247kJ/mol反应Ⅱ:CO(g)+H2O(g)
 CO2(g)+H2(g)ΔH=-41kJ/mol
CO2(g)+H2(g)ΔH=-41kJ/mol则反应Ⅲ:CH4(g)+3CO2(g)
 4CO(g)+2H2O(g)ΔH=
4CO(g)+2H2O(g)ΔH=(2)在容积为1L的刚性容器中进行“合成气催化重整”,反应的化学方程式为:CH4(g)+CO2(g)
 2CO(g)+2H2(g),当投料n(CH4):n(CO2)=1.0时,CO2的平衡转化率(ɑ)与温度(T),初始压强(p)的关系如图所示,压强p1
2CO(g)+2H2(g),当投料n(CH4):n(CO2)=1.0时,CO2的平衡转化率(ɑ)与温度(T),初始压强(p)的关系如图所示,压强p1
 制取甲醇可实现资源的循环利用。
制取甲醇可实现资源的循环利用。Ⅰ.二氧化碳催化加氢制甲醇
(1)①已知:

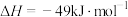 ,该反应在
,该反应在②在恒温恒容条件下发生反应:
 ,下列说法能证明此反应达到平衡状态的是
,下列说法能证明此反应达到平衡状态的是A.
 B.气体的平均摩尔质量不再改变
B.气体的平均摩尔质量不再改变C.单位时间内断裂2mol C=O键同时断裂3mol H−H键 D.

(2)合成
 过程起始物
过程起始物 时,在不同条件下达到平衡,设体系中
时,在不同条件下达到平衡,设体系中 的转化率为
的转化率为 ,在
,在 ℃下的
℃下的 、在
、在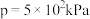 下的
下的 如图所示。已知在
如图所示。已知在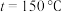 ,
,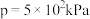 反应条件下,反应经过10s达到平衡,
反应条件下,反应经过10s达到平衡, :
:
①图中对应的等温曲线是a,理由是
②
 的分压平均变化率为
的分压平均变化率为 ,该温度下
,该温度下
 。(保留两位有效数字)(已知:对于气相反应,可以用分压表示,分压=总压×物质的量分数)。
。(保留两位有效数字)(已知:对于气相反应,可以用分压表示,分压=总压×物质的量分数)。(3)二氧化碳催化加氢制甲醇反应往往伴随着副反应的发生:
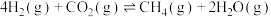 ,在一定温度和压强下,为了提高反应速率和甲醇的选择性,应当
,在一定温度和压强下,为了提高反应速率和甲醇的选择性,应当Ⅱ.电解催化
 制甲醇
制甲醇(4)电解催化
 制甲醇装置如图所示:
制甲醇装置如图所示: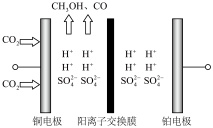
①装置中的
 移动方向为
移动方向为②电解催化
 制甲醇的电极反应方程式为
制甲醇的电极反应方程式为 xC(g)+2D(g),经5s反应达平衡,在此5s内C的平均反应速率为0.2 mol/(L·s),同时生成1 mol D,下列叙述错误的是
xC(g)+2D(g),经5s反应达平衡,在此5s内C的平均反应速率为0.2 mol/(L·s),同时生成1 mol D,下列叙述错误的是| A.x=4 |
| B.达到平衡时容器内气体的压强与起始时的压强比为6:5 |
| C.达到平衡时B的体积分数约为33% |
| D.该反应的平衡常数Kc=8 |
(1)1670年,德国人斯瓦恩哈德无意中将萤石(
 )与浓硫酸1∶1混合在一起,产生了一种刺激性气体,这种气体能腐蚀玻璃。该气体腐蚀玻璃的化学反应方程式为
)与浓硫酸1∶1混合在一起,产生了一种刺激性气体,这种气体能腐蚀玻璃。该气体腐蚀玻璃的化学反应方程式为(2)单质氟的制备是化学史上一段悲壮的历史,直到1886年法国化学家莫瓦桑电解熔融的氟化氢钾(
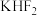 )才制得单质氟。电解过程中,两极均有气体产生,阴极的电极反应式为
)才制得单质氟。电解过程中,两极均有气体产生,阴极的电极反应式为(3)氟单质的反应性非常强,可与稀有气体氙发生反应。已知:
| 反应方程式 | 标准平衡常数 | |
| 523K | 673K | |
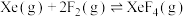 |  | 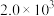 |
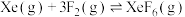 |  | 36.0 |

 ,其中
,其中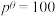 kPa,
kPa,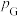 、
、 、
、 、
、 为各组分的平衡分压)。
为各组分的平衡分压)。下图是以0.125 mol/L Xe和1.225 mol/L
 为起始量,得到的生成物在平衡体系中的分压与反应温度的关系。
为起始量,得到的生成物在平衡体系中的分压与反应温度的关系。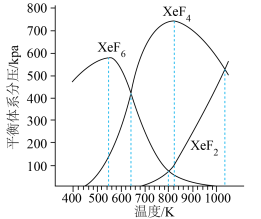
①制备
 的适宜温度约为
的适宜温度约为②523K时,以Xe和
 制取
制取 。反应达到平衡时,欲使产物中
。反应达到平衡时,欲使产物中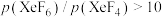 ,
,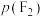 至少应保持在
至少应保持在③反应
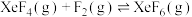 的
的
(4)法国科学家盖•吕萨克也曾试图制备氢氟酸。1809年,他把氟化钙与硼酸混和加热,却意外地制成了一种所谓的“氟酸气”(
 )。已知:
)。已知: ,其中
,其中 为含多个卤素原子的阳离子,
为含多个卤素原子的阳离子, 为一个正四面体结构的阴离子,则
为一个正四面体结构的阴离子,则 的VSEPR模型名称为
的VSEPR模型名称为(5)已知:
 ,若向1 L 0.1 mol/L的
,若向1 L 0.1 mol/L的 溶液中加入NaF固体,充分反应后,测得溶液中
溶液中加入NaF固体,充分反应后,测得溶液中 浓度为
浓度为 mol/L,则加入的NaF固体的质量为
mol/L,则加入的NaF固体的质量为5 . 哈伯法合成氨需要高温高压,为降低能耗,过渡金属催化合成氨被认为是前景巨大的替代方法。催化过程一般有吸附、解离、反应、脱附等过程,以下图示为 和
和 在过渡金属催化剂表面合成氨反应历程的势能图(部分数据略),其中“*”表示被催化剂吸附。
在过渡金属催化剂表面合成氨反应历程的势能图(部分数据略),其中“*”表示被催化剂吸附。
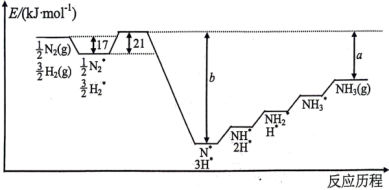
(1)
 mol
mol  (g)、
(g)、 mol
mol (g)变成活化分子需要吸收
(g)变成活化分子需要吸收(2)合成氨的捷姆金和佩热夫速率方程式为:
 (w为反应的瞬时总速率,为正反应和逆反应速率之差,
(w为反应的瞬时总速率,为正反应和逆反应速率之差, 、
、 是正、逆反应速率常数)。合成氨反应
是正、逆反应速率常数)。合成氨反应 的平衡常数
的平衡常数
 、
、 表示)
表示)(3)若将2.0mol
 和6.0mol
和6.0mol  通入体积为2L的密闭容器中,分别在
通入体积为2L的密闭容器中,分别在 和
和 温度下进行反应,下图曲线分别只表示X的浓度(或Y的物质的量)随时间的变化(X、Y分别代表某一种反应物或生成物)。
温度下进行反应,下图曲线分别只表示X的浓度(或Y的物质的量)随时间的变化(X、Y分别代表某一种反应物或生成物)。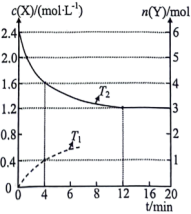
①X表示的物质是 温度下恰好平衡时,曲线上的点为A,其坐标为
温度下恰好平衡时,曲线上的点为A,其坐标为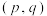 ,则p
,则p
② 温度下,合成氨反应
温度下,合成氨反应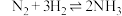 的平衡常数的数值是
的平衡常数的数值是
6 . 合成气(CO、 )可用于合成低碳烯烃和甲醇等化工产品。回答下列问题:
)可用于合成低碳烯烃和甲醇等化工产品。回答下列问题:
(1)用天然气制备合成气的原理如下:

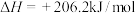
该反应的压强平衡常数(Kp)随温度的变化如下表:
温度/℃ | 700 | 750 | 800 | 850 | 900 |
|
|
| 1.00 | 5.23 |
|
根据热力学状态函数自由能(∆G)的数学表达式: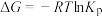 (R为大于0的常数,T为热力学温度),可以推知当温度超过
(R为大于0的常数,T为热力学温度),可以推知当温度超过
(2)用转炉熔渣(未冷却)制备合成气时,涉及反应如下:
Ⅰ.

Ⅱ.

Ⅲ.

反应温度与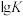 的关系如图所示。
的关系如图所示。
①
②反应: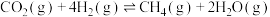 的
的
 、
、 表示)。
表示)。
③用转炉熔渣制取合成气的优点是
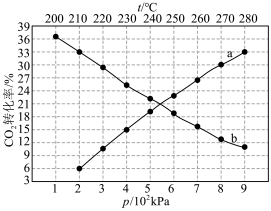
(3)在三个密闭容器中,按起始物质的量之比
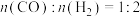 ,将CO和
,将CO和 充入容器中,在不同的温度和压强下,发生反应:
充入容器中,在不同的温度和压强下,发生反应: 。CO的转化率
。CO的转化率 与温度的关系如图所示:
与温度的关系如图所示: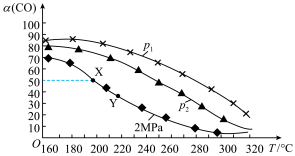
①
 (填“>”“<”或“=”);反应速率
(填“>”“<”或“=”);反应速率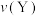
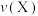 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②X点处,该反应的平衡常数为 (用平衡分压表示,分压等于总压乘以物质的量分数)。
(用平衡分压表示,分压等于总压乘以物质的量分数)。
③提高CO的转化率除改变温度和压强外还可采取的措施是
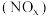 是严重的大气污染物,其主要来源有汽车尾气和硝酸工厂等。氮氧化物
是严重的大气污染物,其主要来源有汽车尾气和硝酸工厂等。氮氧化物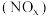 能引起雾霾、光化学烟雾、酸雨等环境问题。某科研机构设计了如下转化氮氧化物的几种方案。请回答下列问题:
能引起雾霾、光化学烟雾、酸雨等环境问题。某科研机构设计了如下转化氮氧化物的几种方案。请回答下列问题:方案Ⅰ:利用甲烷在催化剂条件下还原
 ,相关反应如下:
,相关反应如下:①

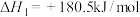
②
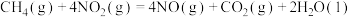
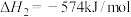
③

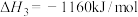
(1)表示甲烷燃烧热的热化学方程式为
(2)反应③自发进行的条件是
 (逆)
(逆) (正)。
(正)。方案Ⅱ:利用CO在催化剂条件下还原
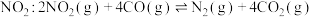 。向容积均为2L的甲(温度为)、乙(温度为
。向容积均为2L的甲(温度为)、乙(温度为 )两个恒容密闭容器中分别充入2mol
)两个恒容密闭容器中分别充入2mol 和3mol
和3mol 。反应过程中两容器内
。反应过程中两容器内 的物质的量浓度随时间的变化关系如图所示:
的物质的量浓度随时间的变化关系如图所示:
(3)由图像可得:甲容器中,
 的平衡转化率为
的平衡转化率为
 (填“>”或“<”);
(填“>”或“<”);
(4)
 温度时,该反应的平衡常数
温度时,该反应的平衡常数
[对于反应
 ,
,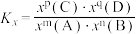 ,
, 为物质的量分数]
为物质的量分数] 方案Ⅲ:可以利用原电池原理处理氮氧化物,如下图所示:
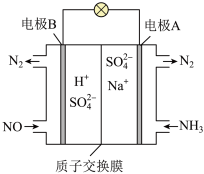
(5)该原电池的正极反应式为
8 . 甲烷的直接转化具有较高的经济价值,备受科学家的关注,其一种反应原理如下: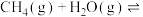
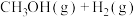
 。
。
(1)依据表中数据计算,x=
化学键 | C—H | O—H | C—O | H—H |
键能/( | 414 | x | 326 | 436 |
(2)在体积为1L的恒容密闭容器中充入1mol
 (g)和2mol
(g)和2mol  (g),只发生上述反应,实验测得温度分别为
(g),只发生上述反应,实验测得温度分别为 、
、 时,其平衡常数分别为
时,其平衡常数分别为 、1,则
、1,则
 。当温度为
。当温度为 时,下列所述状态中,能说明反应已达到平衡状态的是
时,下列所述状态中,能说明反应已达到平衡状态的是A.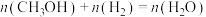 B.混合气体的密度不再变化
B.混合气体的密度不再变化
C.混合气体的平均摩尔质量不再变化 D.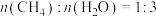
(3)某温度下,在一恒容密闭容器中充入
 (g)和
(g)和 (g),
(g), ,加入催化剂使其发生上述反应(忽略其他副反应),测得该反应中初始压强为
,加入催化剂使其发生上述反应(忽略其他副反应),测得该反应中初始压强为 kPa,分压如图甲所示(2min前,
kPa,分压如图甲所示(2min前, 的分压未给出),则A点坐标为
的分压未给出),则A点坐标为
 (g)和
(g)和 (g),再经过1min反应再次达到平衡,此时表示
(g),再经过1min反应再次达到平衡,此时表示 (g)分压的点的坐标为
(g)分压的点的坐标为
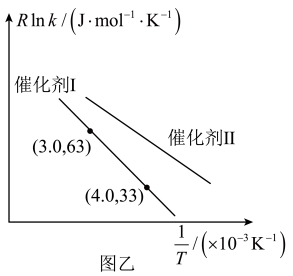
(4)反应
 的Arrhenius经验公式的实验数据如图乙所示,已知经验公式为
的Arrhenius经验公式的实验数据如图乙所示,已知经验公式为 (其中
(其中 为活化能,k为速率常数,R和C为常数)。催化剂Ⅰ与催化剂Ⅱ相比,催化效果更好的是
为活化能,k为速率常数,R和C为常数)。催化剂Ⅰ与催化剂Ⅱ相比,催化效果更好的是
 。
。
9 . 利用水煤气合成甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g) ΔH1=−90.8kJ·mol−1
CH3OH(g) ΔH1=−90.8kJ·mol−1
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2=−23.5kJ·mol−1
CH3OCH3(g)+H2O(g) ΔH2=−23.5kJ·mol−1
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH3=−41.2kJ·mol−1
CO2(g)+H2(g) ΔH3=−41.2kJ·mol−1
(1)总反应:3H2(g)+3CO(g)
 CH3OCH3(g)+CO2(g) ΔH=
CH3OCH3(g)+CO2(g) ΔH=(2)一定条件下,起始浓度分别为c(CO)=0.6mol·L−1、c(H2)=1.4mol·L−1,8min后反应①达到化学平衡,CO的平衡转化率为50%,则8min内H2的平均反应速率为
(3)一定温度下,在恒容密闭容器中发生反应②,当容器内气体的总压强不再变化时。下列说法正确的是_____。
| A.该反应可能处于化学平衡状态 |
| B.正、逆反应速率一定相等 |
| C.CH3OH全部转化为CH3OCH3和H2O |
| D.CH3OH、CH3OCH3、H2O的浓度一定相等 |
物质 | CH3OH | CH3OCH3 |
c/mol·L−1 | 0.44 | 0.60 |
比较此时正、逆反应速率的大小
A。υ(正)>υ(逆) B.υ(正)<υ(逆) C.υ(正)=υ(逆) D.无法判断
判断依据为
 、
、 在一定条件下与
在一定条件下与 催化合成
催化合成 等有机化工产品,对落实“双碳目标”具有重要的意义。在一定条件下
等有机化工产品,对落实“双碳目标”具有重要的意义。在一定条件下 、
、 与
与 可发生如下反应:
可发生如下反应:反应I:
反应II:
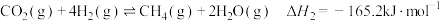
反应III:
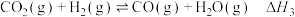
回答下列问题:
(1)反应II自发的条件是
 、
、 ,则
,则
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(2)某温度下,向一刚性容器中加入等物质的量
 和
和 ,发生反应III,测得
,发生反应III,测得 和
和 物质的量浓度随时间的变化如图所示。
物质的量浓度随时间的变化如图所示。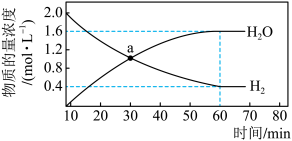
①下列说法正确的是
a.a点时

b.60min内
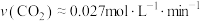
c.相同条件下,减小CO浓度,
 增大
增大d.平衡后,向容器中继续加入
 和
和 ,重新达到平衡,
,重新达到平衡, 转化率不变
转化率不变②已知
 ,其中
,其中 、
、 分别为正、逆反应速率常数。a点时,
分别为正、逆反应速率常数。a点时,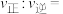
③70min时,升高温度,
 转化率
转化率(3)在密闭反应器中通入
 和
和 ,分别在1MPa和5MPa下进行反应II和反应III。其
,分别在1MPa和5MPa下进行反应II和反应III。其 和
和 在含碳物质中的平衡组成(如
在含碳物质中的平衡组成(如 的平衡组成为
的平衡组成为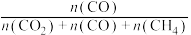 )受温度的影响如图所示:
)受温度的影响如图所示: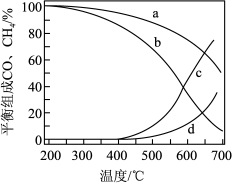
①5MPa时,表示
 和
和 平衡组成的曲线分别是
平衡组成的曲线分别是②当
 和
和 平衡组成均为30%时,
平衡组成均为30%时, 的平衡转化率为
的平衡转化率为 为
为