解题方法
1 . 苯乙烯是合成树脂、离子交换树脂及合成橡胶等的重要单体,常用如下反应来制备: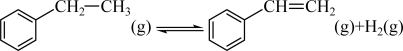 。在T1℃、10MPa反应条件下,向甲、乙、丙三个容器中分别通入n(乙苯):n(N2)为1∶1、1∶4、1∶9的混合气体,发生上述反应,测得乙苯转化率随时间变化如表所示。
。在T1℃、10MPa反应条件下,向甲、乙、丙三个容器中分别通入n(乙苯):n(N2)为1∶1、1∶4、1∶9的混合气体,发生上述反应,测得乙苯转化率随时间变化如表所示。
下列说法正确的是
 。在T1℃、10MPa反应条件下,向甲、乙、丙三个容器中分别通入n(乙苯):n(N2)为1∶1、1∶4、1∶9的混合气体,发生上述反应,测得乙苯转化率随时间变化如表所示。
。在T1℃、10MPa反应条件下,向甲、乙、丙三个容器中分别通入n(乙苯):n(N2)为1∶1、1∶4、1∶9的混合气体,发生上述反应,测得乙苯转化率随时间变化如表所示。| 10min | 20min | 30min | 40min | 50min | |
| 甲 | 20.5% | 39.0% | 54.5% | 60.0% | 60.0% |
| 乙 | 23.5% | 44.5% | 61.0% | 66.8% | x |
| 丙 | 25.0% | 45.5% | 63.8% | 74.0% | 80.0% |
A.20min内,乙苯的平均反应速率 从大到小的顺序是丙>乙>甲 从大到小的顺序是丙>乙>甲 |
| B.若其他条件不变,把容器甲改为恒容容器,则平衡转化率变小 |
C.T1℃时,该反应的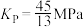 |
| D.50min时,容器丙中的反应已达到平衡状态 |
您最近半年使用:0次
名校
解题方法
2 . CO2–CH4干气重整反应制合成气(H2、CO)是CO2资源化利用的重要研究方向。其反应主要包括:
反应I CH4(g)+CO2(g) 2H2(g)+2CO(g) ΔH1=+247.34 kJ·mol-1
2H2(g)+2CO(g) ΔH1=+247.34 kJ·mol-1
反应II H2(g)+CO2(g) H2O(g)+CO(g) ΔH2
H2O(g)+CO(g) ΔH2
回答下列问题:
(1)已知 H2(g)、CO(g) 的燃烧热分别为 285.8 kJ·mol-1 和 283 kJ·mol-1 ,水的汽化热为44 kJ·mol-1,则ΔH2=___________ kJ·mol-1;能同时提高CH4(g)的平衡转化率和反应速率的措施为___________ (写一条即可)。
(2)向T℃、2.8 MPa的恒压密闭容器中,充入1 mol CH4(g)和1 mol CO2(g)发生反应I和II。达到平衡时,CO2的转化率为80%,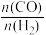 =3 ,则平衡时气体的总物质的量n总=
=3 ,则平衡时气体的总物质的量n总=___________ mol;反应I的压强平衡常数Kp=___________ (MPa)2;若反应在刚性容器中达到平衡,则CO2(g)的转化率___________ (填“>”、“=”或“<”)80%。
(3)实验研究发现,在(2)条件下,催化剂表面产生积碳与下列2个反应有关:
反应III CH4(g) C(s)+2H2(g) ΔH3=+74.87 kJ·mol-1
C(s)+2H2(g) ΔH3=+74.87 kJ·mol-1
反应IV 2CO(g) CO2(g)+C(s) ΔH4=–172.47 kJ·mol-1
CO2(g)+C(s) ΔH4=–172.47 kJ·mol-1
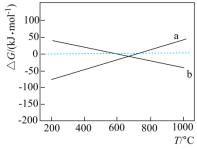
已知ΔG=ΔH–TΔS,ΔG的值只取决于反应体系的始态和终态,忽略ΔH、ΔS随温度的变化,反应Ⅲ和反应Ⅳ的ΔG与T的关系如图所示,其中表示反应III的曲线为___________ (填“a”或“b”);催化剂表面始终存在积碳的原因为___________ 。
反应I CH4(g)+CO2(g)
 2H2(g)+2CO(g) ΔH1=+247.34 kJ·mol-1
2H2(g)+2CO(g) ΔH1=+247.34 kJ·mol-1反应II H2(g)+CO2(g)
 H2O(g)+CO(g) ΔH2
H2O(g)+CO(g) ΔH2回答下列问题:
(1)已知 H2(g)、CO(g) 的燃烧热分别为 285.8 kJ·mol-1 和 283 kJ·mol-1 ,水的汽化热为44 kJ·mol-1,则ΔH2=
(2)向T℃、2.8 MPa的恒压密闭容器中,充入1 mol CH4(g)和1 mol CO2(g)发生反应I和II。达到平衡时,CO2的转化率为80%,
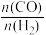 =3 ,则平衡时气体的总物质的量n总=
=3 ,则平衡时气体的总物质的量n总=(3)实验研究发现,在(2)条件下,催化剂表面产生积碳与下列2个反应有关:
反应III CH4(g)
 C(s)+2H2(g) ΔH3=+74.87 kJ·mol-1
C(s)+2H2(g) ΔH3=+74.87 kJ·mol-1反应IV 2CO(g)
 CO2(g)+C(s) ΔH4=–172.47 kJ·mol-1
CO2(g)+C(s) ΔH4=–172.47 kJ·mol-1已知ΔG=ΔH–TΔS,ΔG的值只取决于反应体系的始态和终态,忽略ΔH、ΔS随温度的变化,反应Ⅲ和反应Ⅳ的ΔG与T的关系如图所示,其中表示反应III的曲线为

您最近半年使用:0次
解题方法
3 . 氮气来源广泛且转化生成的工业产品(如氨、肼类等)具有重要的社会效益和经济价值。我国科学家成功制备了一类以金属锌为中心离子、具有双氮负离子配位和稳定D-A-D夹心结构的多孔金属配位聚合物材料NJUZ-1.NJUZ-1双氮配位聚合物具有优异的固氮性能。能够将空气中的氮气经光催化还原为氮。
(1)氨分子的空间构型为___________ 。
(2)光催化固氮在NJUZ-1催化剂作用下的反应机理如下(*表示吸附态)
①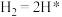
②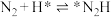 ;
;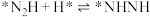 ;
;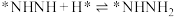 ;
;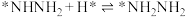 ;
;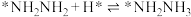 ;
;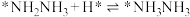
③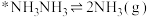
已知断裂1mol相应化学键需要的能量如下
写出光催化固氮在NJUZ-1催化剂作用下总反应的热化学方程式___________ 。
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应: ΔH<0
ΔH<0
请完成下列问题:
①试比较化学平衡常数K1、K2的大小,K1___________ K2(填“>”、“<”或“=”)
②400℃时,反应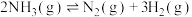 的化学平衡常数为
的化学平衡常数为___________ 。当NH3、N2和H2的物质的量分别为2mol、amol和1mol时,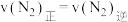 。a=
。a=___________ 。
③采用NJUZ-1将空气中的氮气经光催化还原为氨时需要将N2纯化,目的是___________ 。
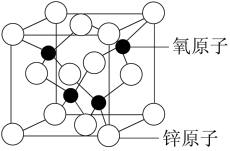
(4)氧化锌是制备NJUZ-1的重要原料之一,其结构有很多种,其中一种立方晶胞结构如图所示,Zn2+的配位数为___________ ;Zn2+周围等距且最近的Zn2+数为___________ 。
(1)氨分子的空间构型为
(2)光催化固氮在NJUZ-1催化剂作用下的反应机理如下(*表示吸附态)
①
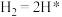
②
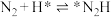 ;
;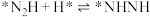 ;
;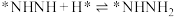 ;
;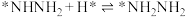 ;
;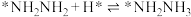 ;
;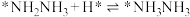
③
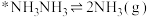
已知断裂1mol相应化学键需要的能量如下
| 化学键 |  |  |  |
| 能量 | 436kJ | 391kJ | 946kJ |
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:
 ΔH<0
ΔH<0请完成下列问题:
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
②400℃时,反应
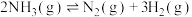 的化学平衡常数为
的化学平衡常数为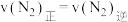 。a=
。a=③采用NJUZ-1将空气中的氮气经光催化还原为氨时需要将N2纯化,目的是
(4)氧化锌是制备NJUZ-1的重要原料之一,其结构有很多种,其中一种立方晶胞结构如图所示,Zn2+的配位数为

您最近半年使用:0次
解题方法
4 . 含铁物质在工业生产中具有重要的应用。以 作为载氧体实现甲烷部分氧化,发生的主要反应有:
作为载氧体实现甲烷部分氧化,发生的主要反应有:
i.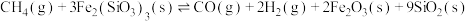
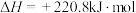
ii.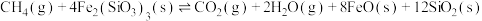
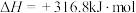
iii.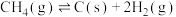
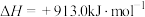
回答下列问题:
(1)反应i可在___________ (“高温”或“低温”)条件下自发进行,反应ii的正反应活化能___________ (“>”或“<”)逆反应活化能。
(2)在刚性容器、绝热体系下,仅发生反应i,则下列说法能够表明该反应已经达到化学平衡的是___________。
(3)载氧体 为CH₄转化为氧化物提供氧原子,
为CH₄转化为氧化物提供氧原子, 与
与 物质的量之比
物质的量之比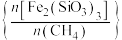 是影响
是影响 转化为合成气(
转化为合成气( 、
、 )的重要因素。在900℃、0.1MPa下,向密闭容器投入1mol
)的重要因素。在900℃、0.1MPa下,向密闭容器投入1mol 发生上述反应,不同
发生上述反应,不同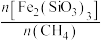 ,对部分物种的平衡量的影响如图所示,
,对部分物种的平衡量的影响如图所示, 、
、 的选择性(
的选择性( )公式如下:
)公式如下:
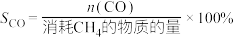
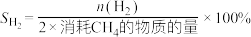
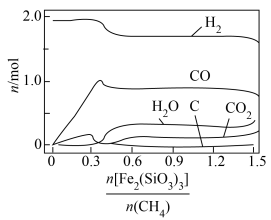
①若要生成更多的合成气,最适宜的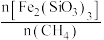 值为
值为___________ (填标号)。
A.0.3 B.0.34 C.0.45 D.1.5
②随着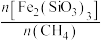 越来越大,试分析
越来越大,试分析 物质的量下降的原因
物质的量下降的原因___________ 。
③当 平衡转化率为98%时,测得体系中
平衡转化率为98%时,测得体系中 ,则
,则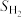 =
=___________ (保留三位有效数字),反应iii的压强平衡常数
___________ (填“大于”、“小于”或“等于”)19MPa。
 作为载氧体实现甲烷部分氧化,发生的主要反应有:
作为载氧体实现甲烷部分氧化,发生的主要反应有:i.
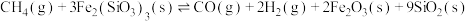
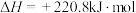
ii.
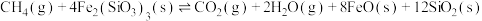
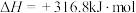
iii.
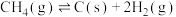
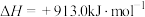
回答下列问题:
(1)反应i可在
(2)在刚性容器、绝热体系下,仅发生反应i,则下列说法能够表明该反应已经达到化学平衡的是___________。
A.相同时间内,气态反应物8mol 键断裂的同时气态产物有3mol 键断裂的同时气态产物有3mol 键断裂 键断裂 |
| B.容器中气体的密度不再变化 |
| C.固体中所含氧元素的质量分数不再变化 |
| D.平衡常数不再变化 |
(3)载氧体
 为CH₄转化为氧化物提供氧原子,
为CH₄转化为氧化物提供氧原子, 与
与 物质的量之比
物质的量之比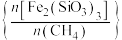 是影响
是影响 转化为合成气(
转化为合成气( 、
、 )的重要因素。在900℃、0.1MPa下,向密闭容器投入1mol
)的重要因素。在900℃、0.1MPa下,向密闭容器投入1mol 发生上述反应,不同
发生上述反应,不同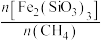 ,对部分物种的平衡量的影响如图所示,
,对部分物种的平衡量的影响如图所示, 、
、 的选择性(
的选择性( )公式如下:
)公式如下: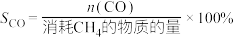
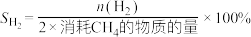

①若要生成更多的合成气,最适宜的
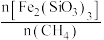 值为
值为A.0.3 B.0.34 C.0.45 D.1.5
②随着
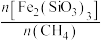 越来越大,试分析
越来越大,试分析 物质的量下降的原因
物质的量下降的原因③当
 平衡转化率为98%时,测得体系中
平衡转化率为98%时,测得体系中 ,则
,则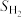 =
=
您最近半年使用:0次
5 . 含氮化合物广泛存在于自然界,是一类常见的化合物。
(1)汽车尾气是城市空气的主要污染物之一,汽车内燃机工作时发生反应:N2(g)+O2(g)=2NO(g),H2可以催化还原NO以达到消除污染的目的。
已知反应Ⅰ、N2(g)+O2(g)=2NO(g)ΔH=+180.5kJ·mol-1;
Ⅱ、2H2(g)+O2(g)=2H2O(1)ΔH=-571.6kJ·mol-1。
写出H2(g)与NO(g)反应生成N2(g)和H2O(1)的热化学方程式:___________ ,该反应自发进行的条件为___________ (填“高温”或“低温”)。
(2)已知当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。如图所示为其他条件不变时,反应2NO(g)+2CO(g) 2CO2(g)+N2(g)中c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线:
2CO2(g)+N2(g)中c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线:
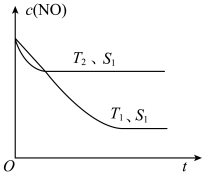
①该反应的ΔH___________ (填“>”或“<”)0。
②若催化剂的表面积S1>S2,在该图中画出该反应在T1、S2条件下达到平衡过程中c(NO)的变化曲线___________ 。
(3)尿素是一种重要的化工原料,工业上可用氨和二氧化碳合成尿素:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g),ΔH<0,一定条件下,向10L恒容密闭容器中充入2molNH3和1molCO2。
CO(NH2)2(s)+H2O(g),ΔH<0,一定条件下,向10L恒容密闭容器中充入2molNH3和1molCO2。
①该反应10min后达到平衡,测得容器中气体密度为4.8g·L-1,则平衡常数K=___________ 。
②达到平衡后,再向容器中加入2molNH3(g)和1molCO2(g),则再次达到平衡时反应物NH3的转化率___________ (填“增大”“减小”或“不变”)。
③下列说法中,可以说明该反应已经达到平衡状态的有___________ (填序号)。
A.NH3和CO2的浓度之比为2∶1 B.2v正(NH3)=v逆(H2O)
C.气体的密度不变 D.容器内总压强不变
(4)N2O5是一种新型绿色硝化剂,其制备可以采用电解法。图甲是NaBH4燃料电池,图乙是电解制备N2O5装置,已知电解时电极a与电极d相连,电极c的反应式为___________ ,若制得10.8g N2O5,则消耗NaBH4的质量为___________ g。

(1)汽车尾气是城市空气的主要污染物之一,汽车内燃机工作时发生反应:N2(g)+O2(g)=2NO(g),H2可以催化还原NO以达到消除污染的目的。
已知反应Ⅰ、N2(g)+O2(g)=2NO(g)ΔH=+180.5kJ·mol-1;
Ⅱ、2H2(g)+O2(g)=2H2O(1)ΔH=-571.6kJ·mol-1。
写出H2(g)与NO(g)反应生成N2(g)和H2O(1)的热化学方程式:
(2)已知当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。如图所示为其他条件不变时,反应2NO(g)+2CO(g)
 2CO2(g)+N2(g)中c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线:
2CO2(g)+N2(g)中c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线:
①该反应的ΔH
②若催化剂的表面积S1>S2,在该图中画出该反应在T1、S2条件下达到平衡过程中c(NO)的变化曲线
(3)尿素是一种重要的化工原料,工业上可用氨和二氧化碳合成尿素:2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g),ΔH<0,一定条件下,向10L恒容密闭容器中充入2molNH3和1molCO2。
CO(NH2)2(s)+H2O(g),ΔH<0,一定条件下,向10L恒容密闭容器中充入2molNH3和1molCO2。①该反应10min后达到平衡,测得容器中气体密度为4.8g·L-1,则平衡常数K=
②达到平衡后,再向容器中加入2molNH3(g)和1molCO2(g),则再次达到平衡时反应物NH3的转化率
③下列说法中,可以说明该反应已经达到平衡状态的有
A.NH3和CO2的浓度之比为2∶1 B.2v正(NH3)=v逆(H2O)
C.气体的密度不变 D.容器内总压强不变
(4)N2O5是一种新型绿色硝化剂,其制备可以采用电解法。图甲是NaBH4燃料电池,图乙是电解制备N2O5装置,已知电解时电极a与电极d相连,电极c的反应式为

您最近半年使用:0次
6 . 丙烯腈(C3H3N)是一种重要的化工原料,以丙烯(C3H6)、NH3、O2为原料,选择合适的催化剂生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:
①主反应;C3H6(g)+NH3(g)+ O2(g)
O2(g) C3H3N(g)+3H2O(g) ΔH1
C3H3N(g)+3H2O(g) ΔH1
②副反应:C3H6(g)+O2(g) C3H4O(g)+H2O(g) ΔH2=-353kJ·mol-1
C3H4O(g)+H2O(g) ΔH2=-353kJ·mol-1
(1)T1时。若只发生反应①,向恒压容器中充入0.2molC3H6、0.2molNH3和0.3molO2达到平衡时,放出51.5kJ能量;若向相同容器中充入lmolC3H3N(g)和3molH2O(g),达平衡时吸收257.5kJ能量,则该反应ΔH1为___________ 。
(2)T1时,向恒压容器中投入2molC3H3N(g)、6molH2O(g)和不同物质的量的He(g),同时发生反应①和反应②,一段时间建立平衡,随着n(He)的值增大,C3H3N的物质的量___________ (填“增大”“减小”或“不变”),原因是___________ 。
(3)将一定量的丙烯(C3H6)、NH3、O2投入恒容密闭容器中,分别在不同的温度和催化剂下进行反应,保持其他初始实验条件不变,经10min测得C3H6气体转化率如图所示。T2温度下两曲线相交,下列说法正确的是___________ (填标号)。

a.相同条件下,催化剂2比催化剂1的效率高
b.在A点时,反应一定未达到平衡
c.增大压强对反应的速率无影响
(4)制丙烯腈的原料之一NH3的化学方程式:N2(g)+3H2(g) 2NH3(g)。
2NH3(g)。
①在恒定温度和恒定压强p(单位:Pa)下进行反应,若N2、H2起始物质的量之比为1∶3,NH3的平衡产率是ω(产率= ×100%),用分压代替物质的浓度,计算平衡常数Kp=
×100%),用分压代替物质的浓度,计算平衡常数Kp=___________ (用含ω、p的计算式表示)。
②反应N2(g)+3H2(g) 2NH3(g)达到平衡时,正、逆反应的速率方程分别为v正=k正p(N2)·p1.5(H2)·p-1(NH3),v逆=k逆pα(N2)·pβ(H2)·pγ(NH3),k正、k逆为速率常数,已知Kp=
2NH3(g)达到平衡时,正、逆反应的速率方程分别为v正=k正p(N2)·p1.5(H2)·p-1(NH3),v逆=k逆pα(N2)·pβ(H2)·pγ(NH3),k正、k逆为速率常数,已知Kp=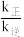 ,据此计算β=
,据此计算β=___________ ,γ=___________ 。
(5)电解丙烯腈(CH2=CHCN)合成已二腈[NC(CH2)4CN]的原理如图所示:

阴极的电极反应式为___________ ;工作时乙室的pH___________ (填“增大”“减小”或“不变”)。
①主反应;C3H6(g)+NH3(g)+
 O2(g)
O2(g) C3H3N(g)+3H2O(g) ΔH1
C3H3N(g)+3H2O(g) ΔH1②副反应:C3H6(g)+O2(g)
 C3H4O(g)+H2O(g) ΔH2=-353kJ·mol-1
C3H4O(g)+H2O(g) ΔH2=-353kJ·mol-1(1)T1时。若只发生反应①,向恒压容器中充入0.2molC3H6、0.2molNH3和0.3molO2达到平衡时,放出51.5kJ能量;若向相同容器中充入lmolC3H3N(g)和3molH2O(g),达平衡时吸收257.5kJ能量,则该反应ΔH1为
(2)T1时,向恒压容器中投入2molC3H3N(g)、6molH2O(g)和不同物质的量的He(g),同时发生反应①和反应②,一段时间建立平衡,随着n(He)的值增大,C3H3N的物质的量
(3)将一定量的丙烯(C3H6)、NH3、O2投入恒容密闭容器中,分别在不同的温度和催化剂下进行反应,保持其他初始实验条件不变,经10min测得C3H6气体转化率如图所示。T2温度下两曲线相交,下列说法正确的是

a.相同条件下,催化剂2比催化剂1的效率高
b.在A点时,反应一定未达到平衡
c.增大压强对反应的速率无影响
(4)制丙烯腈的原料之一NH3的化学方程式:N2(g)+3H2(g)
 2NH3(g)。
2NH3(g)。①在恒定温度和恒定压强p(单位:Pa)下进行反应,若N2、H2起始物质的量之比为1∶3,NH3的平衡产率是ω(产率=
 ×100%),用分压代替物质的浓度,计算平衡常数Kp=
×100%),用分压代替物质的浓度,计算平衡常数Kp=②反应N2(g)+3H2(g)
 2NH3(g)达到平衡时,正、逆反应的速率方程分别为v正=k正p(N2)·p1.5(H2)·p-1(NH3),v逆=k逆pα(N2)·pβ(H2)·pγ(NH3),k正、k逆为速率常数,已知Kp=
2NH3(g)达到平衡时,正、逆反应的速率方程分别为v正=k正p(N2)·p1.5(H2)·p-1(NH3),v逆=k逆pα(N2)·pβ(H2)·pγ(NH3),k正、k逆为速率常数,已知Kp=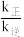 ,据此计算β=
,据此计算β=(5)电解丙烯腈(CH2=CHCN)合成已二腈[NC(CH2)4CN]的原理如图所示:

阴极的电极反应式为
您最近半年使用:0次
7 . 向含 ,
, ,
, 的溶液中滴加KCl溶液,混合液中
的溶液中滴加KCl溶液,混合液中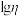 与
与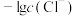 的关系如图所示,其中η代表
的关系如图所示,其中η代表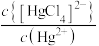 ,
,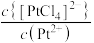 ,
,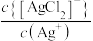 。已知:反应
。已知:反应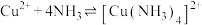 的平衡常数称为稳定常数(
的平衡常数称为稳定常数( ),
),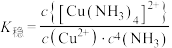 .常温下,
.常温下,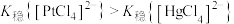 。下列叙述正确的是
。下列叙述正确的是
 ,
, ,
, 的溶液中滴加KCl溶液,混合液中
的溶液中滴加KCl溶液,混合液中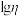 与
与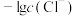 的关系如图所示,其中η代表
的关系如图所示,其中η代表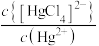 ,
,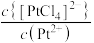 ,
,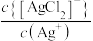 。已知:反应
。已知:反应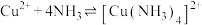 的平衡常数称为稳定常数(
的平衡常数称为稳定常数( ),
),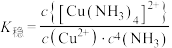 .常温下,
.常温下,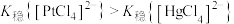 。下列叙述正确的是
。下列叙述正确的是
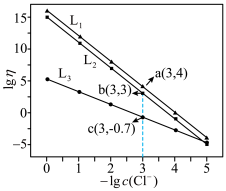
A. 代表 代表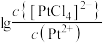 与 与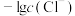 的关系 的关系 |
B.常温下, |
C.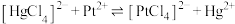 的平衡常数K为10 的平衡常数K为10 |
D.常温下,浓度相同的配离子解离出金属离子的浓度大小: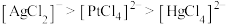 |
您最近半年使用:0次
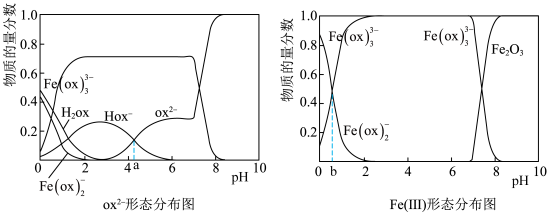
8 . 在一定条件下,用草酸-草酸铵浸出废渣中的Fe2O3,平衡时浸出体系中含草酸根粒子及含Fe(Ⅲ)粒子的形态分布随pH变化如下图所示。下列说法正确的是
已知:①Fe3+和ox2−(代表草酸根)可以生成Fe(ox)+、Fe(ox) 和Fe(ox)
和Fe(ox) 三种配离子。
三种配离子。
②体系中草酸根的总浓度[ox2−]TOT = 4.54 mol/L(按折合成ox2−计)
体系中Fe(Ⅲ)的总浓度[Fe3+]TOT = 1.08 mol/L(按折合成Fe3+计)
已知:①Fe3+和ox2−(代表草酸根)可以生成Fe(ox)+、Fe(ox)
 和Fe(ox)
和Fe(ox) 三种配离子。
三种配离子。②体系中草酸根的总浓度[ox2−]TOT = 4.54 mol/L(按折合成ox2−计)
体系中Fe(Ⅲ)的总浓度[Fe3+]TOT = 1.08 mol/L(按折合成Fe3+计)

A.该条件下,酸性增强Fe(ox) 的物质的量分数增大 的物质的量分数增大 |
B.改变体系中草酸-草酸铵和Fe2O3的量,使[ox2-]TOT / [Fe3+]TOT = 3,体系中Fe(Ⅲ)全部以Fe(ox) 形态存在 形态存在 |
C.Hox− H+ + ox2− Ka2 = 10−a;Fe(ox) H+ + ox2− Ka2 = 10−a;Fe(ox) + ox2− + ox2−  Fe(ox) Fe(ox) K = 10−b K = 10−b |
| D.pH = 4时,c(Hox−) + c(ox2−) ≈ 1.3 mol/L |
您最近半年使用:0次
9 .  与
与 反应合成HCOOH,是实现“碳中和”的有效途径。回答下列问题:
反应合成HCOOH,是实现“碳中和”的有效途径。回答下列问题:
(1)HCOOH中碳原子的杂化类型为______ 。
(2)已知:
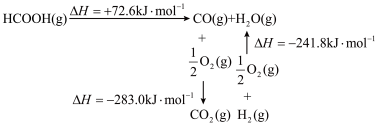
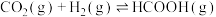
______ 。
(3)在催化作用下,温度为 时,将一定量
时,将一定量 和
和 充入密闭容器中发生如下反应:
充入密闭容器中发生如下反应:
主反应Ⅰ: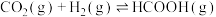

副反应Ⅱ:
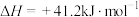 。
。
①下图是不同催化剂电化学还原 生产HCOOH的催化性能及机理,并通过DFT计算催化剂表面该还原过程的物质的相对能量,如图所示(带“*”表示物质处于吸附态)。
生产HCOOH的催化性能及机理,并通过DFT计算催化剂表面该还原过程的物质的相对能量,如图所示(带“*”表示物质处于吸附态)。
电化学还原 生产HCOOH,使用
生产HCOOH,使用______ 作催化剂较优。
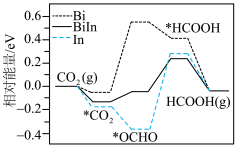
②实验测得反应Ⅰ: ,
, ,
, 、
、 为速率常数。温度为
为速率常数。温度为 时,
时,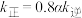 ,则
,则
______  (填“大于”“小于”“等于”),判断依据是
(填“大于”“小于”“等于”),判断依据是______ 。
③实验测得平衡时 的转化率及HCOOH和CO的选择性(产物的选择性:生成的HCOOH或CO与转化的
的转化率及HCOOH和CO的选择性(产物的选择性:生成的HCOOH或CO与转化的 的比值)随温度变化如图所示。
的比值)随温度变化如图所示。
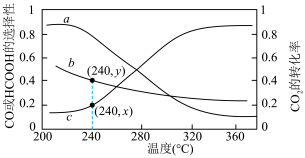
曲线b表示______ ,200℃~360℃,升高温度曲线b对应纵坐标值减小的原因是______ 。240℃时,平衡体系中氢气的分压为 kPa,主反应Ⅰ的
kPa,主反应Ⅰ的
______  (用x、y、
(用x、y、 表示)。
表示)。
 与
与 反应合成HCOOH,是实现“碳中和”的有效途径。回答下列问题:
反应合成HCOOH,是实现“碳中和”的有效途径。回答下列问题:(1)HCOOH中碳原子的杂化类型为
(2)已知:

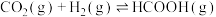
(3)在催化作用下,温度为
 时,将一定量
时,将一定量 和
和 充入密闭容器中发生如下反应:
充入密闭容器中发生如下反应:主反应Ⅰ:
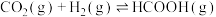

副反应Ⅱ:

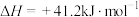 。
。①下图是不同催化剂电化学还原
 生产HCOOH的催化性能及机理,并通过DFT计算催化剂表面该还原过程的物质的相对能量,如图所示(带“*”表示物质处于吸附态)。
生产HCOOH的催化性能及机理,并通过DFT计算催化剂表面该还原过程的物质的相对能量,如图所示(带“*”表示物质处于吸附态)。
电化学还原
 生产HCOOH,使用
生产HCOOH,使用②实验测得反应Ⅰ:
 ,
, ,
, 、
、 为速率常数。温度为
为速率常数。温度为 时,
时,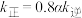 ,则
,则
 (填“大于”“小于”“等于”),判断依据是
(填“大于”“小于”“等于”),判断依据是③实验测得平衡时
 的转化率及HCOOH和CO的选择性(产物的选择性:生成的HCOOH或CO与转化的
的转化率及HCOOH和CO的选择性(产物的选择性:生成的HCOOH或CO与转化的 的比值)随温度变化如图所示。
的比值)随温度变化如图所示。
曲线b表示
 kPa,主反应Ⅰ的
kPa,主反应Ⅰ的
 (用x、y、
(用x、y、 表示)。
表示)。
您最近半年使用:0次
10 . Sabatier反应是CO2和H2在一定的温度、压强和适宜的催化剂等条件下发生反应生成甲烷和水。其反应经过如下两个过程:
i.
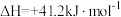
ii.
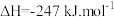
回答下列问题:
(1)若在恒温恒容的密闭容器中充入1 mol CO2、1molH2,仅发生Sabatier反应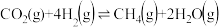 。下列说法能够说明达到平衡状态的是
。下列说法能够说明达到平衡状态的是___________ (填字母);试写出1条能够提高CH4产率的措施:___________ 。
a.混合气体的平均相对分子质量不变
b.CO2的物质的量分数不变
c.混合气体的密度不变
d.生成CO2的速率等于生成CH4的速率
(2)在T℃、10L恒容容器中投入5 mol CO2、5molH2,在催化剂作用下发生反应i、ii.达到平衡时测得体系中含有a mol CH4、b mol H2,则此时含有CO2、CO、H2O的物质的量分别为___________ mol、___________ mol、___________ mol(分别用含a、b的表达式表示)。
(3)研究得出Ni/La2O3催化作用下Sabatier反应的正反应的活化能为249.8kJ·mol-1,则Sabatier反应的逆反应的活化能为___________ kJ·mol-1。
(4)某恒容密闭容器中,H2与CO2的投料比为4:1,发生如下反应:①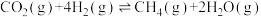 、②
、② 。
。
①CO2的平衡转化率随压强、温度的变化分别为下图表示,CO2的平衡转化率随温度升高先减小后增大的原因是___________ 。
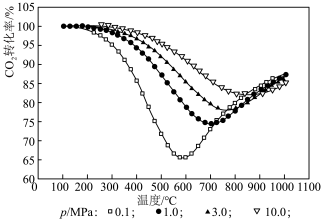
②350℃、0.1Mpa时,CO2的转化率和甲烷的选择性均为90%,则反应 的压强平衡常数为
的压强平衡常数为___________ (写出计算式即可)。
③CH4的生成速率方程为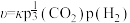 ,则υ(CH4)=
,则υ(CH4)=___________ (选择性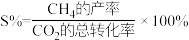 ,用含κ的式子表示,单位可忽略,写出计算式即可)。
,用含κ的式子表示,单位可忽略,写出计算式即可)。
i.

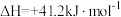
ii.

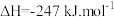
回答下列问题:
(1)若在恒温恒容的密闭容器中充入1 mol CO2、1molH2,仅发生Sabatier反应
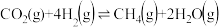 。下列说法能够说明达到平衡状态的是
。下列说法能够说明达到平衡状态的是a.混合气体的平均相对分子质量不变
b.CO2的物质的量分数不变
c.混合气体的密度不变
d.生成CO2的速率等于生成CH4的速率
(2)在T℃、10L恒容容器中投入5 mol CO2、5molH2,在催化剂作用下发生反应i、ii.达到平衡时测得体系中含有a mol CH4、b mol H2,则此时含有CO2、CO、H2O的物质的量分别为
(3)研究得出Ni/La2O3催化作用下Sabatier反应的正反应的活化能为249.8kJ·mol-1,则Sabatier反应的逆反应的活化能为
(4)某恒容密闭容器中,H2与CO2的投料比为4:1,发生如下反应:①
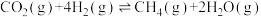 、②
、② 。
。①CO2的平衡转化率随压强、温度的变化分别为下图表示,CO2的平衡转化率随温度升高先减小后增大的原因是

②350℃、0.1Mpa时,CO2的转化率和甲烷的选择性均为90%,则反应
 的压强平衡常数为
的压强平衡常数为③CH4的生成速率方程为
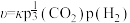 ,则υ(CH4)=
,则υ(CH4)=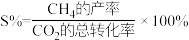 ,用含κ的式子表示,单位可忽略,写出计算式即可)。
,用含κ的式子表示,单位可忽略,写出计算式即可)。
您最近半年使用:0次



