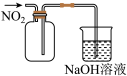
真题
名校
1 . 下列实验操作或装置能达到目的的是
| A | B | C | D |
|
|
|
|
| 混合浓硫酸和乙醇 | 配制一定浓度的溶液 | 收集 气体 气体 | 证明乙炔可使溴水褪色 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-06-09更新
|
9247次组卷
|
42卷引用:《2020年新高考政策解读与配套资源》模拟试题03-2020年北京新高考化学模拟试题
(已下线)《2020年新高考政策解读与配套资源》模拟试题03-2020年北京新高考化学模拟试题(已下线)《2020年新高考政策解读与配套资源》模拟试题12-2020年北京新高考化学模拟试题2019年天津高考化学试题黑龙江省双鸭山市第一中学2018-2019学年高二下学期期末考试化学试题(已下线)专题1.2 物质的量浓度(练)-《2020年高考一轮复习讲练测》(已下线)专题10.1 常见仪器使用和实验基本操作(讲)-《2020年高考一轮复习讲练测》(已下线)专题10.1 常见仪器使用和实验基本操作(练)-《2020年高考一轮复习讲练测》2020届高考化学小题狂练(全国通用版)专练19 化学实验基础专题5.1 化学实验基础(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升天津市南开中学2020届高三第四次月考(线上考试) 化学试题(已下线)第01讲 化学实验基础知识和技能(精讲)——2021年高考化学一轮复习讲练测四川省北大成都附属实验中学2021届高三上学期开学考试化学试题辽宁省沈阳市辽宁省实验中学2020届高三上学期期中考试化学试题西藏山南市第二高级中学2021届高三上学期第一次月考化学试题(已下线)第13单元 化学实验基本操作(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷陕西省宝鸡市陈仓区虢镇中学2020-2021学年高一上学期第一次月考化学试题海南华侨中学观澜湖学校2020届高三上学期第一次月考化学试题甘肃省平凉市庄浪县第一中学2021届高三第四次模拟化学试题江西省南昌县莲塘第一中学2020-2021学年高二上学期期末检测化学试题湖南省名校联盟2021届高三下学期开学考试(新高考)化学试题(已下线)解密11 化学实验(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密11 化学实验(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)2021年高考化学押题预测卷(湖南卷)03(含考试版、答题卡、参考答案、全解全析)(已下线)押全国卷理综第9题 化学实验基础-备战2021年高考化学临考题号押题(课标全国卷)河北省辛集市高中2020-2021学年高二下学期期中考试化学试题(已下线)考点29 化学实验基础-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点28 化学实验仪器与基本操作-备战2022年高考化学一轮复习考点帮(浙江专用)黑龙江省齐齐哈尔三立高级中学2022届高三上学期开学考试化学试题(已下线)课时51 实验仪器的使用及安全操作-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第27讲 常见仪器使用和实验基本操作(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)湖南省永州市祁阳市第四中学2020-2021学年高二下学期期末考试化学试题(已下线)解密11 化学实验基础(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密11 化学实验(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题05 化学基础实验—2022年高考化学二轮复习讲练测(全国版)-练习天津市河西区2022届高考三模化学试题(已下线)考点49 化学实验基础-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第25讲 常见仪器使用和实验基本操作(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)专题13 化学实验基础(已下线)T4-实验方案的设计与评价吉林省长春外国语学校2023-2024学年高三上学期9月月考化学试题湖南省株洲市第一中学2021届高三第一次模拟检测化学试题广东省江门市新会第一中学2023-2024学年高三下学期热身考试化学试题
名校
2 . 以废旧锌锰电池中的黑锰粉(MnO2、MnO(OH)、NH4Cl、少量ZnCl2及炭黑、氧化铁等)为原料制备MnCl2,实现锰的再利用。其工作流程如下:

(1)过程Ⅰ,在空气中加热黑锰粉的目的是除炭、氧化MnO(OH)等。O2氧化MnO(OH)的化学方程式是_______ 。
(2)溶液a的主要成分为NH4Cl,另外还含有少量ZnCl2等。

① 溶液a呈酸性,原因是______ 。
② 根据如图所示的溶解度曲线,将溶液a______ (填操作),可得NH4Cl粗品。
③ 提纯NH4Cl粗品,有关性质数据如下:
根据上表,设计方案提纯NH4Cl:________ 。
(3)检验MnSO4溶液中是否含有Fe3+:取少量溶液,加入_______ (填试剂和现象),证明溶液中Fe3+沉淀完全。
(4)探究过程Ⅱ中MnO2溶解的适宜条件。
ⅰ.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4,固体未明显溶解。
ⅱ.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
① 用化学方程式表示ⅱ中MnO2溶解的原因:________ 。
② 解释试剂加入顺序不同,MnO2作用不同的原因:________ 。
上述实验说明,试剂加入顺序不同,物质体现的性质可能不同,产物也可能不同。

(1)过程Ⅰ,在空气中加热黑锰粉的目的是除炭、氧化MnO(OH)等。O2氧化MnO(OH)的化学方程式是
(2)溶液a的主要成分为NH4Cl,另外还含有少量ZnCl2等。

① 溶液a呈酸性,原因是
② 根据如图所示的溶解度曲线,将溶液a
③ 提纯NH4Cl粗品,有关性质数据如下:
| 化合物 | ZnCl2 | NH4Cl |
| 熔点 | 365℃ | 337.8℃分解 |
| 沸点 | 732℃ | ------------- |
(3)检验MnSO4溶液中是否含有Fe3+:取少量溶液,加入
(4)探究过程Ⅱ中MnO2溶解的适宜条件。
ⅰ.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4,固体未明显溶解。
ⅱ.向MnO2中加入稀H2SO4,固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
① 用化学方程式表示ⅱ中MnO2溶解的原因:
② 解释试剂加入顺序不同,MnO2作用不同的原因:
上述实验说明,试剂加入顺序不同,物质体现的性质可能不同,产物也可能不同。
您最近一年使用:0次
2019-04-04更新
|
1003次组卷
|
5卷引用:【区级联考】北京市朝阳区2019届高三下学期一模考试化学试题
名校
3 . 下列实验或事实中,不能证明CH3COOH是弱电解质的是
| A.常温下,0.1mol/L CH3COOH溶液的pH=3 |
| B.常温下,0.1mol/LCH3COONa溶液的pH=8 |
| C.常温下,向0.1mol/L CH3COOH溶液中加入少量相应的盐CH3COONa(s),溶液pH增大 |
| D.常温下,相同体积相同浓度的盐酸和醋酸分别与足量的镁条反应,产生H2体积(同温同压)相同 |
您最近一年使用:0次
名校
4 . 下列实验方案正确且能达到实验目的的是( )
A. 证明碳酸的酸性比硅酸强 证明碳酸的酸性比硅酸强 |
B. 验证草酸晶体是否含结晶水 验证草酸晶体是否含结晶水 |
C. 检验混合气体中H2S和CO2 检验混合气体中H2S和CO2 |
D. 制备乙酸乙酯 制备乙酸乙酯 |
您最近一年使用:0次
2019-04-15更新
|
688次组卷
|
5卷引用:《2020年新高考政策解读与配套资源》模拟试题07-2020年北京新高考化学模拟试题
(已下线)《2020年新高考政策解读与配套资源》模拟试题07-2020年北京新高考化学模拟试题【全国百强校】西藏自治区拉萨北京实验中学2019届高三下学期第五次月考化学试题【市级联考】辽宁省兴城市2019届高三第九次模拟考试理科综合化学试题四川省泸县第五中学2020届高三上学期第一次月考理综化学试题黑龙江省哈尔滨市第一中学校2022-2023学年高三上学期12月月考化学试题
5 . 某小组同学研究SO2和KI溶液的反应,设计如下实验。
(1)加入淀粉溶液的目的是______ ,为达到相同的目的,还可选用的试剂是______ 。
(2)经检验,II中的浅黄色固体是硫。资料显示,在酸性条件下,SO2和KI溶液反应生成S和I2。
① 在酸性条件下,SO2和KI溶液反应的离子方程式是______ 。
② 针对II中加入淀粉溶液不变色,甲同学提出假设:______ 。为证实该假设,甲同学取II中离心分离后的溶液,加入盐酸酸化的BaCl2溶液,有白色沉淀生成。
③ 乙同学认为甲同学的实验方案不支持上述假设,理由是______ 。
④ 丙同学向1 mL 1 mol·L−1 KCl溶液中加入5滴1 mol·L−1盐酸,通入SO2,无明显实验现象,再加入盐酸酸化的BaCl2溶液,几乎没有白色沉淀。丙同学的实验结论是______ 。
(3)实验表明,I−是SO2转化的催化剂。补全下列离子方程式。
SO2+H2O ===_____ + +
(4)对比实验I和II,推测增大H+的浓度可加快SO2的转化速率。为证实该推测,还需进一步进行实验证明,实验方案是______ 。
| 实验 | 操作 | 现象 |
| I |  | 溶液迅速变为浅黄色,将溶液进行离心分离无固体沉积, 加入淀粉溶液,不变色 |
| II |  | 溶液立即变成深黄色,将溶液进行离心分离有浅黄色固体沉积,溶液黄色变浅,加入淀粉溶液,不变色 |
(2)经检验,II中的浅黄色固体是硫。资料显示,在酸性条件下,SO2和KI溶液反应生成S和I2。
① 在酸性条件下,SO2和KI溶液反应的离子方程式是
② 针对II中加入淀粉溶液不变色,甲同学提出假设:
③ 乙同学认为甲同学的实验方案不支持上述假设,理由是
④ 丙同学向1 mL 1 mol·L−1 KCl溶液中加入5滴1 mol·L−1盐酸,通入SO2,无明显实验现象,再加入盐酸酸化的BaCl2溶液,几乎没有白色沉淀。丙同学的实验结论是
(3)实验表明,I−是SO2转化的催化剂。补全下列离子方程式。
SO2+H2O ===
(4)对比实验I和II,推测增大H+的浓度可加快SO2的转化速率。为证实该推测,还需进一步进行实验证明,实验方案是
您最近一年使用:0次
名校
6 . 某实验小组对FeCl3分别与Na2SO3、NaHSO3的反应进行探究。
【甲同学的实验】
(1)配制FeCl3溶液时,先将FeCl3溶于浓盐酸,再稀释至指定浓度。结合化学用语说明浓盐酸的作用:。
(2)甲同学探究实验I的电极产物______________ 。
①取少量Na2SO3溶液电极附近的混合液,加入______________ ,产生白色沉淀,证明产生了 。
。
②该同学又设计实验探究另一电极的产物,其实验方案为______________ 。
(3)实验I中负极的电极反应式为______________ 。
【乙同学的实验】
乙同学进一步探究FeCl3溶液与NaHSO3溶液能否发生反应,设计、完成实验并记录如下:
(4)乙同学认为刺激性气味气体的产生原因有两种可能,用离子方程式表示②的可能原因。
① Fe3++3
 Fe(OH)3 +3SO2;②
Fe(OH)3 +3SO2;②______________ 。
(5)查阅资料:溶液中Fe3+、 、OH-三种微粒会形成红色配合物并存在如下转化:
、OH-三种微粒会形成红色配合物并存在如下转化:

从反应速率和化学平衡两个角度解释1~30 min的实验现象:______________ 。
(6)解释30 min后上层溶液又变为浅红色的可能原因:______________ 。
【实验反思】
(7)分别对比I和II、II和III,FeCl3能否与Na2SO3或NaHSO3发生氧化还原反应和有关(写出两条)______________ 。
【甲同学的实验】
| 装置 | 编号 | 试剂X | 实验现象 |
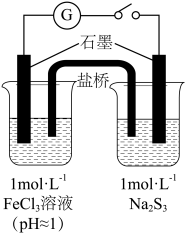 | I | Na2SO3溶液(pH≈9) | 闭合开关后灵敏电流计指针发生偏转 |
| II | NaHSO3溶液(pH≈5) | 闭合开关后灵敏电流计指针未发生偏转 |
(2)甲同学探究实验I的电极产物
①取少量Na2SO3溶液电极附近的混合液,加入
 。
。②该同学又设计实验探究另一电极的产物,其实验方案为
(3)实验I中负极的电极反应式为
【乙同学的实验】
乙同学进一步探究FeCl3溶液与NaHSO3溶液能否发生反应,设计、完成实验并记录如下:
| 装置 | 编号 | 反应时间 | 实验现象 |
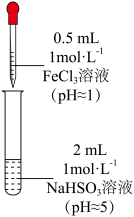 | III | 0~1 min | 产生红色沉淀,有刺激性气味气体逸出 |
| 1~30 min | 沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色 | ||
| 30 min后 | 与空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色 |
① Fe3++3

 Fe(OH)3 +3SO2;②
Fe(OH)3 +3SO2;②(5)查阅资料:溶液中Fe3+、
 、OH-三种微粒会形成红色配合物并存在如下转化:
、OH-三种微粒会形成红色配合物并存在如下转化:
从反应速率和化学平衡两个角度解释1~30 min的实验现象:
(6)解释30 min后上层溶液又变为浅红色的可能原因:
【实验反思】
(7)分别对比I和II、II和III,FeCl3能否与Na2SO3或NaHSO3发生氧化还原反应和有关(写出两条)
您最近一年使用:0次
2019-04-08更新
|
723次组卷
|
3卷引用:【区级联考】北京市海淀区2019届高三一模考试化学试题
7 . 某小组研究AgCl的溶解平衡:向10 mL 1mol/L KCl 溶液中加入1 mL 0.2 mol/LAgNO3溶液,将浑浊液均分为2份,进行如下实验:
已知:AgOH不稳定,立即分解为Ag2O(棕褐色或棕黑色),Ag粉为黑色,AgCl、Ag2O可溶于浓氨水生成Ag(NH3)2+
(1)滤液所属分散系为________ 。
(2)现象ii中无色气泡产生的原因是_________ (写出化学方程式)。
(3)现象iii中,导致产生气泡的速率下降的主要影响因素 是________ 。
(4)甲认为Mg条表面的棕褐色物质中一定有Ag和Ag2O,其中生成Ag的离子方程式为____ 。
(5)甲设计实验检验Ag:取实验I中表面变为棕褐色的Mg条于试管中,向其中加入足量试剂a,反应结束后,继续向其中加入浓硝酸,产生棕色气体,溶液中有白色不溶物。
① 白色不溶物为_____ (填化学式),棕色气体产生的原因是_____ (写离子方程式)。
② 试剂a为________ ,加入试剂a的目的是________ 。
③ 该实验能证明棕褐色物质中一定有Ag的实验现象是________ 。
(6)甲进一步设计实验验证了Mg条表面的棕褐色物质中有Ag2O,实验方案是:取实验I中表面变为棕褐色的Mg条_________ 。
(7)综合上述实验,能说明存在AgCl(s) Ag+(aq) + Cl-(aq)的证据及理由有
Ag+(aq) + Cl-(aq)的证据及理由有________ 。
| 实验序号 | 实验操作 | 实验现象 |
| I | 将其中一份浑浊液过滤,向滤液中放入Mg条 | i. 滤液澄清透明,用激光照射有丁达尔现象。 ii. 放入Mg条后,立即有无色气泡产生,气体可燃,滤液中出现白色浑浊。 iii. 一段时间后开始出现棕褐色浑浊物,Mg条表面也逐渐变为棕褐色,产生气泡的速率变缓慢。 |
| Ⅱ | 向另一份浑浊液中放入大小相同的Mg条 | iv. 棕褐色浑浊物的量明显多于实验I,Mg条表面棕褐色更深,其他现象与ii、iii相同。 |
(1)滤液所属分散系为
(2)现象ii中无色气泡产生的原因是
(3)现象iii中,导致产生气泡的速率下降的主要
(4)甲认为Mg条表面的棕褐色物质中一定有Ag和Ag2O,其中生成Ag的离子方程式为
(5)甲设计实验检验Ag:取实验I中表面变为棕褐色的Mg条于试管中,向其中加入足量试剂a,反应结束后,继续向其中加入浓硝酸,产生棕色气体,溶液中有白色不溶物。
① 白色不溶物为
② 试剂a为
③ 该实验能证明棕褐色物质中一定有Ag的实验现象是
(6)甲进一步设计实验验证了Mg条表面的棕褐色物质中有Ag2O,实验方案是:取实验I中表面变为棕褐色的Mg条
(7)综合上述实验,能说明存在AgCl(s)
 Ag+(aq) + Cl-(aq)的证据及理由有
Ag+(aq) + Cl-(aq)的证据及理由有
您最近一年使用:0次
2019-05-10更新
|
791次组卷
|
4卷引用:【区级联考】北京市丰台区2019届高三下学期5月二模理科综合化学试题
【区级联考】北京市丰台区2019届高三下学期5月二模理科综合化学试题2020届高三化学二轮复习实验题必练-碱土金属及其化合物2020届高三化学二轮复习实验题必练-化学平衡(已下线)专题6.2 实验综合题(必考)(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升
名校
解题方法
8 . 下列实验操作及现象能够达成相应实验目的的是( )
| 实验目的 | 实验操作及现象 | |
| A | 检验某固体物质中含有NH4+ | 取少量固体于试管中,加入少量浓NaOH溶液,加热,试管口放置蓝色石蕊试纸立即变红 |
| B | 证明酸性条件下H2O2的氧化性强于I2 | 向淀粉KI溶液中滴入3滴稀硫酸,未见溶液变蓝;再加入10%的H2O2溶液,溶液立即变蓝色 |
| C | 证明氯的非金属性强于碳 | 将稀盐酸滴到碳酸钙固体上,生成的气体通入盛有澄清石灰水的试管中,出现浑浊 |
| D | 验证氧化性强弱:Cl2>Br2>I2 | 向5mL饱和氯水中滴加少量0.1 mol/L NaBr溶液,溶液由无色变为橙黄色,再滴加少量0.1mol/L淀粉KI溶液,溶液变蓝 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-06-13更新
|
616次组卷
|
5卷引用:【全国百强校】北京四中2018-2019学年高一下学期期中测试化学试题
9 . 下列关于甲烷的叙述中不正确 的是
| A.甲烷是一种无色、难溶于水的气体 |
| B.将甲烷通入酸性高锰酸钾溶液,溶液褪色 |
| C.甲烷只有1种二氯代物,证明它是正四面体结构 |
| D.CH4和Cl2在光照条件下能发生反应,得到多种产物 |
您最近一年使用:0次
2019-06-13更新
|
211次组卷
|
4卷引用:【全国百强校】北京师大附中2018-2019学年高一下学期期中考试化学试题
名校
10 . 实验小组制备高铁酸钾(K2FeO4) 并探究其性质。
资料: K2FeO4 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4 (夹持装置略)

①A为氯气发生装置。A中化学反应的还原剂是_______ 。
②装置B的作用是除杂,所用试剂为___________ 。
③C中得到紫色固体和溶液。C中的反应有:3Cl2 + 2Fe(OH)3+ 10KOH=== 2K2FeO4 + 6KCl+ 8H2O
此反应表明:氧化性Cl2______ FeO42-(填“>”或“<”)。
④C中除了发生③中的反应,还发生化学反应:__________ 。
(2)探究K2FeO4的性质
用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液a。取少量a,滴加盐酸,有Cl2产生。
①此实验可证明氧化Cl-的物质只能是FeO42-。用KOH溶液洗涤的目的是__________ 。
②此实验得出Cl2和FeO42-的氧化性强弱关系与制备实验时得出的结论相反,原因是_______________ 。
资料: K2FeO4 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4 (夹持装置略)

①A为氯气发生装置。A中化学反应的还原剂是
②装置B的作用是除杂,所用试剂为
③C中得到紫色固体和溶液。C中的反应有:3Cl2 + 2Fe(OH)3+ 10KOH=== 2K2FeO4 + 6KCl+ 8H2O
此反应表明:氧化性Cl2
④C中除了发生③中的反应,还发生化学反应:
(2)探究K2FeO4的性质
用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液a。取少量a,滴加盐酸,有Cl2产生。
①此实验可证明氧化Cl-的物质只能是FeO42-。用KOH溶液洗涤的目的是
②此实验得出Cl2和FeO42-的氧化性强弱关系与制备实验时得出的结论相反,原因是
您最近一年使用:0次