名校
1 . 乳酸亚铁晶体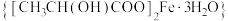 (相对分子质量:288),可由乳酸与
(相对分子质量:288),可由乳酸与 反应制得,它易溶于水,几乎不溶于乙醇,是一种很好的补铁剂,但其水溶液易被氧化,光照可促进氧化。
反应制得,它易溶于水,几乎不溶于乙醇,是一种很好的补铁剂,但其水溶液易被氧化,光照可促进氧化。
Ⅰ.制备碳酸亚铁:装置如图所示。
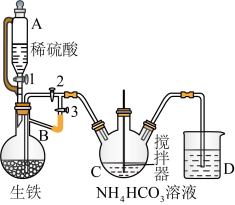
(1)仪器C的名称是_______ 。
(2)该实验使用生铁比纯铁更好,原因为_______ 。
(3)实验操作如下:关闭活塞2,打开活塞1、3,加入适量稀硫酸反应一段时间,其目的是_______ ,然后关闭活塞1,打开活塞2,关闭活塞3,此后,C装置溶液中有沉淀生成,并有大量气泡冒出,则C中发生反应的离子方程式为_______ 。
Ⅱ.制备乳酸亚铁。
(4)向纯净的 固体加入足量乳酸溶液,在75℃下搅拌使之充分反应。该反应的加热方式
固体加入足量乳酸溶液,在75℃下搅拌使之充分反应。该反应的加热方式_______ 。为防止乳酸亚铁变质,在上述体系中还应加入适量_______ 。反应结束后,将所得溶液隔绝空气低温浓缩、降温结晶、过滤、洗涤、干燥,得乳酸亚铁晶体。
Ⅲ.乳酸亚铁晶体纯度的测量。
(5)某同学查阅文献后,用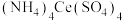 滴定法测定样品中
滴定法测定样品中 的含量并计算样品纯度(反应中
的含量并计算样品纯度(反应中 还原为
还原为 ),他称取6.00 g样品,配制成250.00 mL溶液,取出25.00 mL,用浓度为0.10mol⋅L-1的
),他称取6.00 g样品,配制成250.00 mL溶液,取出25.00 mL,用浓度为0.10mol⋅L-1的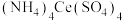 标准溶液滴定至终点,消耗标准液20.00 mL。则产品中乳酸亚铁晶体的纯度为
标准溶液滴定至终点,消耗标准液20.00 mL。则产品中乳酸亚铁晶体的纯度为_______ (保留三位有效数字,以质量分数表示)。
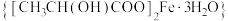 (相对分子质量:288),可由乳酸与
(相对分子质量:288),可由乳酸与 反应制得,它易溶于水,几乎不溶于乙醇,是一种很好的补铁剂,但其水溶液易被氧化,光照可促进氧化。
反应制得,它易溶于水,几乎不溶于乙醇,是一种很好的补铁剂,但其水溶液易被氧化,光照可促进氧化。Ⅰ.制备碳酸亚铁:装置如图所示。

(1)仪器C的名称是
(2)该实验使用生铁比纯铁更好,原因为
(3)实验操作如下:关闭活塞2,打开活塞1、3,加入适量稀硫酸反应一段时间,其目的是
Ⅱ.制备乳酸亚铁。
(4)向纯净的
 固体加入足量乳酸溶液,在75℃下搅拌使之充分反应。该反应的加热方式
固体加入足量乳酸溶液,在75℃下搅拌使之充分反应。该反应的加热方式Ⅲ.乳酸亚铁晶体纯度的测量。
(5)某同学查阅文献后,用
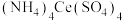 滴定法测定样品中
滴定法测定样品中 的含量并计算样品纯度(反应中
的含量并计算样品纯度(反应中 还原为
还原为 ),他称取6.00 g样品,配制成250.00 mL溶液,取出25.00 mL,用浓度为0.10mol⋅L-1的
),他称取6.00 g样品,配制成250.00 mL溶液,取出25.00 mL,用浓度为0.10mol⋅L-1的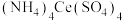 标准溶液滴定至终点,消耗标准液20.00 mL。则产品中乳酸亚铁晶体的纯度为
标准溶液滴定至终点,消耗标准液20.00 mL。则产品中乳酸亚铁晶体的纯度为
您最近一年使用:0次
2022-12-07更新
|
105次组卷
|
2卷引用:安徽省亳州市第二完全中学2022-2023学年高二下学期期末考试化学(A卷)试题
单选题
|
较易(0.85)
|
名校
2 . 下列实验操作所得的现象及结论均正确的是
| 选项 | 实验操作 | 现象及结论 |
| A | 将AlCl3溶液加热蒸干 | 得到白色固体,成分为纯净的AlCl3 |
| B | 将少量Na2SO3样品溶于水,滴加足量盐酸酸化的Ba(NO3)2溶液 | 有白色沉淀产生,则Na2SO3已变质 |
| C | 用量筒量取一定体积的浓硫酸时,仰视读数 | 所量取的浓硫酸体积偏大 |
| D | 向FeI2溶液中通入少量Cl2 | 溶液变黄,则Cl2的氧化性强于Fe3+ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2017-06-02更新
|
440次组卷
|
5卷引用:安徽省涡阳县第一中学2021届高三上学期第二次月考化学试题
3 . 高铁酸钾(K2FeO4)是一种强氧化剂和环境友好型水处理剂,易分解,遇水和酸易变质。学习小组在实验室对高铁酸钾的制备和一些性质进行探究。
回答下列问题:
(1)高铁酸钾的制备。
步骤一:制备Na2FeO4,装置如图1所示。将b中饱和NaOH溶液全部逐滴滴入a中,充分反应;
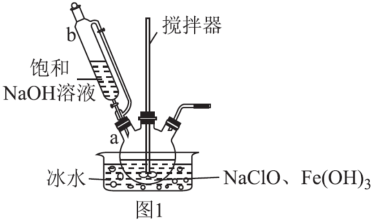
步骤二:由b向a中反应后液体中加入饱和KOH溶液;
步骤三:将a中所得浊液移出,分离提纯。
①仪器b的名称为___ ,其侧管的作用为___ 。
②步骤一中采用冰水浴冷却的目的为___ ;a中制备Na2FeO4反应的离子方程式为___ 。
③步骤二中,能得到K2FeO4悬浊液的原因为___ 。
④K2FeO4悬浊液经过滤、洗涤、提纯,可得产品。其中提纯所用的操作名称为___ 。
(2)K2FeO4遇水转化为Fe(OH)3,则其作水处理剂的优点为___ 。
(3)用图2所示装置检验K2FeO4受热分解的产物。
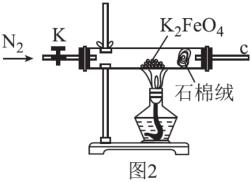
①检验分解的气体产物为O2的操作和现象为___ 。
②设计实验证明完全分解后的固体产物中不含Fe(Ⅱ)___ 。
回答下列问题:
(1)高铁酸钾的制备。
步骤一:制备Na2FeO4,装置如图1所示。将b中饱和NaOH溶液全部逐滴滴入a中,充分反应;

步骤二:由b向a中反应后液体中加入饱和KOH溶液;
步骤三:将a中所得浊液移出,分离提纯。
①仪器b的名称为
②步骤一中采用冰水浴冷却的目的为
③步骤二中,能得到K2FeO4悬浊液的原因为
④K2FeO4悬浊液经过滤、洗涤、提纯,可得产品。其中提纯所用的操作名称为
(2)K2FeO4遇水转化为Fe(OH)3,则其作水处理剂的优点为
(3)用图2所示装置检验K2FeO4受热分解的产物。

①检验分解的气体产物为O2的操作和现象为
②设计实验证明完全分解后的固体产物中不含Fe(Ⅱ)
您最近一年使用:0次
2021-08-28更新
|
554次组卷
|
4卷引用:安徽省亳州市涡阳县育萃高级中学2021-2022学年高二上学期第一次月考化学试题
安徽省亳州市涡阳县育萃高级中学2021-2022学年高二上学期第一次月考化学试题河南部分学校2022届新高三8月份摸底联考化学试题(已下线)3.1.2 不同价态铁元素之间的转化-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)山西省太原市第五十六中学2021-2022学年高三上学期第一次月考化学试题
名校
4 . 某化学兴趣小组模拟“侯氏制碱法”制纯碱并进行后续实验。
I.制备纯碱:先以 和水等为原料,用下图所示装置制取
和水等为原料,用下图所示装置制取 ,然后再将
,然后再将 制备成
制备成 。
。
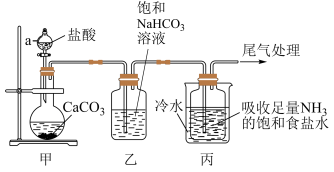
(1)仪器a的名称是___________ ,装置乙的作用是___________ 。
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是 。装置丙中可得两种产物,分别是
。装置丙中可得两种产物,分别是 和另一种盐,装置丙中反应的化学方程式为
和另一种盐,装置丙中反应的化学方程式为___________ 。
(3)用装置丙中产生的 制取
制取 时,需要进行的实验操作有过滤、洗涤、
时,需要进行的实验操作有过滤、洗涤、_________ ,最后一步发生反应的化学方程式为___________ 。
II.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有 ,请选择下列装置设计实验,并完成下表:
,请选择下列装置设计实验,并完成下表:
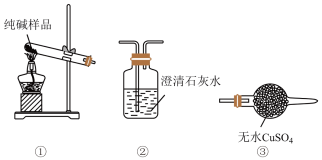
(5)测定该纯碱样品的纯度:称取ag样品,置于小烧杯中,加水溶解,滴加足量 溶液。将反应混合物过滤、洗涤、干燥、称量,得到固体的质量为bg。则该纯碱样品的纯度为
溶液。将反应混合物过滤、洗涤、干燥、称量,得到固体的质量为bg。则该纯碱样品的纯度为___________ (用含有a、b的式子表示)。
I.制备纯碱:先以
 和水等为原料,用下图所示装置制取
和水等为原料,用下图所示装置制取 ,然后再将
,然后再将 制备成
制备成 。
。
(1)仪器a的名称是
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是
 。装置丙中可得两种产物,分别是
。装置丙中可得两种产物,分别是 和另一种盐,装置丙中反应的化学方程式为
和另一种盐,装置丙中反应的化学方程式为(3)用装置丙中产生的
 制取
制取 时,需要进行的实验操作有过滤、洗涤、
时,需要进行的实验操作有过滤、洗涤、II.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有
 ,请选择下列装置设计实验,并完成下表:
,请选择下列装置设计实验,并完成下表:
| 选择的装置连接顺序(填编号) | 实验现象 | 实验结论 |
样品中含 |
(5)测定该纯碱样品的纯度:称取ag样品,置于小烧杯中,加水溶解,滴加足量
 溶液。将反应混合物过滤、洗涤、干燥、称量,得到固体的质量为bg。则该纯碱样品的纯度为
溶液。将反应混合物过滤、洗涤、干燥、称量,得到固体的质量为bg。则该纯碱样品的纯度为
您最近一年使用:0次
5 . “环境就是民生,青山就是美丽、蓝天也是幸福”。回答下列问题:
(1)化肥、炼油、稀土、钢铁等工业都会排放出高浓度的氨氮废水。
①某氮肥厂产生的氨氮废水中的氮元素多以 和
和 形式存在,为达到变废为宝回收利用的目的。可采取的方法是
形式存在,为达到变废为宝回收利用的目的。可采取的方法是___________ 。
②某团队设计处理流程如下:
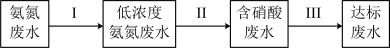
过程Ⅱ为硝化过程,在微生物的作用下实现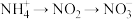 的转化,在碱性条件下被氧气氧化成NO
的转化,在碱性条件下被氧气氧化成NO 的总反应离子方程式为
的总反应离子方程式为___________ ;
过程Ⅲ为反硝化过程,向一定条件下的废水中加入甲醇CH3OH被氧化为CO2)实现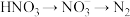 的转化,反应的化学方程式为
的转化,反应的化学方程式为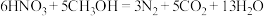 ,氧化产物是
,氧化产物是___________ ,当有1mol硝酸完全转化时,转移的电子数目为___________ 。
(2)磷酸生产及煤燃烧产生的废气SO2等会对大气造成污染。
①为防止工业煤燃烧产生SO2,常向燃煤中加入CaCO3浆状物进行脱硫,脱硫的产物用于制造石膏。脱硫反应的化学方程式为___________ 。也可用NaClO2在酸性条件下氧化处理SO2,反应的离子方程式是___________ 。
②某兴趣小组对取得的酸雨样品进行pH测定,随着时间的推移,得到以下数据(pH越小,酸性越强)。
引起雨水pH变化的主要原因是___________ (用化学方程式表示)。
(3)碳捕集技术是减少二氧化碳排放的一种途径,基本思路是将工业排放的二氧化碳分离出来。若用氢氧化钠溶液吸收二氧化碳,反应后碳酸盐和碳酸氢盐的物质的量比为1∶1,反应的离子方程式为___________ 。
(1)化肥、炼油、稀土、钢铁等工业都会排放出高浓度的氨氮废水。
①某氮肥厂产生的氨氮废水中的氮元素多以
 和
和 形式存在,为达到变废为宝回收利用的目的。可采取的方法是
形式存在,为达到变废为宝回收利用的目的。可采取的方法是②某团队设计处理流程如下:

过程Ⅱ为硝化过程,在微生物的作用下实现
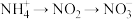 的转化,在碱性条件下被氧气氧化成NO
的转化,在碱性条件下被氧气氧化成NO 的总反应离子方程式为
的总反应离子方程式为过程Ⅲ为反硝化过程,向一定条件下的废水中加入甲醇CH3OH被氧化为CO2)实现
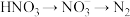 的转化,反应的化学方程式为
的转化,反应的化学方程式为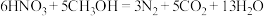 ,氧化产物是
,氧化产物是(2)磷酸生产及煤燃烧产生的废气SO2等会对大气造成污染。
①为防止工业煤燃烧产生SO2,常向燃煤中加入CaCO3浆状物进行脱硫,脱硫的产物用于制造石膏。脱硫反应的化学方程式为
②某兴趣小组对取得的酸雨样品进行pH测定,随着时间的推移,得到以下数据(pH越小,酸性越强)。
| 时间/h | 开始 | 8 | 16 | 24 | 32 | 40 | 48 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
(3)碳捕集技术是减少二氧化碳排放的一种途径,基本思路是将工业排放的二氧化碳分离出来。若用氢氧化钠溶液吸收二氧化碳,反应后碳酸盐和碳酸氢盐的物质的量比为1∶1,反应的离子方程式为
您最近一年使用:0次
名校
解题方法
6 . 亚硝酸钠(NaNO2)是一种工业盐,实验室可用如图装置(略去部分夹持仪器)制备。

已知:
① ;
;
② ;
;
③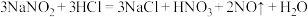 ;
;
④酸性条件下,NO和 都能与
都能与 反应生成
反应生成 和
和 ;
; 能使酸性高锰酸钾溶液褪色。
能使酸性高锰酸钾溶液褪色。
(1)加热装置A前,先通一段时间N2,目的是_______ ;
(2)装置A中发生反应的化学方程式为_______ ;
(3)实验结束后,B瓶溶液中溶质的主要成分是_______ (填化学式)。
(4)仪器C中盛放的药品为_______ (填名称)。
(5)充分反应后,检验装置D中产物的方法是:取产物少许置于试管中,_______ ,则产物是NaNO2 (注明试剂、现象)。
(6)装置F的作用是_______ ;
(7)为测定亚硝酸钠的含量,称取4.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,再向锥形瓶中加入0.1000molL酸性KMnO4溶液20.00mL,两者恰好完全反应。计算所得固体中亚硝酸钠的质量分数_______ 。(写出计算过程)

已知:
①
 ;
;②
 ;
;③
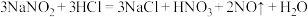 ;
;④酸性条件下,NO和
 都能与
都能与 反应生成
反应生成 和
和 ;
; 能使酸性高锰酸钾溶液褪色。
能使酸性高锰酸钾溶液褪色。(1)加热装置A前,先通一段时间N2,目的是
(2)装置A中发生反应的化学方程式为
(3)实验结束后,B瓶溶液中溶质的主要成分是
(4)仪器C中盛放的药品为
(5)充分反应后,检验装置D中产物的方法是:取产物少许置于试管中,
(6)装置F的作用是
(7)为测定亚硝酸钠的含量,称取4.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,再向锥形瓶中加入0.1000molL酸性KMnO4溶液20.00mL,两者恰好完全反应。计算所得固体中亚硝酸钠的质量分数
您最近一年使用:0次
2021-04-28更新
|
449次组卷
|
4卷引用:安徽省亳州市蒙城第一中学东校区2022-2023学年高三上学期第四次月考化学试题



