名校
1 . 根据实验操作和现象,不能得出相应结论的是
A.未知溶液中滴加 溶液出现不溶于硝酸的白色沉淀,说明该溶液中存在 溶液出现不溶于硝酸的白色沉淀,说明该溶液中存在 或 或 |
| B.将FeNO32样品溶于稀硫酸,滴加KSCN溶液变红,不能说明FeNO32样品溶于稀硫酸前已氧化变质 |
C.将充满 的密闭玻璃球没泡在热水中,红色加深,则 的密闭玻璃球没泡在热水中,红色加深,则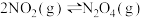 ,△H<0 ,△H<0 |
D.等体积 的 的 和 和 ,分别与足量的 ,分别与足量的 反应, 反应, 放出的氢气多,则酸性: 放出的氢气多,则酸性: |
您最近一年使用:0次
2022-11-03更新
|
202次组卷
|
2卷引用:安徽省宣城中学2023-2024学年高二上学期12月月考化学试题
2 . 某同学用硫铁矿焙烧后的烧渣(主要成分为Fe2O3、SiO2、Al2O3。不考虑其它杂质)制取绿矾(FeSO4· 7H2O),设计了如下流程(部分物质已略去)。
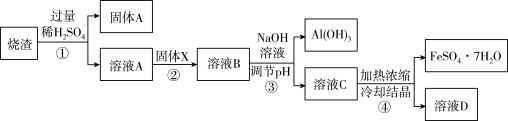
回答下列问题:
(1)硫铁矿的主要成分是FeS2,其中铁元素化合价为_______ ,焙烧产物之一的Fe2O3,俗称________ 。
(2)固体A的主要成分是_______ ,固体X为_________ 。
(3)写出①中Al2O3发生反应的离子方程式:__________ 。
(4)从溶液C到绿矾的过程中,须控制反应条件防止变质,检验其变质所用的化学试剂是________ ,步骤③所得Al(OH)3沉淀含有杂质,应如何洗涤?__________ 。

回答下列问题:
(1)硫铁矿的主要成分是FeS2,其中铁元素化合价为
(2)固体A的主要成分是
(3)写出①中Al2O3发生反应的离子方程式:
(4)从溶液C到绿矾的过程中,须控制反应条件防止变质,检验其变质所用的化学试剂是
您最近一年使用:0次
2020-08-20更新
|
186次组卷
|
3卷引用:安徽省宣城市2019-2020学年高一上学期期末考试化学试题
名校
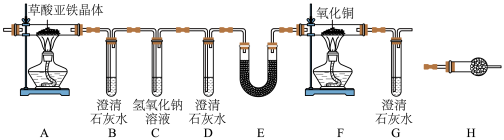
3 . 某实验小组对草酸亚铁晶体(FeC2O4∙xH2O)进行热分解研究时,按下图装置将草酸亚铁晶体样品加热,使其完全分解,对所得气体产物进行探究(装置中各试剂均足量)。_______ 之间(填字母)。
(2)装置E中试剂可以是_______ (填名称)。
(3)若利用上述装置所得数据进行定量分析,存在的明显缺陷是_______ 。
(4)文献显示,FeC2O4∙xH2O受热分解时,固体的质量随温度变化的曲线如下图所示:_______ 。
②从300℃到400℃,隔绝空气加热固体时,发生反应的化学方程式:_______ 。
③从400℃到500℃,在敞口环境中充分加热,C处得到的固体质量为_______ 。
④500℃后,固体质量减小是因为有氧气生成,试写出反应的化学方程式:_______ 。
(2)装置E中试剂可以是
(3)若利用上述装置所得数据进行定量分析,存在的明显缺陷是
(4)文献显示,FeC2O4∙xH2O受热分解时,固体的质量随温度变化的曲线如下图所示:

②从300℃到400℃,隔绝空气加热固体时,发生反应的化学方程式:
③从400℃到500℃,在敞口环境中充分加热,C处得到的固体质量为
④500℃后,固体质量减小是因为有氧气生成,试写出反应的化学方程式:
您最近一年使用:0次
名校
4 . 氯化铁是一种常用的试剂。
(1)配制一定物质的量浓度的 溶液时,取一定量
溶液时,取一定量 溶于浓盐酸中,加水稀释至指定的浓度。盐酸的作用是
溶于浓盐酸中,加水稀释至指定的浓度。盐酸的作用是___________ 。
(2)蒸干 溶液并灼烧所得固体,最终得到的物质是
溶液并灼烧所得固体,最终得到的物质是___________ (填化学式)。
(3)测定 样品的纯度(杂质不参与反应)。
样品的纯度(杂质不参与反应)。
方案1:配合滴定法。
文献资料 已知:溶液中 与EDTA以物质的量之比
与EDTA以物质的量之比 形成稳定的配合物,
形成稳定的配合物, ,其溶液颜色为亮黄色。磺基水杨酸溶于水得到无色溶液,在
,其溶液颜色为亮黄色。磺基水杨酸溶于水得到无色溶液,在 时与
时与 形成红色配合物,可用作滴定
形成红色配合物,可用作滴定 的指示剂。
的指示剂。
实验操作:称取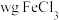 样品溶于盐酸中,稀释成
样品溶于盐酸中,稀释成 溶液,取
溶液,取 配制的溶液于锥形瓶中,滴几滴磺基水杨酸溶液,滴加稀硫酸至
配制的溶液于锥形瓶中,滴几滴磺基水杨酸溶液,滴加稀硫酸至 左右,用
左右,用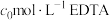 溶液滴定至终点,消耗EDTA溶液V mL。
溶液滴定至终点,消耗EDTA溶液V mL。
①部分滴定操作如下:
A.用待装液润洗滴定管
B.检查滴定管是否漏水
C.加入反应液并排气
D.终点时读数
正确的先后排序为___________ (填字母)。
②达到滴定终点的标志是___________ 。该 样品的纯度为
样品的纯度为___________ %(用含 、V、w的代数式表示)。
、V、w的代数式表示)。
方案2:氧化还原滴定法。
滴定原理:在甲基橙指示剂下,用 溶液(过量)还原
溶液(过量)还原 :
: 。过量的
。过量的 被甲基橙消除,同时甲基橙变色,且甲基橙的还原产物不和
被甲基橙消除,同时甲基橙变色,且甲基橙的还原产物不和 反应:
反应: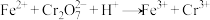 (未配平)。
(未配平)。
实验操作:称取一定量 样品溶于稀盐酸中,滴加几滴甲基橙,滴加
样品溶于稀盐酸中,滴加几滴甲基橙,滴加 溶液至甲基橙变色。用
溶液至甲基橙变色。用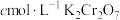 溶液继续滴定至终点,消耗滴定液x mL(在该条件下,滴定剂不氧化氯离子和甲基橙等)。
溶液继续滴定至终点,消耗滴定液x mL(在该条件下,滴定剂不氧化氯离子和甲基橙等)。
③应选择___________ 式滴定管盛放 溶液(填“酸”或“碱”)。
溶液(填“酸”或“碱”)。
④上述氯化铁样品中含___________ 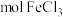 (用含c、x的代数式表示)。
(用含c、x的代数式表示)。
⑤若其他操作均正确,滴定管起始时仰视读数,终点时俯视读数,则测得结果___________ (填“偏高”“偏低”或“无影响”)。
(1)配制一定物质的量浓度的
 溶液时,取一定量
溶液时,取一定量 溶于浓盐酸中,加水稀释至指定的浓度。盐酸的作用是
溶于浓盐酸中,加水稀释至指定的浓度。盐酸的作用是(2)蒸干
 溶液并灼烧所得固体,最终得到的物质是
溶液并灼烧所得固体,最终得到的物质是(3)测定
 样品的纯度(杂质不参与反应)。
样品的纯度(杂质不参与反应)。方案1:配合滴定法。
文献资料 已知:溶液中
 与EDTA以物质的量之比
与EDTA以物质的量之比 形成稳定的配合物,
形成稳定的配合物, ,其溶液颜色为亮黄色。磺基水杨酸溶于水得到无色溶液,在
,其溶液颜色为亮黄色。磺基水杨酸溶于水得到无色溶液,在 时与
时与 形成红色配合物,可用作滴定
形成红色配合物,可用作滴定 的指示剂。
的指示剂。实验操作:称取
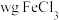 样品溶于盐酸中,稀释成
样品溶于盐酸中,稀释成 溶液,取
溶液,取 配制的溶液于锥形瓶中,滴几滴磺基水杨酸溶液,滴加稀硫酸至
配制的溶液于锥形瓶中,滴几滴磺基水杨酸溶液,滴加稀硫酸至 左右,用
左右,用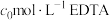 溶液滴定至终点,消耗EDTA溶液V mL。
溶液滴定至终点,消耗EDTA溶液V mL。①部分滴定操作如下:
A.用待装液润洗滴定管
B.检查滴定管是否漏水
C.加入反应液并排气
D.终点时读数
正确的先后排序为
②达到滴定终点的标志是
 样品的纯度为
样品的纯度为 、V、w的代数式表示)。
、V、w的代数式表示)。方案2:氧化还原滴定法。
滴定原理:在甲基橙指示剂下,用
 溶液(过量)还原
溶液(过量)还原 :
: 。过量的
。过量的 被甲基橙消除,同时甲基橙变色,且甲基橙的还原产物不和
被甲基橙消除,同时甲基橙变色,且甲基橙的还原产物不和 反应:
反应: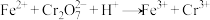 (未配平)。
(未配平)。实验操作:称取一定量
 样品溶于稀盐酸中,滴加几滴甲基橙,滴加
样品溶于稀盐酸中,滴加几滴甲基橙,滴加 溶液至甲基橙变色。用
溶液至甲基橙变色。用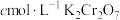 溶液继续滴定至终点,消耗滴定液x mL(在该条件下,滴定剂不氧化氯离子和甲基橙等)。
溶液继续滴定至终点,消耗滴定液x mL(在该条件下,滴定剂不氧化氯离子和甲基橙等)。③应选择
 溶液(填“酸”或“碱”)。
溶液(填“酸”或“碱”)。④上述氯化铁样品中含
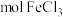 (用含c、x的代数式表示)。
(用含c、x的代数式表示)。⑤若其他操作均正确,滴定管起始时仰视读数,终点时俯视读数,则测得结果
您最近一年使用:0次
解题方法
5 .  常用于制药和食品添加剂。以海带为原料提取高纯度碘单质并制备
常用于制药和食品添加剂。以海带为原料提取高纯度碘单质并制备 的一种流程如下:
的一种流程如下:
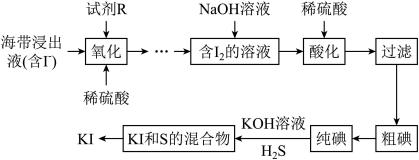
回答下列问题:
(1)“酸化”时稀硫酸的作用是___________ 。
(2)分离 和S的混合物得到
和S的混合物得到 溶液的试剂和方法如下,正确的是
溶液的试剂和方法如下,正确的是___________ (填标号)。
(3)利用下图装置完成 与
与 反应制备
反应制备 。
。

① 溶液的作用是
溶液的作用是___________ (用离子方程式表示)。
②三颈烧瓶中产生 的正确操作顺序为
的正确操作顺序为___________ (填标号)。
a.旋开活塞K,通入 b.加入稀硫酸 c.加入
b.加入稀硫酸 c.加入 溶液
溶液
(4)产品纯度测定。
准确称取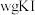 样品溶于水配成
样品溶于水配成 溶液,量取
溶液,量取 溶液于锥形瓶中,加入足量用稀硫酸酸化的
溶液于锥形瓶中,加入足量用稀硫酸酸化的 溶液,摇匀,置于电热板上加热煮沸(常补加热水以保持溶液体积基本不变)。待紫色碘蒸气消失后,再煮沸5分钟,取下放置几分钟,冷却至室温。加入适量的硫酸和磷酸的混合液,用
溶液,摇匀,置于电热板上加热煮沸(常补加热水以保持溶液体积基本不变)。待紫色碘蒸气消失后,再煮沸5分钟,取下放置几分钟,冷却至室温。加入适量的硫酸和磷酸的混合液,用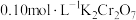 标准溶液反应至完全(还原产物只有
标准溶液反应至完全(还原产物只有 ),消耗标准溶液
),消耗标准溶液 。该
。该 产品的纯度为
产品的纯度为___________ (用含w,V的式子表示)。
 常用于制药和食品添加剂。以海带为原料提取高纯度碘单质并制备
常用于制药和食品添加剂。以海带为原料提取高纯度碘单质并制备 的一种流程如下:
的一种流程如下:
回答下列问题:
(1)“酸化”时稀硫酸的作用是
(2)分离
 和S的混合物得到
和S的混合物得到 溶液的试剂和方法如下,正确的是
溶液的试剂和方法如下,正确的是| 选项 | 试剂 | 方法 |
| a | 二硫化碳 | 分液 |
| b | 酒精 | 分液 |
| c |  溶液 溶液 | 过滤 |
(3)利用下图装置完成
 与
与 反应制备
反应制备 。
。
①
 溶液的作用是
溶液的作用是②三颈烧瓶中产生
 的正确操作顺序为
的正确操作顺序为a.旋开活塞K,通入
 b.加入稀硫酸 c.加入
b.加入稀硫酸 c.加入 溶液
溶液(4)产品纯度测定。
准确称取
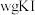 样品溶于水配成
样品溶于水配成 溶液,量取
溶液,量取 溶液于锥形瓶中,加入足量用稀硫酸酸化的
溶液于锥形瓶中,加入足量用稀硫酸酸化的 溶液,摇匀,置于电热板上加热煮沸(常补加热水以保持溶液体积基本不变)。待紫色碘蒸气消失后,再煮沸5分钟,取下放置几分钟,冷却至室温。加入适量的硫酸和磷酸的混合液,用
溶液,摇匀,置于电热板上加热煮沸(常补加热水以保持溶液体积基本不变)。待紫色碘蒸气消失后,再煮沸5分钟,取下放置几分钟,冷却至室温。加入适量的硫酸和磷酸的混合液,用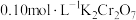 标准溶液反应至完全(还原产物只有
标准溶液反应至完全(还原产物只有 ),消耗标准溶液
),消耗标准溶液 。该
。该 产品的纯度为
产品的纯度为
您最近一年使用:0次
6 . 如图是铜与浓硫酸反应并验证其产物性质的装置图。请回答下列问题。
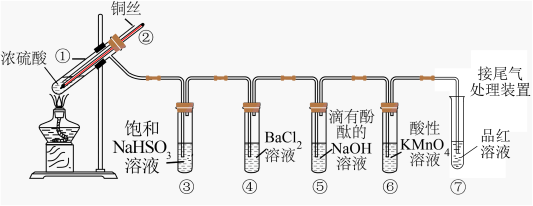
(1)试管①中发生反应的化学方程式为____ ;其中硫酸发生了____ (填“氧化”或“还原”)反应。
(2)一段时间后,④中溶液无明显现象,⑤⑥⑦溶液均褪色,试管⑤⑥⑦中的现象分别说明SO2的水溶液具有____ 、SO2具有____ 、漂白性。
(3)下列说法正确的是____ (填字母)。
a.上下移动铜丝可控制反应的发生与停止
b.反应结束后,从导管向装置中鼓入空气,使气体完全被吸收,防止污染
c.实验结束后,试管①中有白色固体出现,为确认白色固体为产物CuSO4,可立刻向试管①中加水,观察颜色
(4)充分反应后发现,铜丝与硫酸都有剩余,在此情况下,加入下列物质能使溶液中n(Cu2+)变大的是____ (填字母)。
a.HClb.Fe2O3c.KNO3
(5)反应停止后,待装置冷却,向试管④中加入氯水,产生白色沉淀,反应的离子方程式为____ 。
(6)为了测定尾气中SO2的含量,将尾气样品经过管道通入盛有400mL0.1mol·L-1酸性KMnO4溶液的密闭容器中。若管道中气体流量为aL·min-1,经过8min溶液恰好褪色,假定样品中SO2被充分吸收,该尾气样品中SO2的含量为____ g·L-1。(假设尾气中其他气体不与酸性KMnO4溶液反应)

(1)试管①中发生反应的化学方程式为
(2)一段时间后,④中溶液无明显现象,⑤⑥⑦溶液均褪色,试管⑤⑥⑦中的现象分别说明SO2的水溶液具有
(3)下列说法正确的是
a.上下移动铜丝可控制反应的发生与停止
b.反应结束后,从导管向装置中鼓入空气,使气体完全被吸收,防止污染
c.实验结束后,试管①中有白色固体出现,为确认白色固体为产物CuSO4,可立刻向试管①中加水,观察颜色
(4)充分反应后发现,铜丝与硫酸都有剩余,在此情况下,加入下列物质能使溶液中n(Cu2+)变大的是
a.HClb.Fe2O3c.KNO3
(5)反应停止后,待装置冷却,向试管④中加入氯水,产生白色沉淀,反应的离子方程式为
(6)为了测定尾气中SO2的含量,将尾气样品经过管道通入盛有400mL0.1mol·L-1酸性KMnO4溶液的密闭容器中。若管道中气体流量为aL·min-1,经过8min溶液恰好褪色,假定样品中SO2被充分吸收,该尾气样品中SO2的含量为
您最近一年使用:0次
2022-08-24更新
|
77次组卷
|
2卷引用:安徽省宣城市三校2022-2023学年高二上学期期初联考化学试题
7 . 某研究小组为测定软锰矿中MnO2的质量分数,实验步骤如下:准确称取0.5000g软锰矿样品,加入1.34gNa2C2O4再加入足量的稀硫酸并加热(杂质不参加反应),充分反应之后冷却、滤去杂质,将所得溶液全部转移到250mL容量瓶中并定容。取出25.00mL待测液置于锥形瓶中,再用0.0100mol/L KMnO4标准溶液进行滴定,当滴入20.00mLKMnO4溶液时恰好完全反应。(已知KMnO4、MnO2在酸性条件下均能将NaC2O4氧化,且还原产物均为Mn2+。)
(1)配制240mL 0.0100mol/L KMnO4标准溶液,若使用分析天平需要KMnO4固体质量为_______ g(保留4位有效数字),需要使用烧杯、量筒、玻璃棒,还缺少的玻璃仪器为________ (填名称)。
(2)酸化KMnO4溶液可选用的酸是_______ ,KMnO4标准溶液应置于________ (填 “酸式”或“碱式”)滴定管中,原因是_______ 。
(3)KMnO4和Na2C2O4在酸性条件下反应的离子方程式为_______ 。
(4)到达滴定终点的实验现象是________ 。
(5)根据实验数据计算,软锰矿中MnO2的质量分数为_______ %。
(1)配制240mL 0.0100mol/L KMnO4标准溶液,若使用分析天平需要KMnO4固体质量为
(2)酸化KMnO4溶液可选用的酸是
(3)KMnO4和Na2C2O4在酸性条件下反应的离子方程式为
(4)到达滴定终点的实验现象是
(5)根据实验数据计算,软锰矿中MnO2的质量分数为
您最近一年使用:0次



