真题
1 . [实验化学]
3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。①分离出甲醇的操作是的_________ 。
②萃取用到的分液漏斗使用前需_______ 并洗净,分液时有机层在分液漏斗的_____ 填(“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3溶液洗涤的目的是______________ ;用饱和食盐水洗涤的目的是______________ 。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是_____ (填字母)。
a.蒸馏除去乙醚 b..重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先_______ ,再______ 。
3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
| 物质 | 沸点/℃ | 熔点/℃ | 密度(20℃) / g·cm-3 | 溶解性 |
| 甲醇 | 64. 7 |  | 0. 7915 | 易溶于水 |
| 乙醚 | 34. 5 |  | 0. 7138 | 微溶于水 |
| 3,5-二甲氧基苯酚 |  | 33 ~36 |  | 易溶于甲醇、乙醚,微溶于水 |
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。①分离出甲醇的操作是的
②萃取用到的分液漏斗使用前需
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3溶液洗涤的目的是
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是
a.蒸馏除去乙醚 b..重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先
您最近一年使用:0次
2016-12-09更新
|
1542次组卷
|
7卷引用:贵州省榕江县第三高级中学2019-2020学年高二上学期期末考试化学试题
名校
2 . 以天然气为原料合成甲醇,有关热化学方程式如下:
①2CH4(g)+O2(g)==2CO(g)+4H2(g) △H1=-70.8kJ•mol-1
②CO(g)+2H2(g) CH3OH(g) △H2
CH3OH(g) △H2
③2CH4(g)+O2(g) 2CH3OH(g) △H3=-251.0 kJ•mol-1
2CH3OH(g) △H3=-251.0 kJ•mol-1
(1)反应②的△H2=________ kJ•mol-1;
(2)在体积可变的密闭在器中投入1 mol CO和2 mol H2,在不同条件下发生反应:CO(g)+2H2(g) CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强变化如图1所示。
CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强变化如图1所示。

①M 点时,H2 的转化率为_________ ;压强: p1_______ (填“>”“<”或“=”)p2;
②反应速率:N 点v正(CO)_______ (填“>”“<”或“=”)M 点v 逆(CO)
③若压强为p1、在1L恒容密闭容器中进行上述反应(起始投料不变),在不同温度下上述反应的平衡常数的对数(IgK)如图2所示。则温度为506K时,平衡常数K=____________ , B、C、D、E四点中能正确表示该反应的1gK 与T的关系的点为________________ 。
④若在2L恒容密闭容器中充入x (x>0)mol H2、2 mol CO、和8 mol CH3OH(g),在 506 K下进行上述反应。为了使该反应逆向进行,x的范围为________________ 。
(3)某甲醇-空气燃料电池以KOH溶液为电解质溶液。当KOH全部转化成KHCO3时停止放电,写出此时负极的电极反应式______________________________ 。
①2CH4(g)+O2(g)==2CO(g)+4H2(g) △H1=-70.8kJ•mol-1
②CO(g)+2H2(g)
 CH3OH(g) △H2
CH3OH(g) △H2③2CH4(g)+O2(g)
 2CH3OH(g) △H3=-251.0 kJ•mol-1
2CH3OH(g) △H3=-251.0 kJ•mol-1(1)反应②的△H2=
(2)在体积可变的密闭在器中投入1 mol CO和2 mol H2,在不同条件下发生反应:CO(g)+2H2(g)
 CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强变化如图1所示。
CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强变化如图1所示。
①M 点时,H2 的转化率为
②反应速率:N 点v正(CO)
③若压强为p1、在1L恒容密闭容器中进行上述反应(起始投料不变),在不同温度下上述反应的平衡常数的对数(IgK)如图2所示。则温度为506K时,平衡常数K=
④若在2L恒容密闭容器中充入x (x>0)mol H2、2 mol CO、和8 mol CH3OH(g),在 506 K下进行上述反应。为了使该反应逆向进行,x的范围为
(3)某甲醇-空气燃料电池以KOH溶液为电解质溶液。当KOH全部转化成KHCO3时停止放电,写出此时负极的电极反应式
您最近一年使用:0次
3 . 某校课外探究小组欲在实验室条件下制取少量纯净的无水氯化铝。查阅到以下资料:无水氯化铝是白色晶体,易吸收水分,常压下在177.8℃升华,遇潮湿空气即产生大量白雾。用于有机合成和石油工业的催化剂,以及用于处理润滑油等。他们设计了以下装置,请结合题意回答问题:
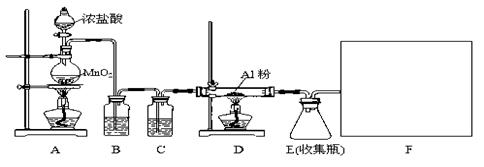
(1)A装置中发生反应的化学方程式为: 。
(2)装置B的作用是 。
(3)请给标记为F的实线方框选择合适的装置 。

(4)AlCl3遇潮湿空气即产生大量白雾的原因是 (结合化学方程式说明)。
(5)有同学认为装置E中有不足之处,存在安全隐患。若你同意他的观点,请指出其不足之处 。
(6)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度,该小组同学提出酸碱中和滴定法测定方案。方案如下:首先准确量取残余清液稀释一定的倍数后作为试样,平行做了4次滴定。实验中所用NaOH溶液浓度为0.2000mol·L-1,以下是实验记录与数据处理(不考虑NaOH与残液中其他成分的反应)。
①经计算,该次滴定测的试样中盐酸浓度为 mol·L-1。
②在本实验的滴定过程中,下列操作会使实验结果偏小的是 (填写序号)。
a.开始滴定时滴定管尖嘴处留有气泡,滴定结束气泡消失
b.未用标准NaOH溶液润洗滴定管
c.锥形瓶中加入待测盐酸后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
e.滴定前锥形瓶用待测盐酸润洗
f.观察读数时,滴定前仰视,滴定后俯视

(1)A装置中发生反应的化学方程式为: 。
(2)装置B的作用是 。
(3)请给标记为F的实线方框选择合适的装置 。

(4)AlCl3遇潮湿空气即产生大量白雾的原因是 (结合化学方程式说明)。
(5)有同学认为装置E中有不足之处,存在安全隐患。若你同意他的观点,请指出其不足之处 。
(6)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度,该小组同学提出酸碱中和滴定法测定方案。方案如下:首先准确量取残余清液稀释一定的倍数后作为试样,平行做了4次滴定。实验中所用NaOH溶液浓度为0.2000mol·L-1,以下是实验记录与数据处理(不考虑NaOH与残液中其他成分的反应)。
| 滴定次数 实验数据ml | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(初读数) | 0.00 | 0.50 | 0.70 | 1.00 |
| V(NaOH)终读数) | 22.60 | 22.55 | 22.65 | 23.00 |
②在本实验的滴定过程中,下列操作会使实验结果偏小的是 (填写序号)。
a.开始滴定时滴定管尖嘴处留有气泡,滴定结束气泡消失
b.未用标准NaOH溶液润洗滴定管
c.锥形瓶中加入待测盐酸后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
e.滴定前锥形瓶用待测盐酸润洗
f.观察读数时,滴定前仰视,滴定后俯视
您最近一年使用:0次
名校
4 . “神十”宇航员使用的氧气瓶是以聚酯玻璃钢为原料。图1中甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料。下列说法错误的是
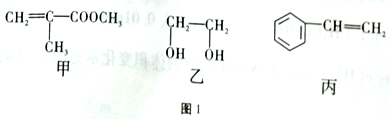

| A.甲物质可以在引发剂作用下通过缩聚生成有机高分子化合物 |
| B.1mol乙物质可与2mol钠完全反应生成1 mol氢气 |
| C.丙物质能够使酸性高锰酸钾溶液褪色 |
| D.乙物质可以在浓硫酸作用下发生消去和取代反应 |
您最近一年使用:0次
名校
5 . 合成气(CO和H2)是目前化工常用的原料,下面是用甲烷制备合成气的两种方法:①CH4(g)+H2O(g) CO(g)+3H2(g) ΔH1=+216 kJ·mol-1;②2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH2=-72 kJ·mol-1。其中一个反应的反应过程与能量变化关系如图所示。则下列说法正确的是
CO(g)+3H2(g) ΔH1=+216 kJ·mol-1;②2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH2=-72 kJ·mol-1。其中一个反应的反应过程与能量变化关系如图所示。则下列说法正确的是
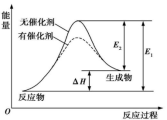
 CO(g)+3H2(g) ΔH1=+216 kJ·mol-1;②2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH2=-72 kJ·mol-1。其中一个反应的反应过程与能量变化关系如图所示。则下列说法正确的是
CO(g)+3H2(g) ΔH1=+216 kJ·mol-1;②2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH2=-72 kJ·mol-1。其中一个反应的反应过程与能量变化关系如图所示。则下列说法正确的是
| A.E1表示2CH4(g)+O2(g)=2CO(g)+4H2(g)的活化能 |
B.E2表示CH4(g)+H2O(g) CO(g)+3H2(g)的活化能 CO(g)+3H2(g)的活化能 |
| C.该图示为反应②的反应过程与能量变化示意图 |
| D.一般情况下,加入催化剂,既能降低E1,也能降低E2,但不能改变E1与E2的差值 |
您最近一年使用:0次
2018-01-20更新
|
459次组卷
|
6卷引用:贵州省安顺市平坝第一高级中学2019-2020学年高二上学期期中考试化学试题
6 . 亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:
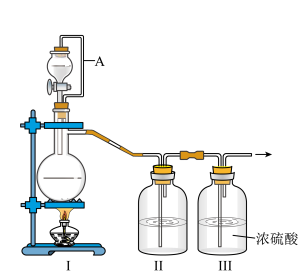
为制备纯净干燥的气体,补充下表中缺少的药品。
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→________________ (按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________________ 。
③装置Ⅶ的作用是________________________________________________________ 。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为______________________ 。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为_______________________________________ 。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:

为制备纯净干燥的气体,补充下表中缺少的药品。
| 装置Ⅰ | 装置Ⅱ | ||
| 烧瓶中 | 分液漏斗中 | ||
| 制备纯净的Cl2 | MnO2 | ① | ② |
| 制备纯净的NO | Cu | ③ | ④ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是
③装置Ⅶ的作用是
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为
您最近一年使用:0次
2017-03-07更新
|
4685次组卷
|
18卷引用:【全国百强校】贵州省遵义航天高级中学2019届高三上学期第四次模拟考试理科综合化学试题
【全国百强校】贵州省遵义航天高级中学2019届高三上学期第四次模拟考试理科综合化学试题福建省莆田第六中学2018届高三上学期期中考试化学试题河北省定州中学2017-2018学年高一(承智班)上学期第二次月考化学试题湖北省荆州中学2018届高三4月月考理综化学试题2017-2018学年第一学期期末复习备考之精准复习模拟题高三化学(单科)(C卷)黑龙江省青冈县一中2017-2018学年高二下学期期末考试化学试题甘肃省甘谷县第一中学2019届高三上学期第二次检测考试化学试题陕西省渭南中学2019届高三上学期第三次质量检测化学试题吉林省吉林市第五十五中学2018-2019学年高二下学期期末考试化学试题专题3.2 非金属及其化合物(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升云南省红河州弥勒市中小学2018-2019学年高二下学期期末考试化学试题高一必修第二册(人教2019版)第五章 素养检测山东省枣庄市2021届高三上学期第三次质量检测化学试题山西省晋城市陵川县高级实验中学2020-2021学年高一下学期3月月考化学试题云南省陆良县2019届高三毕业班第二次教学质量摸底考化学试题黑龙江省七台河市勃利县高级中学2021-2022学年高一下学期期中考试化学试题(已下线)01 以无机物质制备为载体的综合型实验 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)(已下线)题型47 物质制备探究型综合实验
名校
7 . 氨是合成硝酸、铵盐和氮肥的基本原料,在科学技术和生产中有重要的应用。请回答下列问题:
(1)以N2和H2为原料,合成氨气的反应为N2(g)+3H2(g) 2NH3(g) ΔH<0,下列措施可以提高ʋ(正)的是
2NH3(g) ΔH<0,下列措施可以提高ʋ(正)的是_____________ (填序号)。
a.选择适当的催化剂 b.增大压强
c.及时分离生成的NH3 d.降低温度
(2)在恒温条件下,将N2与H2按一定比例混合的气体充人一个体积可变的恒压密闭容器中,p = 5MPa,原气体体积为2L。5分钟后反应达到平衡时,n(N2)=1.0mol,n(H2)=3.0mol,n(NH3)=1.0mol,则反应速率v (N2)=_______ mol/min (用单位时间物质的量变量表示化学反应速率),平衡常数Kp =________ 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)在容积恒定的密闭容器中进行反应2NO(g)+O2(g) 2NO2(g) ΔH>0,该反应的反应速率(v)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是
2NO2(g) ΔH>0,该反应的反应速率(v)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是_____ (填序号)。
a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0~t5时,容器内NO2的体积分数在t3时的值最大
(4)氨和联氨(N2H4)是氨的两种常见化合物,最常见的制备联氨的方法是以丙酮为催化剂,用次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式:_________ 。标况下,每消耗1.12L氨气,转移_________ mol电子。
(5)已知:N2(g)+O2(g)═2NO(g) ΔH=+180.5kJ/mol; N2(g)+3H2(g) 2NH3(g)
2NH3(g)
ΔH=-92.4kJ/mol; 2H2(g) +O2 (g) ═2H2O(g) ΔH=-483.6kJ/mol。
若有34g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为_________ 。
(1)以N2和H2为原料,合成氨气的反应为N2(g)+3H2(g)
 2NH3(g) ΔH<0,下列措施可以提高ʋ(正)的是
2NH3(g) ΔH<0,下列措施可以提高ʋ(正)的是a.选择适当的催化剂 b.增大压强
c.及时分离生成的NH3 d.降低温度
(2)在恒温条件下,将N2与H2按一定比例混合的气体充人一个体积可变的恒压密闭容器中,p = 5MPa,原气体体积为2L。5分钟后反应达到平衡时,n(N2)=1.0mol,n(H2)=3.0mol,n(NH3)=1.0mol,则反应速率v (N2)=
(3)在容积恒定的密闭容器中进行反应2NO(g)+O2(g)
 2NO2(g) ΔH>0,该反应的反应速率(v)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是
2NO2(g) ΔH>0,该反应的反应速率(v)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是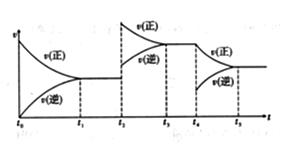
a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0~t5时,容器内NO2的体积分数在t3时的值最大
(4)氨和联氨(N2H4)是氨的两种常见化合物,最常见的制备联氨的方法是以丙酮为催化剂,用次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式:
(5)已知:N2(g)+O2(g)═2NO(g) ΔH=+180.5kJ/mol; N2(g)+3H2(g)
 2NH3(g)
2NH3(g) ΔH=-92.4kJ/mol; 2H2(g) +O2 (g) ═2H2O(g) ΔH=-483.6kJ/mol。
若有34g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为
您最近一年使用:0次
8 . (1)氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g)===CO2(g)+3H2(g)。下图是该反应的能量变化图:
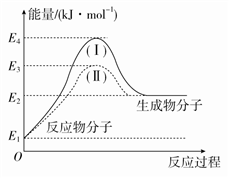
①通过图中信息可判断反应CH3OH(g)+H2O(g)===CO2(g)+3H2(g)的ΔH________ 0(选填“>”“=”或“<”)。
②图中途径(Ⅱ)的条件是__________________ ,途径(Ⅰ)的反应热________ 途径(Ⅱ)的反应热(选填“>”“=”或“<”)。
③在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ。则表示甲醇燃烧热的热化学方程式为__________________________________________ 。
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)===NH2CO2NH4(s) ΔH=-159.5 kJ/mol
②NH2CO2NH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+116.5 kJ/mol
③H2O(l)===H2O(g) ΔH=+44.0 kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式__________________ 。

①通过图中信息可判断反应CH3OH(g)+H2O(g)===CO2(g)+3H2(g)的ΔH
②图中途径(Ⅱ)的条件是
③在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ。则表示甲醇燃烧热的热化学方程式为
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)===NH2CO2NH4(s) ΔH=-159.5 kJ/mol
②NH2CO2NH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+116.5 kJ/mol
③H2O(l)===H2O(g) ΔH=+44.0 kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式
您最近一年使用:0次
2017-09-08更新
|
377次组卷
|
2卷引用:【全国百强校】贵州省铜仁市思南中学2018-2019学年高二上学期第一次月考化学试题
9 . 研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为_____________ 。元素Mn与O中,第一电离能较大的是_________ ,基态原子核外未成对电子数较多的是_________________ 。
(2)CO2和CH3OH分子中C原子的杂化形式分别为__________ 和__________ 。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为_________________ ,原因是______________________________ 。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在________ 。
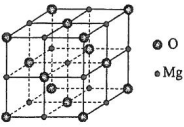
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为________ nm。MnO也属于NaCl型结构,晶胞参数为a' =0.448 nm,则r(Mn2+)为________ nm。
(1)Co基态原子核外电子排布式为
(2)CO2和CH3OH分子中C原子的杂化形式分别为
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420 nm,则r(O2-)为

您最近一年使用:0次
2017-08-08更新
|
8074次组卷
|
19卷引用:贵州省铜仁市思南中学2021届高三上学期第二次月考化学试题
贵州省铜仁市思南中学2021届高三上学期第二次月考化学试题2017年全国普通高等学校招生统一考试理综化学(新课标Ⅲ卷精编版)广东省广州市执信中学2018届高三上学期期中考试理综化学试题(已下线)【中等生百日捷进提升系列-基础练测】专题2.17 物质结构与性质(已下线)【艺体生文化课百题突围系列-基础练测】专题2.17 物质结构与性质(选修)(已下线)《考前20天终极攻略》5月30日 物质结构与性质(已下线)解密21 物质的结构与性质(教师版)——备战2018年高考化学之高频考点解密步步为赢 高二化学暑假作业:作业十四 物质结构与性质(选修3)(已下线)2019年6月29日《每日一题》选修3—— 周末培优四川省南充市阆中中学2018-2019学年高二6月月考理科综合化学试题江西省临川一中2020届上学期第二次联合考试化学试题2020届湖南省湘潭市高三教学质量监测卷化学试题河北省衡水中学2020届高三下学期二月份网络教学质量监测理科综合化学试题宁夏海原县第一中学2019-2020学年高二下学期第一次月考化学试题陕西省榆林市绥德县绥德中学2020届高三第六次模拟考试化学试题河北省张家口市宣化区宣化第一中学2021届高三上学期10月月考化学试题(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练陕西省西安市高新第一中学2020届高三教学质量监测理综化学试题云南省玉溪第三中学2021-2022学年高三下学期3月入学考试理综化学试题
解题方法
10 . Ⅰ:为了减少CO的排放,某环境研究小组以CO和H2为原料合成清洁能源二甲醚(DME),反应如下:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g) ∆H=-198kJ/mol。
CH3OCH3(g)+H2O(g) ∆H=-198kJ/mol。
(1)如图所示能正确反映平衡常数K随温度变化关系的曲线是_______ (填曲线标记字母),其判断理由是_______ 。

(2)在一定温度下,向2.0L固定的密闭容器中充入2molH2和1molCO,经过一段时间后,反应4H2(g)+2CO(g) CH3OCH3(g)+ H2O(g) 达到平衡。反应过程中测得的部分数据见下表:
CH3OCH3(g)+ H2O(g) 达到平衡。反应过程中测得的部分数据见下表:
①0~20min的平均反应速率v(CO)=_______ mol/(L·min);
②达平衡时,H2的转化率为:_______ ;
③在上述温度下,向平衡后的2L容器中再充入0.4molH2和0.4molCH3OCH3(g),则化学平衡_______ (向“正向”、“逆向”或“不”)移动。
(3)用Li2CO3和Na2CO3的熔融盐混合物作为电解质,CO为负极燃气,空气与CO2的混合气体作为正极助燃气,制得在650℃工作的燃料电池,则负极反应式为:_______ ,当燃料电池的电路中有0.2NA个电子发生转移,则标况下生成_______ 升CO2。
(4)Ⅱ:(4)已知在25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2 ]=2.2×10-20,在25℃下,向浓度均为0.1mol/L的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成_______ 沉淀(填化学式),生成该沉淀的离子方程式为_______ 。
 CH3OCH3(g)+H2O(g) ∆H=-198kJ/mol。
CH3OCH3(g)+H2O(g) ∆H=-198kJ/mol。(1)如图所示能正确反映平衡常数K随温度变化关系的曲线是

(2)在一定温度下,向2.0L固定的密闭容器中充入2molH2和1molCO,经过一段时间后,反应4H2(g)+2CO(g)
 CH3OCH3(g)+ H2O(g) 达到平衡。反应过程中测得的部分数据见下表:
CH3OCH3(g)+ H2O(g) 达到平衡。反应过程中测得的部分数据见下表:| 时间/min | 0 | 20 | 40 | 80 | 100 |
| n(H2)/mol | 2.0 | 1.4 | 0.85 | 0.4 | — |
| n(CO) /mol | 1.0 | — | 0.425 | 0.2 | 0.2 |
| n(CH3OCH3) /mol | 0 | 0.15 | — | — | 0.4 |
| n(H2O) /mol | 0 | 0.15 | 0.2875 | 0.4 | 0.4 |
①0~20min的平均反应速率v(CO)=
②达平衡时,H2的转化率为:
③在上述温度下,向平衡后的2L容器中再充入0.4molH2和0.4molCH3OCH3(g),则化学平衡
(3)用Li2CO3和Na2CO3的熔融盐混合物作为电解质,CO为负极燃气,空气与CO2的混合气体作为正极助燃气,制得在650℃工作的燃料电池,则负极反应式为:
(4)Ⅱ:(4)已知在25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2 ]=2.2×10-20,在25℃下,向浓度均为0.1mol/L的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
您最近一年使用:0次



